甘肃荒漠地区野生白刺的组织培养
张艳萍等
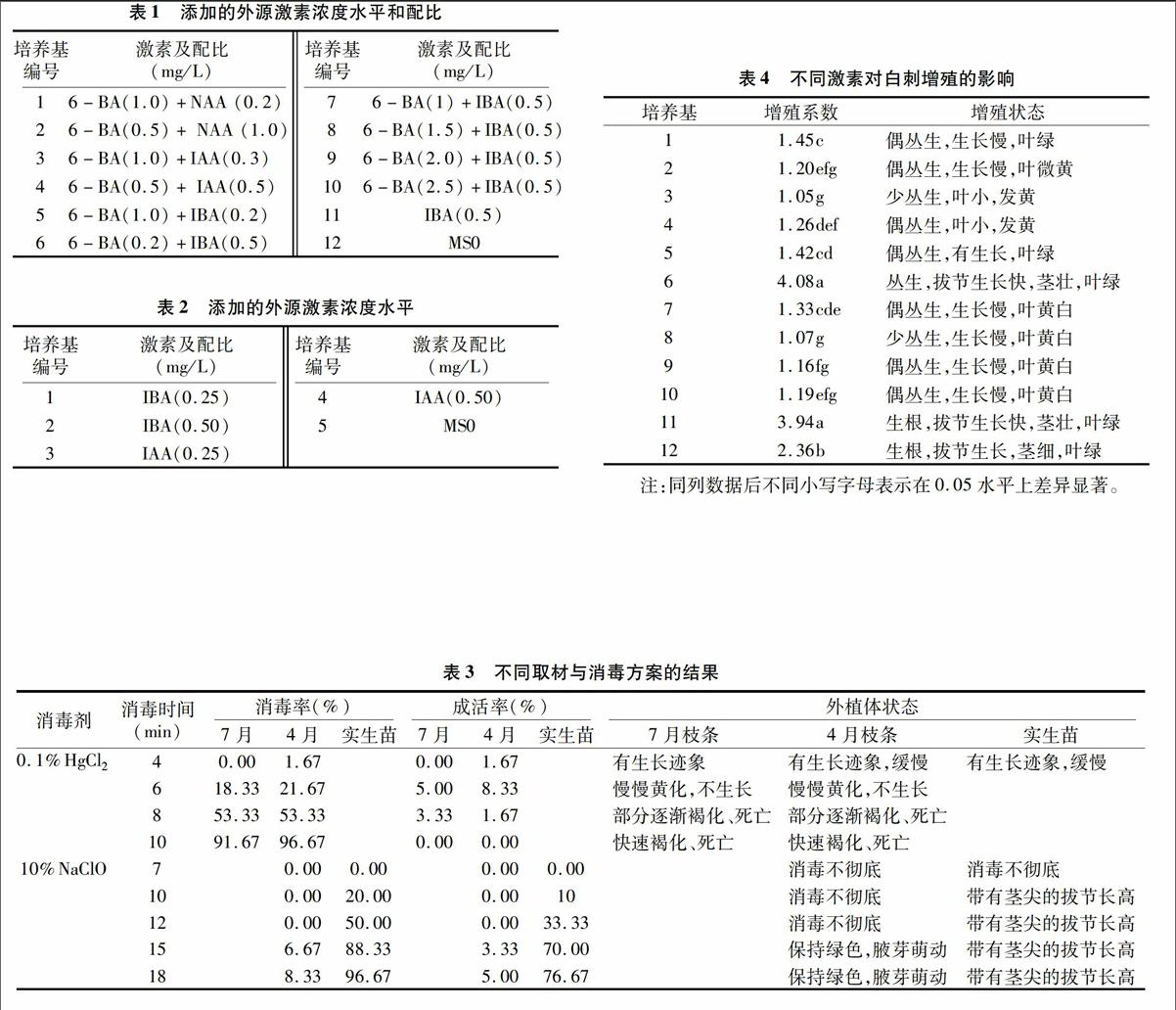

摘要:以荒漠野生白刺作为试验材料,研究不同消毒方式对白刺茎段无菌外植体建立的影响及不同激素、不同浓度组合对野生白刺试管苗增殖和生根的影响。结果表明:选取室内种子萌发的实生苗茎段为外植体,用10% NaClO 消毒15~18 min可以获得理想的成活率;适宜的增殖培养基是MS+0.2 mg/L 6-BA+0.5 mg/L IBA或MS+0.5 mg/L IBA;比较适宜的生根培养基是1/2 MS+0.5 mg/L IBA。不添加激素的简化培养基MS0对白刺也有较为理想的增殖和生根效果。
关键词:甘肃;荒漠地区;野生白刺;增殖;生根;组织培养
中图分类号: S580.4文献标志码: A文章编号:1002-1302(2015)09-0080-03
收稿日期:2014-09-12
基金项目:国家农村领域科技计划 (编号:2012BAD16B0303)。
作者简介:张艳萍(1978—),女,甘肃武威人,助理研究员,主要从事分子生物学、病毒检测以及中药材组培研究。E-mail:64929217@qq.com。
通信作者:董治宝。E-mail:zbdong@lzb.ac.cn。当前,全球盐碱地面积已达9.5亿hm2 [1],其中我国盐碱土地资源约为0.99亿 hm2,其中现代盐碱土面积为0.37亿hm2,残余盐碱土约0.45亿hm2,并且尚存在有约0.173亿hm2的潜在盐碱土[2]。大面积盐碱地、荒漠地的开发利用对环境的改善具有重要的现实意义。白刺(Nitraria L.),灌木,蒺藜科,全世界有12个种,我国有 8个种,甘肃有5种 [3],其根系发达,具有很强的防风固沙、抗旱、抗盐碱、耐热、耐土壤瘠薄和耐沙埋能力,可明显改良土壤物理性状,提高土壤肥力[4]。此外,白刺根寄生的锁阳(Cynomorium songaricum Rupr)为传统名贵的温补药材[5],白刺果含多种营养成分和丰富的微量元素,具有极高的营养和药用价值[6]。近年来,从野生植物资源中寻找新的、潜在的药食同源植物,已成为国内外学者研究的热点,而沙生植物白刺则是经过长期的自然筛选而保留下来的优胜者之一,白刺因其顽强的生命力和优良的遗传基因而受到沙区人们的喜爱[7]。然而据调查,白刺种间杂交混乱,分化严重[8],同时随着自然环境的严重恶化和人为的大幅度破坏,白刺出现了不同程度的退化,大面积死亡或生长不良,结实率下降或不结实,使得这一特殊野生资源的种群繁衍面临着严重的威胁[9]。因此,为可持续利用这一野生资源,保持其优良性状的稳定性,采用离体繁育技术就成为重要途径之一。
目前,较多学者对白刺进行过多方面的研究[10-14],其中关于白刺组培再生方面的研究已有不少[15-18],发现不同品种的白刺分化增殖所需的激素种类差异很大。西伯利亚白刺和唐古特白刺需要6-BA和IBA的浓度与配比存在很大差异[16,19],添加一定量的IAA和GA更有利于天津野生白刺的增殖。可见,不同区域品种的基因型不同,所需激素不同,这是组培研究工作中普遍存在的问题[20-21]。本试验以甘肃荒漠野生白刺为材料,对其组培快繁进行研究,以期建立一套甘肃地区野生白刺较为简易的组培方法,为白刺的离体繁育提供参考。
1材料与方法
1.1试验材料
试验材料为荒漠野生白刺,采自甘肃省酒泉市巴丹吉林沙漠边缘,地理坐标为39°44′N、98°31′E,海拔1 000~1 500 m。于2012年7月和2013年4月先后2次采样,第1次于2012年7月下旬采摘的带果实枝条,冰盒内带回实验室,剪取顶端幼嫩枝条备用,同时采摘果实收集种子备用;第2次于2013年4月下旬,剪取当年旺盛新枝,冰盒内带回实验室备用。2次采样均为同株野生白刺枝条。
实生苗获得:2013年2月,将收集的野生白刺种子种于温室花盆内,即可获得实生苗。
1.2试验方法
1.2.1取材和消毒处理取7月和4月野外白刺单株茎段,流动自来水冲洗30 min,放于超净工作台,用75%乙醇消毒30 s,0.1%氯化汞处理4、6、8、10 min;取4月野外采集的茎段和种子发芽得到实生苗的茎段,流动自来水冲洗30 min,放于超净工作台,用75%乙醇消毒30 s,10%次氯酸钠处理7、10、12、15、18 min。消毒剂处理完之后,用无菌水冲洗4~5次,接于MS培养基上,在温度(25±2) ℃、光照强度2 000 lx、光照周期16 h/d下培养1周,统计消毒率和无菌苗成活率。
1.2.2增殖培养基筛选取启动培养获得的无菌苗茎段,接种于添加不同激素浓度配比的MS培养基中,激素浓度水平和组合见表1。以简化MS培养基为对照,简化培养基以自来水配置,市售白糖代替蔗糖,简写为MS0。60 d后调查增殖系数。
1.2.3生根诱导将切取的单芽茎段,接种于添加不同浓度IBA和IAA的1/2MS培养基中,进行生根诱导,浓度水平和组合见表2,以简化培养基MS0作对照。记录生根时间,40 d
1.3数据处理
数据用Excel 2003进行整理,用DPS 7.0进行数据分析。
2结果与分析
2.1不同取材与消毒方法对启动培养的影响
7月和4月在荒漠取的枝条,采用第1种消毒方案,随着消毒时间的增加消毒率呈逐渐上升趋势,成活率呈先微升后降趋势(表3)。2个时期采摘的枝条活性均较弱(表3),消毒时间在8~10 min时,外植体基本褐化死亡,消毒时间在4~6 min 时,消毒不彻底,外植体污染严重。0.1%氯化汞处理10 min时,消毒率最高,7月下旬和4月上旬采取的枝条,消毒率分别高达91.67%和96.67%,可相对应的成活率却都为0;消毒6 min时,2个时期的枝条成活率达到了各自的最高值,分别仅为5%和8.33%,相对应的消毒率分别为1833%和21.67%。

