基于香豆素的银离子化学传感器的合成与性能研究
尹凯,余柱,骆早利,李焰,任君
(湖北大学化学化工学院,湖北 武汉 430062)
0引言
随着工业化程度不断增加、环境污染日益严重以及人类对生态环境要求的提高,发展能快速高效地检测环境和生态系统中的重金属离子已经成为一个重要的研究领域.银作为一种重要的工业原料,已被广泛地应用于催化技术、电子成像和感光技术以及医药行业[1-2].由于工业生产中对银离子使用量的飞速增长,大量的银化合物被违规排放.然而,银离子与蛋白质中的氨基、咪唑、羧基和巯基有较强的配合能力,人体过量地摄入会导致体内蛋白质失活、机体免疫力下降[3].另外,银纳米材料产生的活性氧,会抑制水生物的生长和再生能力[4].
原子吸收光谱法[5]、电感耦合等离子体原子发射光谱[6]以及伏安法[7]等传统的方法已经被应用于检测环境中的银离子.虽然这些方法能进行定量的检测,但是复杂的仪器设备、繁琐的样品预处理过程和昂贵的测试费用大大降低了它们的应用价值.因此,研究高选择性和高灵敏度的银离子化学传感器具有十分重要的意义.本文中设计合成了一种以香豆素[8]为发色基团,以含氮、硫原子的冠醚为识别基团的化学传感器S1,实验结果表明S1对银离子有很好的选择性和较高的灵敏度.
1 实验部分
1.1 试剂和仪器试剂:3-氨基苯酚(AR级,阿拉丁试剂);丙二酸二乙酯(AR,阿拉丁试剂);哌啶(AR级,阿拉丁试剂);氢氧化钠(AR,天津博迪化工股份有限公司);三氯氧磷(AR级,国药集团上海化学试剂公司);碳酸钙(AR,天津博迪化工股份有限公司);乙醇(AR,国药集团上海化学试剂公司);N,N-二甲基甲酰胺(AR,国药集团上海化学试剂公司);四氢呋喃(AR,国药集团上海化学试剂公司);碳酸铯(AR,阿拉丁试剂);其他试剂均为市售分析纯,使用前未经纯化.
仪器:核磁用美国VARIAN Unity INOVA(600MHz)和中国科学院WIPM(400MHz)核磁共振波谱仪测定,指定氘代试剂为溶剂,TMS为内标;紫外可见光谱用日本Shimadzu UV-3100型紫外可见光谱仪测定;熔点采用北京泰克仪器有限公司的显微熔点仪X-6测定.

Scheme 1 化合物S1的合成路线
1.2 合成步骤
1.2.1 3-二(2-羟基乙基)氨基苯酚的合成[9]将3-氨基苯酚(3.3 g,30.2mmol),2-氯乙醇(21mL,0.31 mol),碳酸钙(7 g,70mmol)和碘化钾(300mg,1.8mmol)依次加入200mL水中,在氮气保护下,剧烈搅拌回流18 h.反应完成后冷却至室温,过滤,所得滤液用乙酸乙酯(60mL×5)萃取,有机相用无水硫酸镁干燥,旋蒸除去溶剂得油状粗产品,经硅胶柱层析分离提纯,得橙色油状物1.91 g,收率33.1%.1H-NMR(400MHz,DMSO-d6):δ=8.95(s, OH,1H),6.89(t,J=7.2 Hz,1H),6.10(m,Ar H,2H),5.95(d,J=7.2 Hz,1H),4.76(t,J=5.0Hz,2H),3.51(m,4H),3.34(t,J=6.2Hz,4H).
1.2.2 4-二(2-氯乙基)氨基-2-羟基苯甲醛的合成[9]在0℃下,将三氯氧磷(1.80mL,19.0mmol)滴加到3mL无水DMF中,滴加完成后继续搅拌20min.然后将3-二(2-羟基乙基)氨基苯酚(1.08 g,5.5mmol)的DMF溶液(3mL)加入上述反应液中,所得混合液加热至75℃反应2 h.反应完成后将反应液冷却至室温,倒入50mL的冰水中,用2mol·L-1的氢氧化钠溶液调节pH=6~7,搅拌2 h后混合液用乙醚萃取,所得有机相用无水硫酸镁干燥,旋蒸除去溶剂,所得固体经硅胶柱层析分离提纯,得目标产物1.06 g,收率73.6%.1H NMR(400 MHz,CDCl3):δ=11.53(s, OH,1H),9,59(s, CHO,1H),7.36(d,J=8.8 Hz,1H),6.31(dd,J=8.8 and 2.0Hz,1H),6.13(d,J=2.0Hz,1H),3.81(t,J=6.8Hz,4H),3.67(t,J=6.8Hz,4H).
1.2.3 7-二(2-氯乙基)氨基-3-乙氧羰基香豆素的合成[9]将(0.5mL,5mmol)哌啶加入4-二(2-氯乙基)氨基-2-羟基苯甲醛(1.25 g,4.8mmol)和丙二酸二乙酯(0.72mL,4.8mmol)的乙醇溶液(12mL)中,室温下搅拌2 h,有黄色沉淀生成,旋干溶剂,粗产品经硅胶柱层析分离提纯,得目标产物1.48 g,产率86.0%.1H NMR(600MHz,CDCl3):δ=8.46(s,phCH,1H),7.45(d,J=9.0Hz,1H),6.67(dd,J=9.0 and 1.8Hz,1H),6.54(d,J=1.8Hz,1H),4.39(q,J=7.2Hz,2H),3.86(t,J=6.6Hz,4H),3.69(t,J=6.6Hz,4H),1.40(t,J=7.2Hz,3H).
1.2.4 传感器S1的合成[10]于500mL三颈烧瓶中,将碳酸铯(3 g,9.17mmol)加入300mL无水四氢呋喃中,搅拌1.5 h,然后将7-二(2-氯乙基)氨基-3-乙氧羰基香豆素(3.26mmol)和3,6-二氧-1,8-辛二硫醇(0.594 g,3.26mmol)的无水四氢呋喃溶液(70mL)滴入上述混合液中.在75℃下,氮气保护,反应4 d后将反应液过滤,所得滤液旋蒸除去溶剂得到粗产品,经硅胶柱层析分离提纯,得黄色固体S1(517mg),产率36.2%.mp:162~165 ℃.1H NMR(600MHz,CDCl3):J=8.42(s,1H),7.36(d,J=8.4 Hz,1H),6.58(d,J=8.4 Hz,1H),6.45(s,1H),4.36(q,J=7.2 Hz,2H),3.79(t,J=5.0 Hz, SCH2CH2O ,4H),3.72(t,J=8.0 Hz, SCH2CH2N ,4H),3.63(s, OCH2CH2O ,4H),2.89(t,J=8.0Hz, SCH2CH2O ,4H),2.75(t,J=5.0 Hz, SCH2CH2N ,4H),1.38(t,J=7.2 Hz,3H).13CNMR(150 MHz,CDCl3):J=164.2,158.4,158.2,152.6,149.3,131.2,110.1,109.9,108.4,97.6,74.5,70.8,61.4,52.5,31.8,29.5,14.5.
2 结果与讨论
2.1 UV-vis光谱该实验中使用的有机试剂均为分析纯试剂,水为去离子水.所有测试均在EtOH-H2O(1∶1,体积分数)中进行.为了研究传感器S1对不同金属离子的选择性识别,取18份等体积的传感器S1的乙醇溶液(2×10-5mol·L-1),分别加入2×10-4mol·L-1的17种阳离子(Mn2+、Co2+、Ni2+、Cu2+、Al3+、Ca2+、Cd2+、Ag+、Ba2+、Hg2+、Sr2+、K+、Mg2+、Li+、Fe3+、Pb2+和Zn2+)以及等体积的去离子水,扫描上述18种混合液的UV-vis吸收光谱,结果如图1所示.只有加入Ag+后传感器S1的UV-vis吸收光谱有明显变化;而在相同条件下加入其他离子,UV-vis吸收光谱没有明显变化.说明在上述17种阳离子中,传感器S1对Ag+有很好的选择性识别作用.加入Ag+后最大吸收波发生蓝移以及吸光常数减弱的原因可能是由于银离子与冠醚上的氮原子络合,从而降低了氮原子的给电子的能力,抑制了电荷向香豆素环的转移,使其吸收带向短波长方向移动[11](蓝移).
为进一步研究传感器的研究传感器S1的识别性能,我们研究了在不同浓度Ag+存在情况下的UV-vis吸收光谱,如图2所示.随着Ag+浓度的增加,其最大吸收波发生蓝移并伴随有强度的减弱.当加入1.2×10-4mol·L-1的Ag+时,最大吸收光谱趋于稳定,继续增加Ag+的浓度,UV-vis吸收光谱没有明显变化.当Ag+浓度在1.2×10-5mol·L-1到1.2×10-4mol·L-1范围内,最大紫外吸收波强度与Ag+吸收浓度呈很好的线性关系,表明该传感器分子可用于Ag+的定量检测.

图1 传感器S1(2×10-5 mol·L-1)中加入2×10-4 mol·L-1的不同阳离子的UV-vis吸收光谱图EtOH-H2O(1∶1,体积分数)

图2 传感器S1(2×10-5 mol·L-1)中加入不同物质的量浓度的Ag+(0~4×10-4mol·L-1)的UV-vis吸收光谱图EtOH-H2O(1∶1,体积分数)
2.2 络合常数和检出限络合常数和检出限是与传感器的性能相关的参数.根据Benesi-Hildebrand表达式[12-13](其中,b为常数,Ka为络合常数,A0、A分别为加入银离子前、后溶液的紫外吸收强度),当n=1时,即当传感器S1与银离子是以1∶1进行络合的,则1[/A0-A]与1[/Ag+]是线性相关的.从实验所得数据,我们以1[/A0-A]对1[/Ag+]作图(图3).经线性拟合,结果表明1[/A0-A]与1[/Ag+]有很好的线性关系其线性相关系数R2=0.993 41,说明传感器S1与Ag+是以1∶1的方式进行络合的并且由线性拟合所得方程可以计算出它们的络合常数Ka为5.15×103.
为了计算传感器S1对Ag+的检出限(DL),以紫外吸光强度A对银离子的浓度[Ag+]作图,线性拟合得线性回归方程:A=0.44-1 081.37[Ag+],上式中A为最大紫外吸收波处的吸光强度,相关系数R2=0.990 08.如图4所示.

图3 银离子与S1配位的Benesi-Hildebrand曲线
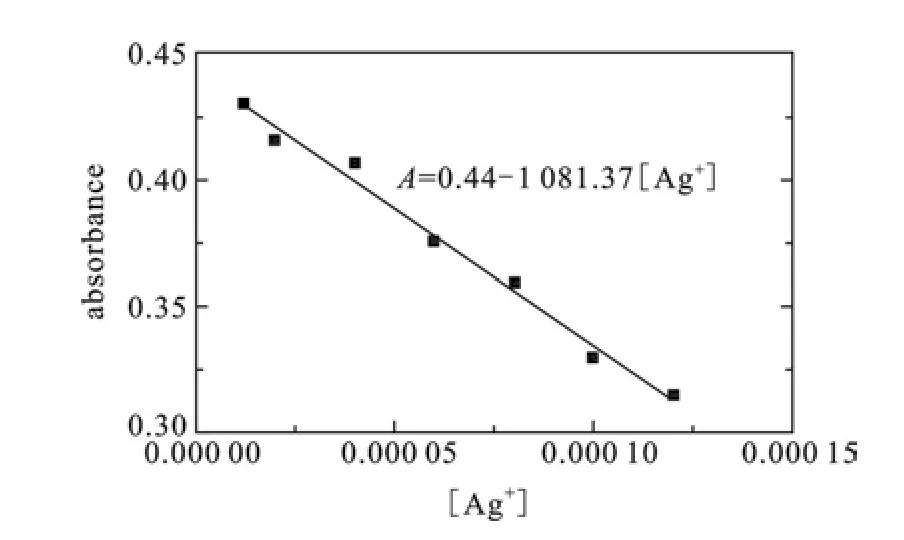
图4 传感器S1(2×10-5 mol·L-1)对不同浓度的Ag+紫外吸收强度变化
根据Stern-Volmer方程[12],检测限DL=Kδ/S,式中δ为空白溶液紫外吸收强度多次测量的标准偏差,本实验中10次平行测量的标准偏差δ为2.93×10-3;K是根据一定置信水平确定的次数,一般取3;S是灵敏度,即上述线性回归方程的斜率的绝对值,计算得传感器S1的检测限为8.13×10-6mol·L-1.这表明传感器S1对银离子的检测具有较高的灵敏度.
2.3 干扰实验在传感器S1的乙醇溶液中(2×10-5mol·L-1),先依次加入4×10-5mol·L-1其他的干扰离子(Mn2+、Co2+、Ni2+、Cu2+、Al3+、Ca2+、Cd2+、Ba2+、Hg2+、Sr2+、K+、Mg2+、,Li+、Pb2+、Zn2+和Fe3+),然后分别加入2×10-4mol·L-1的Ag+,记录紫外吸收强度的变化.由图5可知,Mn2+、Co2+、Ni2+、Cu2+、Al3+、Ca2+、Cd2+、Ba2+、Hg2+、Sr2+、K+、Mg2+、,Li+、Pb2+、Zn2+和Fe3+的存在对 Ag+的识别没有明显的影响 .说明传感器 S1具有很强的抗干扰能力.

图5 其他离子对Ag+的干扰实验结果EtOH-H2O(1∶1,体积分数)
3 结论
本文中设计合成了一种以香豆素为发色基团,以含氮、硫原子的冠醚为识别基团的化学传感器S1.该分子在EtOH-H2O(体积分数,1∶1)溶液中可高选择性的识别银离子.随着银离子浓度的增加,传感器S1的最大紫外吸收出现明显的蓝移并且伴随有吸光强度的减弱.通过Benesi-Hildebrand方程计算得到络合常数Ka=5.15×103,表明传感器S1对银离子有较强的络合能力;由Stern-Volmer方程计算得到的数据,表明传感器S1对银离子较低的检出限(8.13×10-6mol·L-1).这样就为Ag+提供了一种选择性好、灵敏度高的检测手段.
[1]Ratte H T.Bioaccumulation and toxicity ofsilver compounds:a review[J].Environ ToxicolChem,1999,18(1):89-108.
[2]Barriada JL,Tappin A D,Evans EH,etal.Dissolved silvermeasure-ments in seawater[J].Trends Anal Chem,2007,26:809-817.
[3]Liau S,Read D,Pugh W,et al.Interaction of silver nitrate with readily identifiable groups:relationship to the antibacterialaction ofsilver ions[J].LettApplMicrobiol,1997,25:279-283.
[4]Carlson C,Hussain S,Schrand A,et al.Unique cellular interaction of silver nanoparticles:size-dependent generation of reactiveoxygen species[J].JPhysChem B,2008,112(43):13608-13619.
[5]Sung YM,Wu SP.Highly selective and sensitive colorimetric detection of Ag(I)using N-1-(2-mercapto-ethyl)adenine functionalized gold nanoparticles[J].Sensorsand Actuators B:Chemical,2014,197(1):172-176.
[6]Hosoba M,Oshita K,Katarina R K,etal.Synthesis of novel chitosan resin possessing histidinemoiety and its application to the determination of trace silver by ICP-AE Scoupled with triplet automatedpretreat mentsystem[J].Anal Chim Acta,2009,639(1):51-56.
[7]Zhang X B,Han Z X,Fang Z H,et al.5,10,15-Tris(pentaflu-orophenyl)corrole as highly selective neutral carrier for a silver ion-sensitive electrode[J].Anal Chim Acta,2006,562(2):210-215.
[8]李艳,吴鸣虎,袁惠.Fe(Ⅲ)介导下的香豆素-3-羧酸与牛血清白蛋白的相互作用[J].华中师范大学学报:自然科学版,2013,47(4):509-513.
[9]Feau C,Klein E,Dosche C,et al.Synthesis and characterization of coumarin-based europium complexes and luminescence measurements in aqueousmedia[J].Org BiomolChem,2009,7:5259-5270.
[10]Atilgan S,Kutuk I,Ozdemir T.A near IR di-styryl BODIPY-based ratiometric fluorescent chemosensor for Hg(II)[J].Tetrahedron Letters,2010,51(6):892-894.
[11]Valeur B,Leray I.Design principles of fluorescent molecular sensors for cation recognition[J].Coordination Chemistry Reviews,2000,205:3-40.
[12]Zhu M,Yuan M J,Liu X F,et al.Visible Near-Infrared Chemosensor for Mercury Ion[J].Org Lett,2008,10(7):1481-1484.
[13]Li ZQ,Zhou Y,etal.A new fluorescence“turn-on”type chemosensor for Fe3+based on naphthalimide and coumarine[J].Dyes&Pigments,2014,105:7-11.

