川芎嗪激活Wnt信号通路改善阿尔茨海默病大鼠脑组织炎性研究
霍江涛 张小乔 严 洁 潘庆敏 陈 敏
川芎嗪激活Wnt信号通路改善阿尔茨海默病大鼠脑组织炎性研究
霍江涛张小乔严洁潘庆敏陈敏
目的 探讨川芎嗪是否能通过激活Wnt信号通路改善阿尔茨海默病(AD)大鼠脑组织炎性,并探讨其作用机制。方法 采用β淀粉样肽25-35(Aβ25-35)双侧海马注射造阿尔茨海默病大鼠模型,观察川芎嗪对AD大鼠海马tau蛋白上部分磷酸化位点及β淀粉样蛋白(Aβ)前体APP水平的影响,Wnt途径中β-联蛋白(β-catenin)和糖原合成激酶3β(GSK-3β)水平,同时采用免疫组化技术测定4组AD大鼠海马Aβ沉积程度。结果 模型组大鼠单侧大脑皮质区Aβ沉积明显,镜下可见细胞间隙呈褐色改变。而经川芎嗪干预后,褐色成分逐渐减少,川芎嗪可显著抑制Aβ沉积,显著抑制tau磷酸化,抑制GSK-3活性,减少β-catenin降解。结论 TMP通过对AD大鼠海马组织GSK-3β阳性表达的抑制、导致β-catenin降解下降,从而抑制tau蛋白过度磷酸化,并可激活Wnt信号通路抑制Aβ蛋白引起神经毒性,从而发挥神经细胞保护作用。
阿尔茨海默病 川芎嗪 Wnt信号通路 tau蛋白 β-联蛋白
阿尔茨海默病(Alzheimer' s disease,AD)又称老年性痴呆。报道显示[1],炎症及氧化应激是导致AD的发病的主要因素。川芎嗪( tetramethylpyrazine,TMP)为中药川芎的有效成分,现代药理学研究表明,其具有神经保护作用,对多种疾病造成的神经元损伤显示出良好的效果[2]。以往研究证实了TMP通过抑制RAGE-ERK1/2-p38-NFKB信号通路可改善AD组织炎性[3]。然而近年来,Wnt信号通路与AD发病的关系被重视,认为激活Wnt信号通路从而抑制β-catenin的神经毒性成为治疗AD的新观点。故本项目对TMP是否能通过激活Wnt信号通路改善AD大鼠脑组织炎性进行了研究,现报道如下。
1 临床资料
1.1一般资料 (1)试验动物:10个月月龄SD大鼠60只,200~250g(SPF级,北京大学医学部实验动物科学部)。(2)药物及试剂:盐酸川芎嗪注射液(上海第一生化药业有限公司)。脑源性Tau蛋白激酶(Rabbit,TTBin/BDTK)抗体;GSK-3β体(Rabbit,GSK-3β)抗体。DAB显色试剂盒(北京索莱宝科技有限公司),β淀粉样蛋白(β-AP)试刻盒(上海科敏生物科技有限公司)。(3)仪器:Multiskan MK3型酶标仪(芬兰雷勃集团),7160型全自动生化分析仪(Hitachi Limited),GC-911型放射免疫计数仪(中国科技大学实业总公司),二通道微量注射泵(德国TUV公司),双臂数显式脑立体定位仪(STOELING公司),DPXVIEW PRO型显微-彩色图像处理系统(北京萨尔笛科技有限公司)。
1.2方法 (1)动物模型制备、分组及干预:按照随机原则将大鼠分为4组,每组各12只,分别为模型组、川芎嗪高剂量组(60mg/kg)、川芎嗪低剂量组(20mg/ kg)和对照组。大鼠麻醉采用腹腔注射10%水合氯醛380mg/kg,麻醉成功后固定于脑立体定位仪上,以前囟为原点,向后4.4mm,左右各旁开2.2mm为穿刺点,钻孔穿颅,自脑表面进针3.0mm至双侧海马,采用微量注射器将β淀粉样肽25-35(Aβ25~35)10μl(10μg)5min内均匀缓慢注入,待其充分浸润后拔针。对照组注射等量0.9%氯化钠液[4]。拔针后缝合伤口,常规饲养于标准环境温度(22±2)℃,湿度(55±5)%的环境中自由摄食饮水,造模3d后给药,TMP高低剂量组每天尾静脉注射给药(0.5ml/只),模型组与对照组注射等体积的0.9%氯化钠液,连续给药21d。(2)大鼠Wnt表达脑组织炎症因子检测:4组大鼠连续给药21d后,腹腔注射10%水合氯醛380mg/kg麻醉,断头将大鼠杀死,迅速在0.9%氯化钠液冰面上取脑,冲净血液,右侧大脑分离海马组织,置于4%多聚甲醛中固定,常规经包埋、切片、脱水、脱蜡处理。0.01mol/柠檬酸钠缓冲溶液(pH=6)微波热修复抗原,滴加一抗,37℃孵育40min,滴加HRP标记的IgG抗体,37℃孵育20min,DAB显色。每张切片均随机取4个高倍视野在显微镜下观察大鼠的海马区域[5]。另剪出0.3g皮层,分别将海马及0.3g皮层以2ml生理盐水冰浴匀浆,4℃,2000r/min,离心10min,取上清液放入-80℃冰箱待测。以放射免疫法检测海马组织的β淀粉样蛋白(Aβ)及tau蛋白等含量。
1.3统计学方法 采用SPSS17.0统计软件。计量资料以(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD法,以P<0.05为差异有统计学意义。
2 结果
2.1川芎嗪对AD大鼠海马tau蛋白磷酸化及Aβ前体APP水平影响 与对照组比较,模型组细胞中tau蛋白在位点Ser199/202及Ser422上磷酸化水平及Aβ前体APP水平明显升高(P<0.05),与模型组比较,TMP高剂量组、低剂量组tau-1蛋白在位点Ser199/202及Ser422上磷酸化水平及Aβ前体APP水平显著下降(P<0.05),tau-1蛋白在位点Ser199/202及Ser422上磷酸化水平显著升高(P<0.05),见表1。

表1 川芎嗪对AD大鼠海马tau蛋白磷酸化及Aβ前体APP水平影响(x±s)
2.2川芎嗪对AD大鼠海马内Aβ沉积状态分析 模型组大鼠单侧大脑皮质区出现阳性表达。显微镜下可见细胞间隙呈现褐色改变。经川芎嗪给药后,褐色成分逐渐变淡,说明Aβ沉积状态明显较给药前改善。见图1。
2.3川芎嗪对AD大鼠海马内GSK-3活性的影响 与对照组比较,模型组大鼠海马组织中GSK-3阳性表达IOD值明显升高(P<0.05);与模型组比较,TMP高剂量组、TMP低剂量组GSK-3阳性表达IOD值明显降低(P<0.05),见表2。
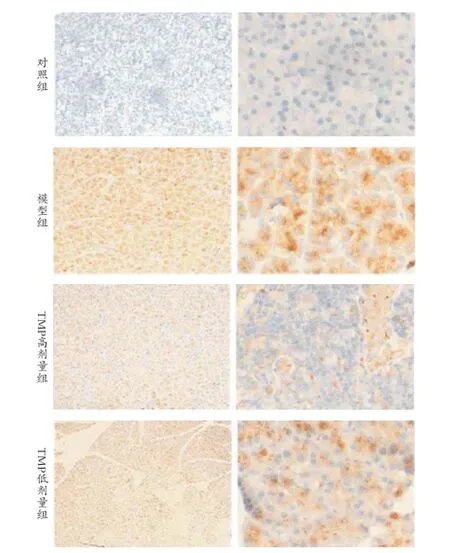
图1 4组AD大鼠Aβ前体APP沉积
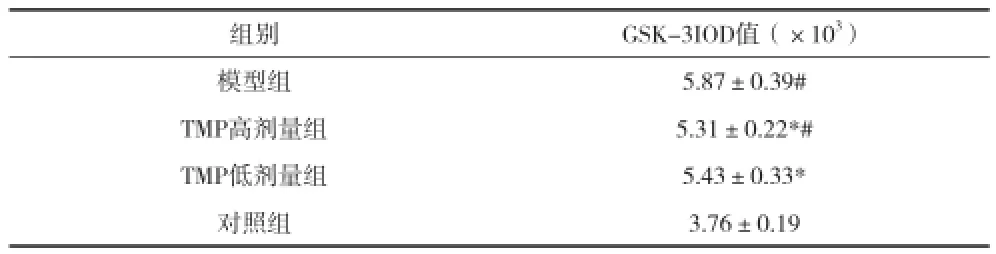
表2 川芎嗪对AD大鼠海马内GSK-3活性的影响(x±s)
2.44组大鼠大脑Wnt信号通路中β-联蛋白(β-catenin)水平变化 与对照组比较,AD模型组大鼠大脑β-catenin水平显著下降。采用川芎嗪高剂量、低剂量干预后,β-catenin水平均呈显著上升。结果显示,在患AD时,Wnt信号通路是下调的,但通过给予川芎嗪后,Wnt信号通路活性上调。见表3。

表3 4组大鼠大脑Wnt信号通路中β-catenin水平变化(x±s)
3 讨论
近年来,AD的发病率逐年上升,已成为影响人类健康的主要疾病之一。AD的病因尚不明确,目前大部分学者认为,Wnt信号通过与AD的发病及发展密切相关[6]。Wnt蛋白通过自分泌或旁分泌与位于细胞膜上的受体结合,从而使细胞内信号途径被激活,发挥调节靶基因的表达的作用,在细胞的生长、自我更新、分化、迁移和凋亡等方面发挥着重要作用。Aβ聚集而成的老年斑通过与过度磷酸化的微血管相关蛋白tau相结合,构成的神经纤维缠结是AD的病理学标志[7]。Aβ的聚集和tau蛋白的过度磷酸化可产生神经毒性,致使海马神经元的大量缺失。而在这一过程中Wnt信号通路参与了大部分过程[8]。
对于AD的致病机制最主要的因素是Aβ异常沉积。Aβ可诱导神经毒性作用,其聚集沉淀后可导致局部炎症反应,从而导致神经元退行性改变,最终导致AD的发生。Aβ是由存在于细胞膜上的淀粉样前体蛋白通过β蛋白酶与γ蛋白酶的2步酶切而形成,单体Aβ会逐渐聚合成寡聚状态,最终诱导神经毒性。Querfurth等[9]研究表明,Aβ淀粉样前体蛋白、早老素Ⅰ等基因的突变会导致Aβ的产生和清除动态失衡,造成Aβ特别是Aβ42过度积累,从而导致AD的发生。Shruster等[10]研究表明,Aβ对Wnt途径的阻断除直接引起海马神经元的破坏外,还会导致神经干细胞的分化减低。本资料结果表明,模型组大鼠单侧大脑皮质区Aβ沉积明显,显微镜下可见细胞间隙呈褐色改变。而通过给予川芎嗪后,褐色成分逐渐减少,说明川芎嗪Aβ沉积较前改善,表明Aβ可以通过抑制Wnt信号通路的功能产生神经毒性,最终导致大量神经元的缺失。而TMP可通过激活Wnt信号通路抑制Aβ蛋白引起神经毒性。
Tau蛋白是一种含磷的微管相关细胞骨架蛋白,位于神经元的突触上。Roberson等[11]研究显示,正常成年人脑内的Tau蛋白呈磷酸化与去磷酸化平衡状态,这样可保持神经元细胞骨架的稳定性和轴突的形态。然而AD患者神经元内tau蛋白呈过度磷酸化状态,过度磷酸化的tau蛋白相互聚集形成神经纤维缠结,从而失去与微管相关细胞蛋白相结合的能力,致使微管的集聚和细胞骨架的稳定性受到破坏,最终引起神经元的死亡。本资料结果表明,模型组细胞中tau蛋白在位点Ser199/202及Ser422上磷酸化水平及Aβ前体APP水平显著升高(P<0.05),而TMP高剂量组、低剂量组tau-1蛋白在位点Ser199、Ser202及Ser422上磷酸化水平及Aβ前体APP水平显著下降(P<0.05),tau-1蛋白在位点Ser199、Ser202及Ser422上磷酸化水平显著升高(P<0.05)。而GSK-3β是Wnt途径的一个重要的负调控因子,它通过对β连环蛋白和APC 2个蛋白磷酸化而发挥作用。糖原合成酶激酶3β与tau蛋白的过度磷酸化及AD患者的记忆损害有关。本资料中模型组大鼠海马组织中GSK-3β阳性表达IOD值显著升高(P<0.05);与模型组比较,TMP高剂量组、TMP低剂量组GSK-3β阳性表达IOD值显著降低(P<0.05)。AD模型组大鼠大脑β-catenin水平显著下降,采用川芎嗪高剂量、低剂量干预后,β-catenin水平均呈显著上升。结果说明,在患AD时,Wnt信号通路下调,经川芎嗪干预后,Wnt途径活性会升高。表明tau蛋白过度磷酸化及β-catenin水平上升是导致AD发生的主要机制,而TMP可抑制GSK-3β阳性表达,导致β-catenin降解减少,从而抑制tau蛋白过度磷酸化,发挥神经细胞保护作用。
综上所述,TMP通过对AD大鼠海马组织GSK-3β阳性表达的抑制导致β-catenin降解减少,从而抑制tau蛋白过度磷酸化,并可激活Wnt信号通路抑制Aβ蛋白引起神经毒性,从而发挥神经细胞保护作用。
1 刘晓杰,杨威,祁金顺.氧化应激与阿尔茨海默病.生理学报,2012,64(1): 87~95.
2 王勇,马武华,郑俊奕,等.川芎嗪预先给药对缺氧损伤胎鼠海马神经元凋亡的影响.新中医,2012,44(2):108~111.
3 刘长安,朱洁.川芎嗪通过抑制RAGE-ERK1/2-p38-NFKB信号通路及活性氧生成改善阿尔茨海默病大鼠脑组织炎性.中国药学杂志,2014,49(13):1126~1132.
4 杨雁,张晓洁,王玉萍,等.噻唑烷二酮通过Wnt路改善2型糖尿病大鼠海马阿尔茨海默病样病变.中国病理生理杂志,2010,26(12):2421~2427.
5 肖若芝,陈琰,王立琳,等.索拉非尼通过抑制WNT信号通路诱导白血病细胞株U937凋亡.中国实验血液学杂志,2011,19(2):353~357.
6 王薇,张海廷,王淑辉,等.阿尔茨海默病与Wnt信号通路及神经干细胞的关系.中国组织工程研究,2013,17(19): 3567~3571.
7 Alves DSM, Smidt MP. En1 and Wnt signaling in midbrain dopaminergic neuronal development. Neural Dev, 2011,6:23.
8 Shruster A, Eldar-Finkelman H, Melamed E, et al. Wnt signaling pathway overcomes the disruption of neuronal differentiation of neural progenitor cells induced by oligomeric amyloid beta-peptide. J Neurochem,2011,116(4):522~529.
9 Querfurth HW, Laferla FM. Alzheimer's disease. N Engl J Med,2010,362(4):329~344.
10 Shruster A, Eldar-Finkelman H, Melamed E, et al. Wnt signaling pathway overcomes the disruption of neuronal differentiation of neural progenitor cells induced by oligomeric amyloid beta-peptide. J Neurochem, 2011,116(4):522~529.
11 Roberson ED, Scearce-Levie K, Palop JJ, et al. Reducing endogenous tau ameliorates amyloid beta-induced deficits in an Alzheimer's disease mouse model. Science,2007,316(5825): 750~754.
Objective To investigate the effect of Ligustrazine on whether the activation of Wnt signal pathway of Alzheimer's disease(AD)rat brain infl ammatory tissue,and to explore its action mechanism. Methods Using the beta amyloid peptide 25-35(A 25-35)of model rats with Alzheimer disease made bilateral hippocampal injection,observe the effects of Ligustrazine on tau protein in hippocampus of AD rats on the part of the phosphorylation site and amyloid beta(A beta)effects of APP precursor levels in the Wnt pathway,beta catenin(Beta -catenin)and glycogen synthase kinase 3 beta(GSK-3 beta)level,at the same time,use immune group to determination of 4 groups of AD rats hippocampal A deposition of the degree of technology. Results This study showed that the model of unilateral cerebral cortex in rats of A group were obviously visible beta,intercellular space mirror under brown change. And the intervention of Ligustrazine,brown component is gradually reduced,ligustrazine can inhibit A deposition,significantly inhibited the phosphorylation of tau,inhibiting the activity of GSK-3,reduce the beta -catenin degradation. Conclusion TMP reduces the beta -catenin degradation,thus preventing tau protein phosphorylation through the inhibition of hippocampus GSK-3 expressionin AD rat ,and can activate Wnt pathway to inhibit the A beta protein induced neurotoxicity,which playsa role in nerve cell protection.
Alzheimer's disease Ligustrazine Wnt signaling pa thway Tau protein Beta catenin
十堰市科学技术研究与开发项目(14K68)
442000湖北省十堰市太和医院老年病房

