共振能量转移技术在生命科学中的应用研究新进展
张顺超, 沈国励, 李合松*
(1.湖南农业大学生物科学技术学院,湖南长沙 410128;2.湖南大学化学化工学院,湖南长沙 410082)
1 引言
共振能量转移(Resonance Energy Transfer,RET)是指发生在距离足够近(一般小于10 nm)的供体与受体之间的非辐射能量转移。其中,荧光共振能量转移技术(Fluorescence Resonance Energy Transfer,FRET)作为一种应用较广泛的分析技术,已经成功应用于蛋白质结构分析[1],核酸、免疫分析[2]等领域。生物发光共振能量转移(Bioluminescence Resonance Energy Transfer,BRET)作为一种天然的生物物理学过程,也成功应用于蛋白质分子相互作用的研究[3 - 4]。然而FRET存在光漂白、需要激发光源等缺点,BRET在供受体对的选择上受到极大的限制。近年来,人们发展了一种新的能量转移技术,即化学发光共振能量转移(Chemiluminescence Resonance Energy Transfer,CRET)。由于CRET不需要激发光源、不存在光漂白现象,有望进一步拓宽能量转移技术在相关领域的应用。目前,CRET在蛋白质分析[5]、核酸分析[6]等领域的应用引起了人们的广泛关注。本文依据供受体对的不同,对RET技术在生命科学中的应用研究进展进行综述,展望了其应用前景和发展趋势。
2 共振能量转移技术的原理
RET的产生必须具备两个条件,一是供体的发射光谱和受体的激发(或吸收)光谱必须有部分重叠;另外供体和受体之间的距离必须足够小(一般小于10 nm)。FRET是指在两个不同的荧光基团中,如果一个荧光基团(供体)的发射光谱与另一个基团(受体)的吸收光谱有一定的重叠,当这两个荧光基团间的距离足够近时(一般小于10 nm),就可观察到荧光能量由供体向受体转移的现象,即荧光供体受激发时,可观察到荧光受体发射的荧光。
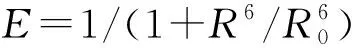
3 共振能量转移技术的应用
3.1 荧光共振能量转移技术的应用
FRET具有分析速度快、方法灵敏度高、选择性好、无污染或污染小等优点,已经广泛应用于生物学中生物分子的结构和动力学研究,如核酸分析[8,9]、免疫分析[10,11]、蛋白质分析[12 - 15]、糖类分析[16]等。因其具有高选择性,近年来也逐渐应用于与临床相关的药物分析[17 - 20]。
3.1.1核酸分析核酸的研究备受广大科研工作者的关注。如使用传统的有机染料作为能量供受体对,设计相应的DNA探针,可以使用FRET技术在分子水平上研究DNA的结构[21]。Zhang等[22]合成了荧光阳离子水溶性共轭聚合物(CCP),对35种卵巢癌症样本RASSF1A、OPCML和HOXA9启动子区域进行了DNA甲基化水平分析,结果表明该方法诊断和筛查癌症具有巨大的应用潜力。Yang等[23]同样通过阳离子共轭聚合物荧光探针,分析了结肠癌启动子甲基化水平,为FRET技术应用于癌症的诊断治疗提出了新的思路。Martí等[24]建立了一种新型的自旋禁止FRET技术,用钌吡啶复合物标记的DNA作为供体,Cy5标记的DNA作为受体,当目标DNA存在时,发生FRET,据此高灵敏检测了目标DNA。
使用传统的分子信标技术,通过FRET分析可在细胞水平上精确地观察活体细胞内基因表达,但早期的FRET主要使用传统的有机染料作为能量供受体对,存在荧光寿命短,斯托克斯位移小(易发生发光光谱重叠),能量转移效率低等缺陷,在一定程度上限制了其应用范围。因此,寻找新的能量供受体对为研究FRET的关键。纳米材料,特别是量子点(Quantum Dot,QDs)的出现,解决了荧光寿命短的缺陷,使FRET得到不断的发展,极大的扩大了其在生命科学中的应用[25]。另外,一些新型纳米材料的出现并作为能量受体和反应载体,如金纳米(AuNPs)、碳纳米管、石墨烯、氧化石墨烯(GO)等,使得供受体对之间的转移距离增大[26],使FRET的应用范围更为广泛。Jin等[27]建立了一种简单有效地在均相水平上筛选G-四链体配体的新方法,该法将荧光素标记的G-四链体DNA(FAM-DNA)通过静电吸附在AuNPs上,发生FRET,结果表明用FRET方法筛选G-四链体配体简单、灵敏、有效,并有望在此基础上设计出鉴别具有抗癌活性配体的方法。Lu等[28]合成带正电的十六烷基三甲基溴化铵修饰的金纳米棒(CTAB-AuNRs),荧光素标记的单链DNA(FAM-ssDNA)可通过静电吸附在CTAB-AuNRs上,发生FRET。Zhang[29]等使用纳米银结合低聚核苷酸DNA,研究了发生FRET的距离,结果表明引入AgNPs后发生能量转移的距离增加至13 nm,从而有望将其用于比标准福斯能量转移距离大的供受体的研究。Dong等[30]研究了QDs和GO作为供受体对,QDs标记的分子信标(QDs-MB)可通过π-π共轭连接到GO上,基于此建立了GO-FRET技术检测DNA的方法。这类基于FRET检测DNA的方法都具有简便、快速、灵敏等优点,已用于活体细胞的DNA检测。基于FRET的核酸分析日趋成熟,已发展由液相分析到固相分析的转变[31]。Krull等[32]在纸上固定多色QDs,结合相应的荧光染料能量受体标记的DNA,构建了一个在非均相水平上多元检测DNA的新技术。FRET技术在核酸分析上的应用,使人们对核酸的研究更加深入,同时,分析方法的多样化,有利于推动核酸研究的快速发展。
3.1.2蛋白质分析FRET可作为精确的“光学分子尺”,已在蛋白质的结构及蛋白质分子内部特定位点之间距离的测量等领域获得了广泛应用[33]。Wruss等[34]基于FRET,在极低密度脂蛋白受体衍生物V33333-His6的N端修饰上荧光素作为能量供体,在其C段键合上猝灭剂QSY7-S-Tris-NTA作为能量受体,实验表明在2 μmol/L的Ni2+存在下,tris-NTA对His6具有很强的亲合性,从而找到了对His6更优越的荧光标记试剂QSY7-S-tris-NTA。Pihlasalo等[35]基于时间分辨FRET,设计了检测低浓度蛋白的分析方法,结果表明该方法具有简便快速、样品消耗量少、灵敏度高等优点,而且检测过程不需要引入有毒的底物,也不需要严格的控制温度。Goswami等[36]采用kynurenine氨基酸和结晶紫作为能量供受体,基于FRET原理研究蛋白质构象的变化,拓宽了FRET在蛋白质分析中的应用。
基于纳米材料的FRET用于蛋白质的检测同样发展迅速。Wang等[37]在微流/纳流芯片中构建了一个V形预反应器,异硫氰酸荧光素标记的狗血清白蛋白(FITC-DSA)共轭连接到AuNPs上形成AuNPs纳米探针(FITC-DSA-AuNPs),由于AuNPs与FITC-DSA之间发生FRET,从而定量分析了胰蛋白酶的活性。Li等[38]设计了一个AgNPs增强FRET传感器用于测量人类血小板源生长因子-BB(PDGF-BB),荧光团TAMRA功能化的生物素化PDGF-BB适配体(Biotin-PDGF-BB-TAMRA)和猝灭剂BHQ-2标记的互补DNA通过亲和反应结合到功能化的AgNPs上,由于适配体链与其互补链相互杂交发生FRET,结果表明使用AgNPs增强FRET传感器具有更高的灵敏度,对PDGF-BB的检测限达到0.8 ng/mL。Hong等[39]基于FRET,链霉亲和素(SA)功能化的QDs作为能量供体,生物素化的AuNPs作为能量受体(作为猝灭剂),设计了检测抗生物素蛋白的分析方法,该方法简便、快速、灵敏、检出限达到10 nmol/L。Chang等[40]利用FAM标记的DNA适配体(FAM-Aptamer)可π-π共轭连接到GO上,发生FRET,基于这种新纳米材料作为荧光受体,灵敏地检测了凝血酶,检测限达到了31.3 pmol/L。
3.1.3免疫分析免疫分析技术主要包含均相法和非均相法。均相法操作较简单、误差小、灵敏度高且应用较广。其中,均相FRET免疫分析方法,选择合适的能量供受体对,已广泛应用于小分子半抗原和大分子抗体的检测[41,42]。随着纳米科学的飞速发展,特别是一些新型纳米材料,如QDs、碳纳米管、石墨烯、上转换纳米材料等的出现极大地丰富了FRET供受体对的选择,扩大了FRET技术在免疫分析上的应用[43 - 47]。Liu等[48]采用双光子荧光染料TP-NH2作为能量供体,DABS作为能量受体,使用免疫夹心法,建立了基于免疫分析的TPE-FRET检测抗体牛血清蛋白,该方法背景信号低,且具有灵敏度高,线性范围宽等优点。Kokko等[10]基于FRET,一个抗体使用过渡金属离子铽标记作为FRET供体,另外两个抗体分别标记的荧光素Alexa Fluor(AF)488和Alexa Fluor 680作为受体,建立了均相双参数免疫分析法。该方法简单、快速、背景干扰少且检测限低。目前,基于FRET免疫分析已成功应用于临床诊断分析。Long等[49]利用小分子BPA功能化石墨烯作为能量受体,荧光标记的BPA抗体作为能量供体,开发了一种均相免疫竞争方法用来检测小分子BPA,检测限达到0.1 nmol/L,可以作为新的小分子快速检测手段。Kuningas课题组[50]基于上转换FRET,利用上转换荧光纳米作为FRET供体,雌二醇偶联的小分子染料作为FRET受体,建立了均相免疫测定雌二醇的方法。开发新的荧光供受体对,结合免疫分析,可以扩大FRET在生命分析中的应用。
3.1.4糖类分析应用FRET于糖类的分析相对较少,这主要可能与在糖的结构中同时修饰上两个荧光团构建FRET相对困难有关。但近些年来,FRET技术应用于糖类分析开始受到科研工作者的关注。Blagoi等[51]基于FRET,用血凝素标记的荧光素作能量供体,右旋糖苷标记的红色染料Texas作能量受体,研究了碳水化合物和糖蛋白类与右旋糖苷对血凝素的的竞争亲合性,同时用该方法检测了水溶液样品中碳水化合物和糖蛋白类的含量。Furchak等[52]基于FRET,在适体酶的催化下,检测6-磷酸盐葡萄糖胺,检测限为500 μmol/L。Chang等[53]基于QDs的FRET,结合毛细管电泳-激光诱导荧光(CE-LIF)超灵敏快速地检测了酸性二糖。使用链霉亲和素(SA)化的CdSe -ZnS QDs作为能量供体,亲和素(biotin)和Cy5双重标记的二糖作为受体,构建二糖的FRET体系,结合CE-LIF定量分析了硫酸软骨素二糖。
3.2 生物发光共振能量转移技术的应用
BRET与FRET相比,具有更多的优势,例如:它不会产生细胞光敏、没有荧光团的光漂白和自身荧光背景的影响等。目前,它已经普遍用于蛋白质之间的相互作用机制,非侵入性活细胞及活体成像等研究中。随着新的荧光蛋白受体(如海肾荧光素,腔肠荧光素,二脱氢腔肠荧光素)的发现,BRET技术有了新的发展,其主要表现在G蛋白受体的偶联的监测[54,55]、G蛋白偶联受体相关的细胞内蛋白的功能与运行规律的研究[56]方面的应用。BRET供受体间的距离一般限制在10 nm以内,超过此距离时能检测的信号非常的小。这也与G蛋白偶联受体的研究相关,因为G蛋白偶联受体7个跨膜螺旋核的直径大概是5 nm。这表明,BRET能够应用于研究G蛋白偶联受体的低聚反应[57]和受体G蛋白的偶联或抑制蛋白的监测,从而研究与G蛋白偶联受体相关的细胞内蛋白的功能与规律。Yoshida等[58]通过染色体免疫沉淀法结合锌指荧光素酶构建BRET体系用于检测表观遗传修饰-组蛋白的修饰,使用该方法,准确地检测了LNCaP和Du145细胞上雄激素受体基因启动子区域的组蛋白的修饰。同样,结合甲基-CpG-键合域蛋白质或甲基胞苷抗体,成功检测了DNA甲基化。该方法能成功地应用于临床诊断分析。Michelini等[59]基于BRET,建立了检测体内植物雌激素复合物的分析方法,该方法可用于评测植物雌激素的活性以及评估从生物相关样品中合成外源性雌激素。
目前,BRET体系主要是使用荧光蛋白作为受体,新的BRET受体需要改善一些特证,如Stokes位移能在大于600 nm的长波上发射荧光,以便获得多功能的BRET体系进而提高它在细胞内成像的实用性和灵敏度。QDs可以在大于600 nm的长波长处发光,且具有较好的生物相容性,容易利用生化方法将它们键合到表达蛋白上,且更容易进入细胞内部。Rao课题组发展的QDs-BRET体系,使用内含子中间调节的化学方法偶联纳米粒子,将生物发光蛋白Luc8的C端通过底物肽蛋白连结到QD表面,用于检测蛋白酶的活性[60]。Hasegawa等[61]通过重组蛋白技术合成谷胱甘肽-s-转移酶标记的海肾萤光素酶(GST-RLuc)-腔肠素作为能量供体,谷胱甘肽(GSH)包裹的近红外(NIR)CdSeTe/CdS QDs(GSH-QDs)作为能量受体,发生CRET,已成功应用于动物内的淋巴结和血管成像。Hsu等[62]建立了一种活体内光动力学治疗(PDT)的BRET新方法。当加入底物腔肠素时,海肾荧光素酶固定的QDs-655(QDs-RLuc8)产生BRET,QDs发出的光进一步活化胶束中包裹的光敏剂Foscan,使产生活性氧(ROS)从而杀死癌细胞,有效地抑制了肿瘤的生长。
随着蛋白质组学研究的进展,可以用BRET技术研究大量的存在潜在相互作用的蛋白质,从而有助于揭示疾病发生的病理生理过程。在此基础上研究蛋白质之间的相互作用,进一步识别新的药物干预靶点方面具有很大的潜力。同时,开发新的生物能量供受体,仍然是BRET技术的研究热点。
3.3 化学发光共振能量转移技术的应用
与FRET不同,CRET不需要外部激发光源,它是由化学发光(CL)底物作为能量供体,随后将氧化反应产生的能量转移给合适的受体分子,是一个非辐射能量转移过程。主要的CL体系有鲁米诺(Luminol)、吖啶酯化合物、过氧化草酸酯等。其中,Luminol是CL体系中最为广泛研究与应用的试剂。一般情况下,在碱性水溶液中,适当的氧化剂如铁氰化钾、过氧化氢、高锰酸钾、高碘酸钾、过硫酸钾等可将Luminol氧化使其处于激发态,随后回到基态时发出最大发射波长为425 nm的光。由于CRET不需要外部光源激发,由外部光源激发非特异性的背景可大大减少,有效地提高了分析的灵敏度。当前,CRET在分析生物大分子和小分子时主要采用分子内和分子间两种能量转移模式[63,64]。
虽然CRET现象在很早以前就为分析科学家所发现,但由于CRET有限的能量供受体对选择,能量转移效率低下,其应用并不多。Zhao等[64]在微流控系统中引入了CRET用于改善免疫分析的灵敏度,以N-(4-氨丁基)-N-乙基异鲁米诺(ABEI)标记雌二醇(E2)抗原为示踪剂,与E2竞争结合有限量的FITC标记抗体,并通过CL光谱对该体系的发光行为进行表征,证实该CL体系为免疫CRET转移,将该免疫体系与微流控芯片电泳-化学发光(MCE-CL)检测技术结合进行分析,游离的ABEI标记抗原和免疫复合物在60 s内实现快速分离,E2的检测限达到了3.6×10-11mol/L。Zhang等[65]用Luminol-H2O2-HRP和荧光素(Fluorescein)作为CRET供体-受体对,结合核酸适体特异性识别靶分子,巧妙设计了二元、三元DNA分子信标作为信号探测器检测小分子三磷酸腺苷(ATP)。用二元、三元DNA分子信标检测ATP的检出限分别达到1.1×10-7、3.2×10-7mol/L。该方法成功检测了白血病细胞和乳腺癌细胞中的ATP,具有样品消耗量少、分析速度快、灵敏度高及选择性好等优点。选择不同的核酸适体,可进一步扩展该方法在高通量药物筛选、临床诊断、细胞研究等方面的应用。然而,传统的CRET主要使用小分子荧光染料作为能量受体,由于小的斯托克斯位移差异,使得供受体对的发射光谱容易发生重叠,CRET的转移效率低。近期,使用一些纳米材料(如QDs,AuNPs,石墨烯等)作为能量受体,由于其具有大的斯托克斯位移和高的能量转移效率,使CRET得到了极大地发展。
QDs相对于有机荧光团具有更长的的激发寿命,能否将QDs作为共振能量转移的受体,有机荧光团作为供体产生共振能量转移引起人们的关注[66]。由于QDs具有宽的激发光谱,高的量子产率,无疑能有效的作为CRET的能量受体。2006年,Huang等[67]首次建立了基于QDs的CRET分析方法。他们研究了QDs催化Luminol-H2O2-HRP-PIP的CL体系,以QDs作为能量受体,Luminol的化学发光为能量供体,提出了该催化体系的CL反应机理为化学发光能量转移。由于Huang等的开拓性工作,此后CRET的研究日益受到人们的关注[68,69]。Zhao 等[70]提出了Luminol-NaBrO-QDs的非酶CRET体系,大大地拓宽了CRET的应用范围。他们以Luminol-NaBrO作为能量供体,CdTe -QDs为能量受体,系统地分析比较了该体系,并结合MCE-CL技术,基于多种生理活性物质对该体系的抑制作用实现对其分析测定。Willner等[71]以DNAzyme催化的Luminol-H2O2发光的体系作为能量供体,CdSe/ZnS-QDs作为能量受体,分别建立了检测核酸适配体和DNA的CRET分析平台。
相对其它的纳米材料,AuNPs具有很多优势,如无毒、良好的生物兼容性,易于合成和表面功能化和高的摩尔吸光系数等。使用AuNPs高的猝灭效率,更长的供受体距离,在FRET系统中已被广泛应用[72],也逐渐应用于构建CRET系统。最近,Huang等[73]提出了一种基于AuNPs的长距离三明治夹心法检测甲胎蛋白(AFP)的方法。他们使用AuNPs标记Anti-AFP-1作为能量受体,HRP共轭连接Anti-AFP-2,结合Luminol-H2O2化学发光体系作为CL供体,当分析物AFP存在时,发生免疫反应,使供受体之间的距离靠近,发生CRET。基于该分析原理,高灵敏、高选择性地测定了AFP。在石墨烯(Graphene)或它的水溶性衍生物氧化石墨烯(GO)反应体系中,由于CL供体到石墨烯或GO的π共轭系统可产生非辐射电子转移,与AuNPs一样,已被广泛用作CRET的有效猝灭剂。Bi等[74]使用GO与生物分子直接作用建立了CRET用于生物大分子的检测,先用荧光染料标记的目标ssDNA(FAM-ssDNA)吸附在GO表面作为能量受体,Luminol-H2O2产生CL,作为能量供体,高灵敏和高选择性地检测了H1V1 DNA和凝血酶。Lee等[75]使用石墨烯作为能量受体,Luminol-H2O2-HRP作为能量供体,构建了均相免疫的CRET用于C-反应蛋白(CRP)的检测。当前,CRET的进一步应用有赖于开发新的CL试剂提高CRET的灵敏度和扩大其潜在的应用。我们相信,随着纳米技术的迅速发展,开发出更多新的CRET供受体对,可以扩展其在生命科学中的重要应用。
4 展望
选择合适的供受体对,是RET得以实现的关键。人们对FRET的研究从早期的两个荧光基团之间,逐渐扩展到纳米材料与荧光基团之间,除了应用于生物化学的分析,人们也用FRET探索或验证晶体的结构等。随着QDs的出现,BRET的应用研究正在不断发展。而CRET的研究的不断深入,解决了FRET自身荧光干扰和荧光寿命短等问题,进一步拓宽了能量转移的应用。由此可见,各种能量转移技术在不同的领域均有其独特的应用,在生命科学研究中,使用哪一种RET,主要取决于实际分析的需要。此外,开发新型的RET供受体对是进一步推动RET用于生命科学,如临床癌症标记物的检测、小分子间距离的研究等热门研究课题。在此基础上,相信RET会在生物分子结构分析、生物标志物的测量以及临床疾病的诊断等生物科学领域作出更大的贡献。

