克氏担孢酵母脂肪酶基因在毕赤酵母中的高效表达
王建荣,刘丹妮,李 鹏,李阳源
(广东溢多利生物科技股份有限公司,广东 珠海 519060)
克氏担孢酵母脂肪酶基因在毕赤酵母中的高效表达
王建荣,刘丹妮,李 鹏,李阳源*
(广东溢多利生物科技股份有限公司,广东 珠海 519060)
以克氏担孢酵母V3脂肪酶基因为研究对象,构建毕赤酵母稳定的高效表达系统。采用同源克隆法从克氏担孢酵母V3中获得一个脂肪酶基因,并将其构建到表达载体pPICZαA,转入毕赤酵母X33中,成功实现了克氏担孢酵母V3脂肪酶基因在毕赤酵母X33中的表达。重组工程菌摇瓶培养120 h后,酶活力可达18 U/mL。重组酶的最适反应温度为60 ℃,最适pH值为5.0。1 mmol/L的Mg2+、K+和Na+以及质量浓度为1 g/100 mL的曲通-100、吐温-80、吐温-20对重组KLIP具有激活作用。重组酶的最适底物为三硬脂酸甘油酯(C18)。
克氏担孢酵母;脂肪酶;毕赤酵母
脂肪酶(lipase,EC3.1.1.3)是一种可以在油水界面上催化天然底物油脂水解释放更少酯键的甘油酯或甘油以及脂肪酸,而在非水相体系中脂肪酶还可催化转酯和酯合成等多种反应[1-3]。由于脂肪酶这种特殊的酶学特性,使其在食品加工、油脂改性、洗涤、能源等众多工业领域具有广泛的应用潜力[4-7]。
脂肪酶作为一种重要的工业酶制剂其主要来源于微生物,微生物分泌的脂肪酶具有较广的作用pH值、作用温度范围以及底物专一性;微生物分泌的脂肪酶一般都为胞外酶,更适合工业化大生产[8-10]。随着对脂肪酶研究的深入,越来越多的微生物脂肪酶被挖掘出来。微生物脂肪酶主要分为细菌脂肪酶和真菌脂肪酶两大类,细菌脂肪酶研究较多的是假单胞菌属脂肪酶[11],真菌脂肪酶的研究主要集中在根霉属和酵母属两大类[12-13]。迄今,酵母属脂肪酶的研究主要集中在3 类脂肪酶,分别是褶皱假丝酵母脂肪酶(Candida rugosa lipase,CRL),南极假丝酵母脂肪酶B(Candida antarctica lipase B,CALB)以及解酯耶式酵母脂肪酶2(Yarrowia lipolytica lipase 2,YLLip2)[14-16]。随着酶催化技术的不断推广应用,酶应用的条件也越来越严格,如高温、高压等特殊条件。CRL、CALB以及YLLip2的热稳定性差,在高温条件下很容易变性失活。相对于CRL、CALB以及YLLip2,来源于克氏担孢酵母的脂肪酶(Kurtzmanomyces lipase,KLIP)则具有很好的热稳定性[17]。KLIP良好的热稳定性使其在一些极端的反应条件下(如高温)具有很好的应用潜力。
克氏担孢酵母表达KLIP的水平较低,为了进一步提高KLIP的表达水平,选择一个合适的表达宿主至关重要。毕赤酵母(Pichia pastoris)表达系统是一种成熟的真核表达系统,在蛋白质表达方面有着不可比拟的优点:如培养条件简单、易于操作、便于工业化生产;高稳定性表达,可高效表达外源蛋白等[18-20]。在本研究中将克氏担孢酵母的脂肪酶基因(klip)在毕赤酵母X33中进行了异源表达并且测定了重组KLIP的酶学特性,为下一步对klip进行基因改造以及高密度发酵重组KLIP酵母工程菌奠定基础。
1 材料与方法
1.1材料与试剂
克氏担孢酵母V3 本实验室保藏;表达载体pPICZαA、毕赤酵母X33、博莱霉素(Zeocin) 美国Invitrogen公司;大肠杆菌Top10、高保真Pfu酶、T4 DNA连接酶、限制性内切酶EcoRⅠ、XbaⅠ、质粒提取试剂盒、酵母基因组提取试剂盒、PCR纯化试剂 生工生物工程(上海)股份有限公司;橄榄油 益海嘉里投资有限公司;不同碳链长度的脂肪酶底物 美国Sigma公司;其他常规试剂均为国产分析纯或进口分装;引物由深圳华大基因合成。
大肠杆菌(Escherichia coli)用LB培养基进行培养,酵母转化子用YPDZ培养基进行筛选,酵母摇瓶培养及产酶培养基分别为BMGY和BMMY。LB、YPDZ、BMGY和BMMY培养基分别参照美国Invitrogen公司的酵母表达手册进行配制。
1.2仪器与设备
PCR仪、凝胶成像系统、冷冻离心机 珠海黑马科技有限公司;电穿孔仪、蛋白质电泳仪 美国Bio-Rad公司;高速均质机 德国IKA公司。
1.3方法
1.3.1克氏担孢酵母V3脂肪酶基因(klip)克隆
通过对美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)上已报道的序列(GenBank登录号为:AB073866)进行分析,设计了一对引物用来扩增klip。上游引物:5’-CAGCGAAT TCGCTCCTTTGGAACCTAGAGCT-3’和下游引物:5’-GACGTCTAGATTACAACAA CTTGTCCAAGGA-3’(分别含有EcoRⅠ和XbaⅠ酶切位点)。采用同源克隆法扩增klip,以提取的克氏担孢酵母V3基因组DNA为模板进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR反应体系:DNA模板1 μL,上、下游引物各2 μL,2×Pfu Master Mix 50 μL,用ddH2O补充到总体积为100 μL。PCR反应条件:94 ℃预变性4 min后,分别于94 ℃变性30 s,55 ℃退火30 s和72 ℃延伸2 min,共33 个循环,最后在72 ℃延伸10 min。PCR产物经凝胶电泳鉴定正确后纯化回收存于-20 ℃备用。
1.3.2表达载体pPICzαA-klip的构建及毕赤酵母转化
用限制性内切酶EcoRⅠ和XbaⅠ对表达载体pPICzαA和目的基因PCR产物进行双酶切,切胶纯化后,用T4 DNA连接酶进行连接反应,然后转入E. coli Top10,在含25 μg/mL Zeocin的LB培养基平板上涂板,过夜培养。挑取阳性转化子过夜培养后提取质粒,进行双酶切鉴定。将阳性质粒提交华大基因公司进行序列测定。将测序正确的重组质粒用限制性内切酶SacⅠ进行线性化,通过电转化法转化至毕赤酵母X33,取转化产物涂布于含有100 μg/mL的Zeocin YPD(YPDZ)平板上,30 ℃培养2~3 d。1.3.3 高酶活转化子的筛选及重组酵母菌摇瓶培养
将YPDZ平板上的酵母转化子,分别挑入含有5 mL BMGY的50 mL离心管中,30 ℃、250 r/min过夜培养,离心,倒掉上清液,每个离心管中加入5 mL BMMY培养基进行诱导培养,每隔24 h取样,离心,取上清液。脂肪酶活性测定参照报道的方法进行[21]。将筛选出的高酶活转化子,接种于含有50 mL BMGY培养基的500 mL三角瓶中,30 ℃、250 r/min振荡过夜培养至OD600nm达到2~6。离心收集菌体,再将其重悬浮于BMMY培养基中,稀释至OD600nm为1.0,继续振荡培养,每隔24 h向BMMY培养基中补加甲醇至终体积分数为0.75%进行诱导表达,同时测定重组菌的菌体浓度和脂肪酶酶活力。
1.3.4重组蛋白的纯化和聚丙烯酰胺凝胶电泳
KLIP重组蛋白的纯化参照文献[22]报道的方法进行。将发酵液离心取上清液,上清液即为粗酶液;将粗酶液进行超滤浓缩,超滤膜的截留分子质量为10 kD;将超滤后的酶液进行DEAE-Sephadex A-50离子交换层析,收集有酶活力的洗脱峰,经透析浓缩后作为十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)上样液。电泳采用12%的分离胶和5%的浓缩胶,电压控制在40 V。电泳结束后进行考马斯亮蓝染色。
1.3.5重组KLIP的酶学性质
1.3.5.1重组KLIP的温度特性
在pH 5.0条件下测定纯化后重组KLIP在30~80 ℃不同温度下的酶活力,以测定酶活力最高的温度下的酶活力为100%,计算其他温度下的相对酶活力。将纯化后的重组KLIP在不同温度下(30~80 ℃)水浴保温1 h,在最适温度、pH 5.0条件下测定剩余的酶活力,以未做任何处理酶液的酶活力为100%,计算其他温度下的剩余酶活力。
1.3.5.2重组KLIP的pH值特性
在60 ℃、不同pH值(缓冲液体系分别为:pH 3~7为100 mmol/L的柠檬酸-磷酸钠缓冲液;pH 8~9 为100 mmol/L的Tris-HCl缓冲液)条件下测定纯化后重组KLIP的活性,以活性最高pH值下的酶活力为100%,计算其他pH值条件下的相对酶活力。将纯化后的重组KLIP分别在pH 3~9(缓冲液体系分别为:pH 3~7为100 mmol/L的柠檬酸-磷酸钠缓冲液;pH 8~9 为100 mmol/L的Tris-HCl缓冲液),30 ℃保存24 h,再于最适温度,最适合pH值条件下测定剩余酶活力,以未做任何处理酶液的酶活力为100%,计算其他pH值条件下的剩余酶活力。
1.3.5.3金属离子对重组KLIP活性的影响
在含有1 mmol/L不同金属离子的环境中,将纯化后的重组KLIP在30 ℃条件下保存6 h,以未加金属离子酶液的酶活力为100%,计算其他条件下的剩余酶活力。
1.3.5.4不同去污剂对重组KLIP活性的影响
在质量浓度为1 g/100 mL的不同去污剂的环境中,将纯化后的重组KLIP在30 ℃条件下保存6 h,以未加去污剂酶液的酶活力为100%,计算其他条件下的剩余酶活力。
1.3.5.5重组KLIP底物特异性
在最适温度以及最适pH值条件下分别测定纯化后的重组KLIP对不同碳链长度的脂肪酸甘油酯的催化能力,以测定酶活力最高时的底物的酶活力为100%,计算其他底物的相对酶活力。
2 结果与分析
2.1表达载体pPICzαA-klip的构建及毕赤酵母转化
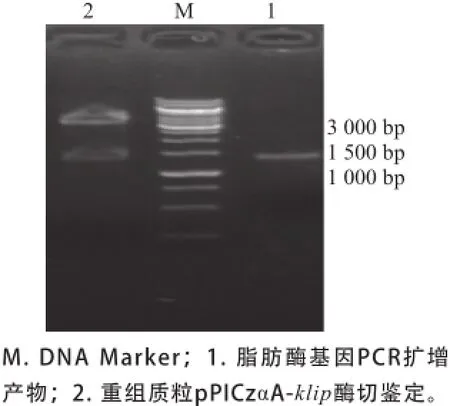
图1 脂肪酶基因PCR扩增及重组质粒酶切鉴定Fig.1 Electrophoretogrom of PCR amplification products and restriction enzyme digestion analysis of plasmid pPICzαA-klip
以提取的克氏担孢酵母V3的基因组DNA为模板,用设计好的引物进行PCR扩增,经琼脂糖凝胶电泳(图1)可见PCR产物大小约为1 400 bp。将该目的片段回收并克隆到表达载体pPICzαA,提取重组质粒,进行双酶切鉴定,电泳结果显示片段大小正确,测序结果表明klip全长为1 374 bp,起始和终止密码子分别为ATG和TAA,以上实验结果表明:表达载体pPICzαA-klip构建成功。通过电转化法将线性化后的表达载体pPICzαA-klip转入毕赤酵母X33,取转化产物涂布于含有100 μg/mL的Zeocin YPD平板上,30 ℃培养2~3 d后,Zeocin YPD平板上长出了数百个转化子。
2.2高酶活力转化子的筛选及重组酵母菌摇瓶培养
按照方法1.3.3节从随机挑选出来的50 个转化子中筛选得到一株产重组KLIP酶活力较高的转化子,命名为K1。将筛选出的高酶活转化子K1,按照方法1.3.3节用摇瓶进行诱导培养,每隔24 h取样测量菌浓和上清发酵液的酶活力。结果如图2所示:诱导至120 h时,酶活力达到18 U/mL(摇瓶培养条件下,克氏担孢酵母V3表达KLIP的最大酶活力为6 U/mL);诱导至144 h时,菌体的OD600nm值达到最大值为45。

图2 重组毕赤酵母产酶曲线和生长曲线Fig.2 Cell growth and lipase production of recombinant yeast
2.3重组蛋白的纯化及SDS-PAGE分析
发酵上清液经截留分子质量为10 kD的膜超滤、DEAE-Sephadex A-50离子交换层析纯化后,得到酶活回收率为58%,纯化倍数为3.50 倍的纯酶(表1)。将纯化后的重组KLIP进行SDS-PAGE分析。由图3可知,重组酶分子质量约49 kD,这与经ExPASy Proteomics Server软件对重组KLIP的氨基酸序列进行分子质量预测值接近。
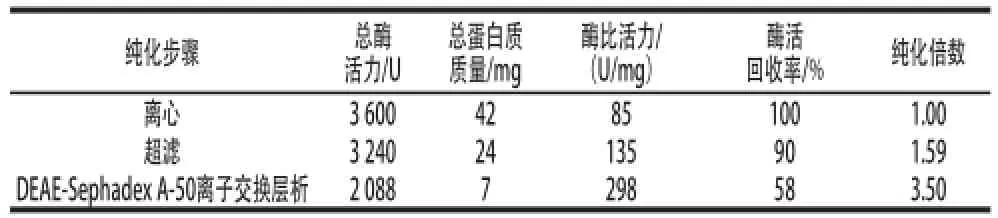
表1 重组蛋白的纯化Table1 Purification of recombinant lipase
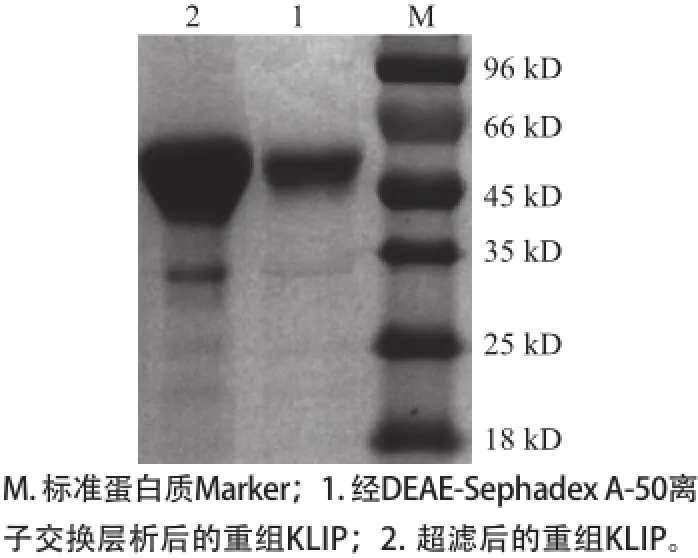
图3 重组KLIP的SDS-PAGEE分析Fig.3 SDS-PAGE analysis of the recombinant lipase
2.4重组KLIP的酶学性质
2.4.1重组KLIP的温度特性
在pH 5.0条件下,分别在不同温度下测定纯化后重组KLIP的酶活力,结果见图4。在30~60 ℃范围内重组KLIP的酶活力逐渐上升,在60~80 ℃范围内重组KLIP的酶活力逐渐下降,说明重组KLIP的最适反应温度为60 ℃。耐温性方面:将纯化后的重组KLIP分别在30~80 ℃水浴保温1 h,再在pH 5.0,60 ℃条件下测定剩余酶活力。结果表明:在30~60 ℃范围内,重组KLIP具有较好的稳定性,剩余酶活力可达到97%以上;当温度超过60 ℃,酶的活性急剧下降,在80 ℃时酶活力为对照的41%。
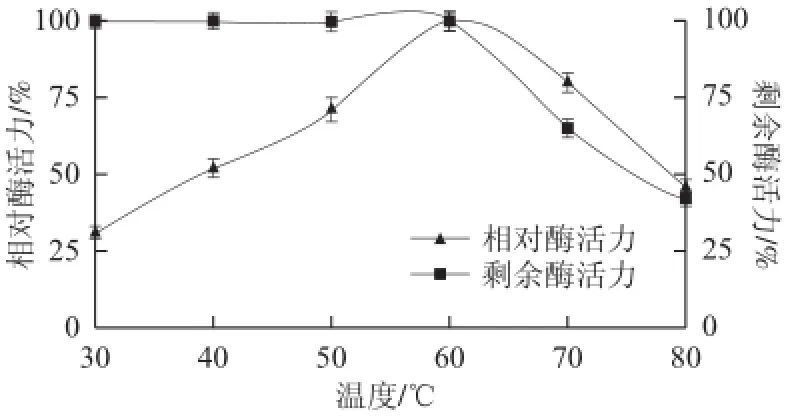
图4 重组脂肪酶最适反应温度及热稳定性Fig.4 Effect of temperature on the activity and stability of the recombinant lipase
2.4.2重组KLIP的pH值特性
在60 ℃,不同pH值条件下测定纯化后重组KLIP的酶活力,结果见图5。在pH 3~5范围内,随着pH值的升高酶活力逐渐升高,在pH 5~9范围内重组KLIP的活性逐渐下降,说明重组KLIP的最适pH值为5。将纯化后的重组KLIP在不同pH值条件下室温保存24 h后测定其剩余酶活力,结果表明重组KLIP在pH 3~7范围内具有很好的稳定性,剩余酶活力均达到80%以上,当pH值大于7时,重组KLIP的活性急剧下降。在pH 8的条件下放置24 h后,剩余酶活力仅为20%。
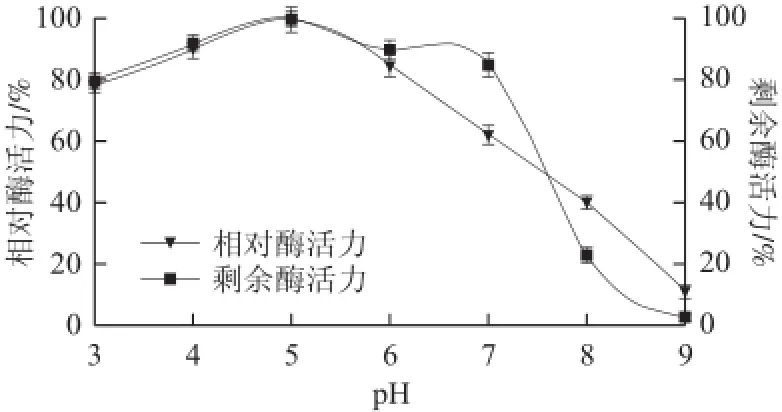
图5 重组脂肪酶的最适反应pH值及pH值稳定性Fig.5 Effect of pH on the activity and stability of the recombinant lipase
2.4.3金属离子对重组KLIP活性的影响
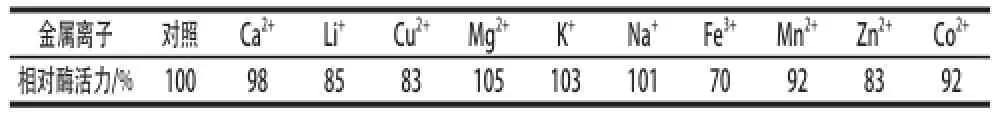
表2 不同金属离子对重组脂肪酶活性的影响Table2 Effects of different metal ions on the activity of the recombinant lipase
由表2可知,1 mmol/L的Mg2+、K+和Na+对重组KLIP具有激活作用,与对照相比对照分别提高5%、3%和1%。除了Fe3+其他金属离子对重组KLIP活性的影响较小,相对酶活力都在83%~100%之间。
2.4.4不同去污剂对重组KLIP活性的影响
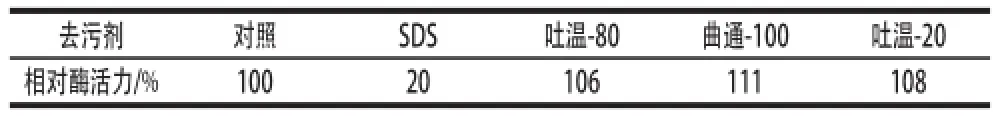
表3 不同去污剂对重组脂肪酶活性的影响Table3 Effects of different detergents on the activity of the recombinant lipase pase
由表3可知,质量浓度为1 g/100 mL的不同去污剂的环境中,吐温-80、吐温-20以及曲通-100对重组KLIP具有激活作用,与对照相比分别提高6%、8%和11%;SDS对重组KLIP的活性具有强烈的抑制作用,在含有1 g/100 mL SDS的条件下保存6 h后,相对酶活力仅为对照的20%。
2.4.5重组KLIP的底物特异性

图6 重组脂肪酶的底物特异性Fig.6 Substrate specificity of the recombinant lipase
由图6可知,重组KLIP对长碳链底物的活性高于短碳链的底物。重组KLIP的最适底物为三硬脂酸甘油酯(C18),其次对三丁酸甘油酯(C4)的活性较高。
3 讨 论
到目前为止,关于酵母脂肪酶的研究主要集中在CRL、CALB以及YLLip2。以上3 种脂肪酶均存在的缺点是酶的热稳定性差:如CRL在温度为55 ℃条件下,检测不到酶活力;当温度超过40 ℃,CALB的稳定性较差;YLLip2在45 ℃水浴保温30 min后,剩余酶活力仅为20%[14-16]。相对于CRL、CALB以及YLLip2,重组KLIP则具有很好的热稳定性。重组KLIP的最适反应温度为60 ℃,在60 ℃和70 ℃水浴保温1 h后剩余酶活力分别为97%和65%。由于重组KLIP良好的热稳定性,使其在工业领域具有很大的应用潜力。
毕赤酵母作为一种成熟的真核表达系统,在蛋白质表达方面有着许多优点:如培养条件简单、易于操作、便于工业化生产、可高效的表达外源蛋白等。本实验将klip在毕赤酵母X33中进行了异源表达。在摇瓶培养条件下,重组酵母工程菌分泌表达KLIP的能力是野生型克氏担孢酵母的3 倍(摇瓶培养条件下,重组工程菌为18 U/mL,克氏担孢酵母为6 U/mL)。本实验采用的基因是从克氏担孢酵母中克隆的原始基因,考虑到毕赤酵母表达外源基因具有密码子偏好性,今后通过对klip进行密码子优化可进一步提高毕赤酵母表达此酶的能力。
本研究成功实现了klip的高效表达,为该基因的进一步研究和应用奠定了基础,今后通过进一步完善发酵和分离纯化工艺,以及采用高密度发酵培养等技术,以最大化提高KLIP的产量和活性,使其能最终应用于工业化生产。
[1] JAEGER K E, EGGERT T. Lipases for biotechnology[J]. Current Opinion in Biotechnology, 2002, 13(4): 390-397.
[2] HASAN F, SHAH A A, HAMEED A. Industrial applications of microbial lipases[J]. Enzyme and Microbial Technology, 2006, 39(2): 235-251.
[3] GOTOR V, BRIEVA R. Lipases: useful biocatalysts for the preparation of pharmaceuticals[J]. Journal of Molecular Catalysis B: Enzymatic, 2006, 40(3/4): 111-120.
[4] 张峦, 黄立群, 喻晓蔚, 等. 重组华根霉脂肪酶的酶学性质及其对面团热机械和烘焙特性的影响[J]. 食品科学, 2012, 33(13): 158-163.
[5] 寿佳菲, 潘丽军, 操丽丽, 等. 酶催化菜籽油酸解制备结构脂质工艺[J].食品科学, 2012, 33(10): 29-32.
[6] HAMA S, YAMAJI H, FUKUMIZU T, et al. Biodiesel-fuel production in a packed-bed reactor using lipase-producing Rhizopus oryzae cells immobilized within biomass support particles[J]. Biochemical Engineering Journal, 2007, 34(3): 273-278.
[7] SHARMA R, CHISTI Y, BANERJEE U C. Production, purification,characterization, and applications of lipases[J]. Biotechnology Advances, 2001, 19(8): 627-662.
[8] GUPTA R, GUPTA N, RATHI P. Bacterial lipases: an overview of production, purification and biochemical properties[J]. Applied Microbiology and Biotechnology, 2004, 64(6): 763-781.
[9] SINGH A K, MUKHOPADHYAY M. Overview of fungal lipase: a review[J]. Applied Biochemistry and Biotechnology, 2012, 166(2): 486-520.
[10] JAEGER K E, REETZ M T. Microbial lipases form versatile tools for biotechnology[J]. Trends in Biotechnology, 2000, 16(9): 396-403.
[11] 张博, 杨江科, 闫云君. 假单胞菌脂肪酶的研究进展[J]. 生物技术通报, 2007(2): 52-57.
[12] 颜兴和, 王栋, 徐岩. 根霉脂肪酶的研究进展[J]. 工业微生物, 2005,35(3): 45-49.
[13] VAKHLU J, KOUR A. Yeast lipases: enzyme purification,biochemical properties and gene[J]. Electronic Journal of Biotechnology, 2006, 9(1): 70-85.
[14] DOMINGUEZ M P, SANCHEZ J M, SINISTERRA J V, et al. Understanding Candida rugosa lipases: an overview[J]. Biotechnology Advances, 2006, 24(2): 180-195.
[15] RAZA S, FRANSSON L, HULT K. Enantioselectivity in Candida antarctica lipase B: a molecular dynamics study[J]. Protein Science,2001, 10(2): 329-338.
[16] FICKERS P, MARTY A, NICAUD J M. The lipases from Yarrowia lipolytica: genetics, production, regulation, biochemical characterization and biotechnological applications[J]. Biotechnology Advances, 2011, 29(6): 632-644.
[17] KAKUGAWA K, SHOBAYASHI M, SUZUKI O, et al. Purification and characterization of a lipase from the glycolipid-producing yeast Kurtzmanomyces sp. Ⅰ-11[J]. Bioscience, Biotechnology, and Biochemistry, 2002, 66(5): 978-985.
[18] MACAULEY S, FAZENDA M L, MCNEIL B, et al. Heterologous protein production using the Pichia pastoris expression system[J]. Yeast, 2005, 22(4): 249-270.
[19] RABERT C, WEINACKER D, PESSOA A, et al. Recombinants proteins for industrial uses: utilization of Pichia pastoris expression system[J]. Brazilian Journal of Microbiology, 2013, 44(2): 351-356.
[20] GASSERB, PRIELHOFER R, MARX H, et al. Pichia pastoris: protein production host and model organism for biomedical research[J]. Future Microbiology, 2013, 8(2): 191-208.
[21] WANG Xiaofeng, SUN Yongchun, SHEN Xuguang, et al. Intracellular expression of Vitreoscilla hemoglobin improves production of Yarrowia lipolytica lipase LIP2 in a recombinant Pichia pastoris[J]. Enzyme and Microbial Technology, 2012, 50(1): 22-28.
[22] YU Mingrui, LANGE S, RICHTER S, et al. High-level expression of extracellular lipase Lip2 from Yarrowia lipolytica in Pichia pastoris and its purification and characterization[J]. Protein Expression and Purification, 2007, 53(2): 255-263.
Overexpression of the Lipase Gene from Kurtzmanomyces in Pichia pastoris
WANG Jianrong, LIU Danni, LI Peng, LI Yangyuan*
(Guangdong VTR Bio-tech Co. Ltd., Zhuhai 519060, China)
A stable and highly effective expression system was constructed for the expression of the lipase gene from Kurtzmanomyces sp. V3. The lipase gene was isolated by homologous cloning, inserted into the expression vector pPICZαA and transformed into Pichia pastoris X33. The results showed that the gene was expressed successfully in Pichia pastoris X33. The optimal temperature and pH of the recombinant lipase were 60 ℃ and 5.0, respectively. Its activity was stimulated by 1 mmol/L Mg2+, K+and Na+, and 1 g/100 mL Triton-100, Tween-80 and Tween-20. The recombinant lipase showed high activity toward tristearin (C18).
Kurtzmanomyces; lipase; Pichia pastoris
Q81
A
1002-6630(2015)03-0104-05
10.7506/spkx1002-6630-201503020
2014-03-12
国家高技术研究发展计划(863计划)项目(2014AA093514)
王建荣(1985—),男,硕士研究生,研究方向为酶工程。E-mail:believe1234@126.com
李阳源(1983—),男,副高级工程师,博士研究生,研究方向为分子生物学与酶学。E-mail:liyangyuanvtr@163.com

