玉米自交系(AS-9)耐盐突变体的遗传变异分析
杨凤娇,李红英,卢存福,陈玉珍
(北京林业大学 生物科学与技术学院 林木育种国家工程实验室 林木花卉遗传育种教育部重点实验室,北京 100083)
玉米自交系(AS-9)耐盐突变体的遗传变异分析
杨凤娇,李红英,卢存福,陈玉珍
(北京林业大学 生物科学与技术学院 林木育种国家工程实验室 林木花卉遗传育种教育部重点实验室,北京 100083)
以玉米基础自交系(AS-9)及其化学诱变自交系M4为实验材料进行耐盐性鉴定,同时利用44对可能与根系性状有关联的SSR引物进行遗传变异分析。结果表明,诱变M4幼苗经200和250 mmol·L-1NaCl盐胁迫处理7 d后,IV400、IV1600根数比AS-9对照分别增加23.1%、19.1%,诱变IV1600初生根1、2、3根长分别为对照的1.33、1.70、2.15倍;同时在M4玉米试材中扩增出多态性条带的引物25对,占引物总数的56.82%;诱变自交系M4与AS-9的遗传相似系数平均值为0.6563,遗传相似系数中心化后,数据在-0.04处可把材料分为三个类群,基础材料AS-9为Ⅰ类,M4代IV1400、IV1600、IV2000聚为Ⅲ类,其余诱变系为Ⅱ类。此外,6对引物的SSR-PCR产物进行序列差异检测,结果产生新的基元和基元重复次数变化,说明系列化学诱变已使玉米自交系AS-9产生了显著的遗传变异。
玉米;自交系;化学诱变;SSR标记;遗传变异
目前,人工诱变被广泛运用到植物育种工作中,主要包括离子束、X射线、γ射线等物理诱变方法,叠氮化物、烷化剂等化学诱变方法以及T-DNA、转座子等生物诱变方法[1—2]。化学诱变突变率高,突变位点具一定的特异性,出现的分子水平变化较多,不会引起染色体畸变或损伤,且致死率低、价格低廉、操作简单[2—3]。目前,通过化学诱变方法获得了多种植物如水稻、玉米、黄瓜、花生等的多种突变体[4—6]。
DNA分子标记可以直接反映核苷酸序列上的差异,检测结果精确。分子标记技术如RFLP、RAPD、AFLP、SSR等已用于各种实验材料的遗传变异研究。SSR分子标记具有染色体上分布均匀、共显性、多态性较为丰富、分辨率高且不受环境影响等优点,被广泛应用于植物种质资源遗传多样性分析、目标性状基因定位、遗传图谱构建及种子纯度分析等研究[7—10]。研究产量、品质、抗逆性等数量性状对农作物遗传改良具有重要意义,随着DNA分子标记技术的不断发展,把数量性状的复杂遗传剖析推向新的高度[11—12]。关联分析将标记(或候选基因)的遗传变异与目标的表型性状联系起来[13—14],目前在小麦[12]、玉米[15]、水稻[16—17]等植物中应用较广泛。
本研究以数据库资源丰富的基因组测序植物玉米的基础自交系 AS-9及化学诱变系 M4为实验材料,检验幼苗经盐胁迫后的生物学效应,并以与根系性状可能有关联的SSR 标记研究各诱变系与基础材料间的遗传差异,以此验证化学诱变对实验材料遗传变异的影响,为合理利用化学诱变创造新的种质资源提供理论依据。
1 材料与方法
1.1材料
以玉米自交系AS-9为基础自交系,经系列化学诱变后获得自交第4代(M4)诱变系,分别为IV200、IV400、IV800、IV1200、IV1400、IV1600、IV2000。自交系AS-9与诱变系同时种植至第4代命名为IVCK。用于SSR分子标记的实验材料取自玉米自交系IVCK和诱变系M4各株系未作任何盐胁迫处理正常生长的幼苗。
1.2发芽实验
上述实验材料种子在75%酒精溶液中消毒5 min,次氯酸钠溶液(2.5%有效氯)消毒3 min,无菌水清洗3~5次,培养皿中发芽。每培养皿50粒,重复3次,于25 ℃进行暗发芽。幼苗生长30 d后,采用200 mmol·L-1和250 mmol·L-1NaCl各处理7 d,进行芽长、根长及根数等形态学指标检测。
1.3SSR标记引物筛选及PCR体系扩增
1.3.1引物筛选根据玉米数据库MaizeGDB公布的引物序列及已有文献资料[18—20],合成可能与根系发育有关的引物44对,筛选出扩增稳定、条带清晰、重复性高、多态性好的25对引物用于实验,目标引物占总合成引物数的56.82%。
1.3.2基因组DNA提取及PCR扩增采用李红英等[21]的方法提取基因组DNA。PCR扩增体系(20 μL):F-primer与R-primer各0.5 μL(10 μmol·L-1),dNTP 0.4 μL(2.5 mmol·L-1),Taq酶0.2 μL(2.5 U·μL-1),DNA 6 μL (15 ng·μL-1),ddH2O 10.4 μL,Buffer(10×) 2 μL。PCR扩增程序:94 ℃预变性5 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸60 s,28个循环;72 ℃延伸5 min,并于4 ℃保存。
1.4扩增产物电泳检测
6%变性聚丙烯酰胺凝胶进行电泳,对3次电泳完全一致的条带进行统计。
1.5数据分析
采用Excel和SPSS19.0软件对实验数据进行统计分析。利用NTSYSpc 2.10e软件计算SSR遗传相似系数(Dice);应用SAHN程序中的UPGMA方式构建树状图,完成聚类分析[21]。利用Popgene1.32 计算Simpson多样性指数(也称位点多态信息量PIC)以及Shannon-weaver多样性指数(也称基因型多样性H)[21—22]。
2 结果与分析
2.1化学诱变对M4代种子生物学效应的影响诱变自交系 M4代幼苗生长30 d后,采用200、250 mmol·L-1NaCl各处理 7 d,诱变自交系 M4代IV400、IV1600根数增加23.1%、19.1%,诱变自交系IV1600初生根(最早长出的根)根长1、根长2、根长3分别为对照的1.33、1.70、2.15倍;大部分诱变系M4代的芽长降低,只有IV400与对照差异不显著。盐胁迫后,诱变M4代多数芽长降低而根数增加,说明化学诱变改变了玉米诱变系的生根能力,根长增加及根数增多为提高其抗逆能力奠定了基础(表1,图1)。

表1 盐胁迫对诱变玉米自交系 M4代幼苗生长的影响Table 1 Effects of salt stress on seedling growth of M4 maize

图1 化学诱变后代玉米自交系幼苗抗盐性的变化Fig. 1 The seedling salt resistance results of untreated maize line AS-9 and M4 generation of mutagenic line generated from AS-9 treated with mutagens
2.2化学诱变后代的遗传变异分析
2.2.1诱变后代SSR标记分析采用44对可能与根系发育有关的SSR引物进行PCR扩增,筛选出扩增稳定、条带清晰、重复性高、多态性好的引物。根据筛选出的25 对SSR引物对基础材料(IVCK)和7个诱变玉米自交系扩增条带进行统计,共扩增得到69个等位基因,其中,多态性条带总数为50个,多态性百分率达 72.46%,单个引物扩增带变幅 1~2个。位点的多态信息量(PIC)和基因型多样性(H)变化范围分别为0.1103~0.3750和0.2338~0.6931,平均值分别为0.3062和0.5697 (表2)。结果表明,基础自交系AS-9与其诱变自交系之间存在较高的遗传差异。
2.2.2SSR标记遗传相似性分析利用25个可能与根系相关的多态性标记进行统计(表3),所有实验材料间的遗传相似系数在0.5797~0.8841之间。其中,7个诱变系间的遗传相似系数为0.5942~0.8841;各诱变系与AS-9遗传相似系数变化范围为0.5797~0.7101,表明诱变 M4代与AS-9的遗传相似性较低。诱变系IV1400、IV2000与AS-9遗传相似性最低,为0.5797,可见IV1400、IV2000诱变效果明显;诱变系IV400、IV1200尽管与AS-9的相似性最高,可遗传相似系数仅为0.7101,充分说明采用系列化学诱变获得的M4代已发生较为明显的遗传变异。

表2 25对引物在8个自交系中检测到的遗传变异信息Table 2 Genetic variation information for 25 loci detected in 8 maize inbred lines

表3 玉米自交系AS-9及诱变 M4代遗传相似系数Table 3 Genetic similarity coefficient of maize inbred lines AS-9 and mutagenesis M4 generation
2.2.3SSR标记的聚类分析聚类分析显示(图2),遗传相似系数进行中心化后,数据在-0.04处,可将自交系玉米材料分为三个类群,基础自交系IVCK为Ⅰ类;诱变系IV800和IV1200的聚类完全重叠在一起,与IV200、IV400为Ⅱ类;诱变M4代IV1400、IV1600、IV2000聚为Ⅲ类。利用可能与根系相关的标记进行检测,诱变M4与AS-9之间发生了显著的遗传变异,SSR标记的聚类分析结果与遗传相似性分析结果基本一致。

图2 玉米自交系AS-9及诱变自交系M4代进行聚类分析结果Fig. 2 A UPGMA dendrogram ofmaize inbred lines AS-9 andmutagenesis M4 generationbased on 25 SSR markers
2.2.4不同诱变系部分引物 SSR-PCR产物序列变化选取具有扩增多态性,清晰稳定性好的部分引物进行测序,其中 6对引物 bnlg339、umc1064、umc2365、phi10412、bnlg391、umc1993可能与根系的发生及数目关联度较高(表4)。
将SSR-PCR产物测序结果与NCBI和MaizeGDB数据库的序列进行比对(表4),结果显示,不同玉米自交系的短片段序列重复两端是高度保守的,由于实验采用的基础自交系AS-9与数据库的玉米自交系不同,因此SSR-PCR产物基元类型和重复次数表现不同。6对引物均使基础自交系和诱变系的基元重复次数发生了一定的变化,其中标记引物bnlg339、umc1064、phi10412、bnlg391发生了基元重复次数的变化,而umc2365、umc1993不但发生了基元重复的变化,同时出现了新的重复基元。此外,从扩增片段大小的差异来看,umc2365、phi10412、umc1993三对引物检测出基础自交系和诱变系发生非常显著的遗传变异,其中诱变系IV800、IV1200、IV1400、IV1600、IV2000与基础自交系的遗传差异最为明显,这与前述的聚类分析结果一致。

表4 6对SSR引物扩增片段测序结果Table 4 The sequencing results of amplified fragment based on 6 SSR markers
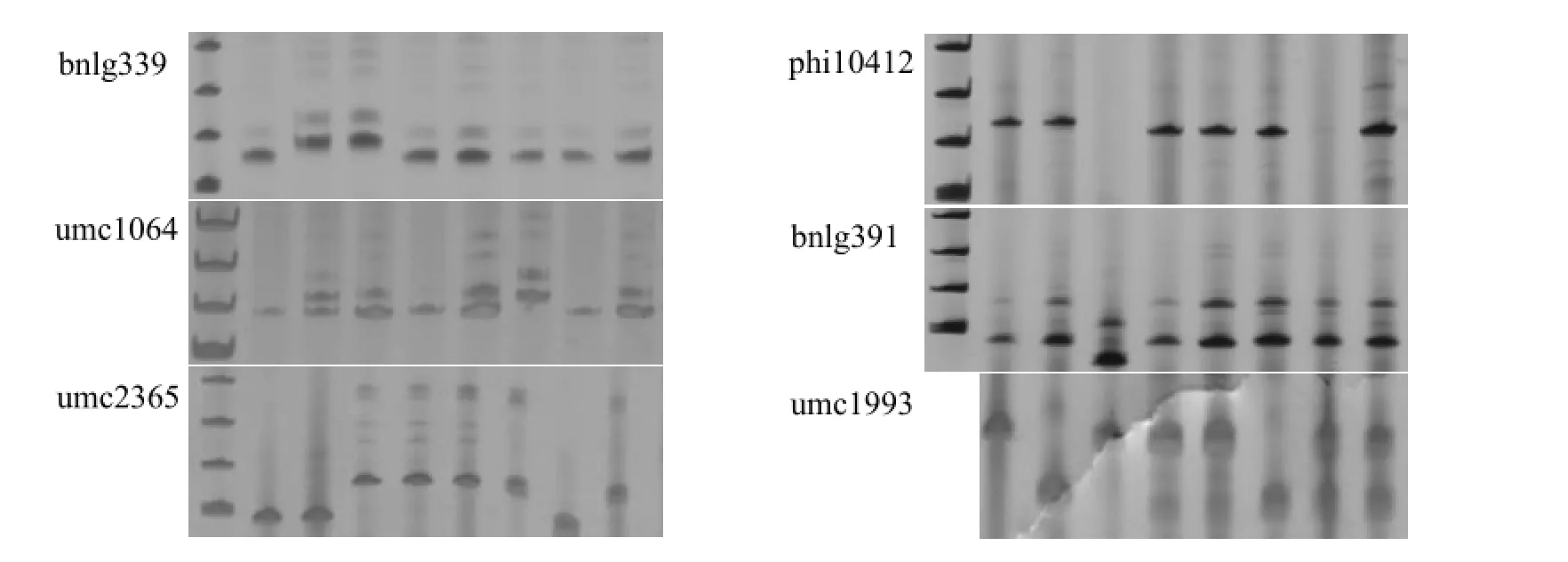
图3 样品在凝胶图谱中的位置Fig. 3 The positions of the samples in the gel maps
3 讨论
化学诱变育种具有经济方便、加快遗传基因重组、提高突变频率、扩大实验材料的突变谱等优点,能够较快地创造有利用价值的突变体。SSR共显性标记能直接在分子水平上反映实验材料的遗传与变异,且不受环境影响[10,23],因此被广泛应用于遗传变异研究。
对实验材料进行表型性状差异分析是鉴定各种诱变产生遗传变异的有效方法[24]。实验表明,化学诱变系M4种子的发芽率、芽长和根数普遍高于对照[21];幼苗经200、250 mmol·L-1NaCl盐胁迫各处理7 d后,诱变系 M4中 Ⅳ400、Ⅳ1600根数比AS-9增加23.1%、19.1%,诱变系Ⅳ1600初生根1、2、3根长分别为对照1.33、1.70、2.15倍(图1,表1)。可见诱变处理显著提高了诱变后代实验材料的种子活力、发芽率,根数和芽长明显增加,同时盐处理后根部性状差异较大,诱变系生物学性状的变化为增强其抗逆能力奠定了基础。
利用各种诱变方法处理玉米自交系后,均产生了不同程度的遗传变异。李奇等[23]利用60Co-γ处理玉米自交系(R08、48-2)种子,选育101份M3株系,与对照平均遗传相似系数为0.8194~0.8373;乔晓等[22]将玉米自交系(K305、K169、698-3)进行航天育种实验,获得的118个诱变后代与各自对照遗传相似系数平均值为 0.6894~0.7924;覃鸿妮等[4]利用 52对SSR引物进行聚类分析,发现大部分诱变系与对照的玉米自交系“082”平均遗传相似系数为0.823,表示化学诱变前后遗传距离较近;Kostova等[25]利用SSR分子标记分析化学诱变玉米的遗传多样性,发现化学诱变使开花时间、产量、颗粒类型、蛋白含量等表型性状及非生物胁迫耐受性等发生了变化,诱变使遗传多样性水平从原始自交系材料的0.608增加到0.651。本实验玉米化学诱变自交系 M4与AS-9遗传相似系数变化范围为0.5797~0.7101,平均值为0.6563(表2),同时位点的多态信息量(PIC)、基因型多样性(H)(表2)、聚类分析(图2)以及SSR-PCR产物序列测序结果(表4)均表明,本实验系列化学诱变获得的诱变系纯合度较高,且在分子水平上发生了较大程度的变异。
Tuberosa等[18]研究Lo964 × Lol0l6的F3家系在水培条件下玉米根系相关性状的QTL,同时还研究了水分胁迫条件下该家系产量性状的QTL,进而分析根系相关性状对产量的影响。张微[19]采用845对SSR引物对亲本综3和87-1进行多态性检测,利用覆盖玉米全基因组的分析标记连锁图,进行玉米苗期根系性状的QTL定位,发现研究中所定位的QTL与其他群体所定位根系相关的QTL具有相同或相似的染色体区间,同时阐明了控制玉米根系的QTL与控制水稻根系的QTL存在广泛同源性关系。
本实验化学诱变系在盐胁迫下根部性状与基础自交系差异显著。采用筛选出的25对与根系性状可能相关的引物对化学诱变系M4进行检测,结果显示,诱变系发生了显著的遗传变异。但由于数量性状在遗传上非常复杂,性状与基因组之间的关系受多种因素调控,同时基因与基因、基因与环境之间还存在明显的互作关系,其表达还受遗传背景的影响[11,26—27],因此化学诱变与根部相关性状之间的关联还有待进一步验证。
[1] 徐明,路铁刚. 植物诱变技术的研究进展[J]. 生物技术进展, 2011,1(2): 90—97.
[2] 魏良明,姜鸿勋,胡学安. 植物诱变新技术及其在玉米育种上的应用[J]. 玉米科学, 2000,8(1): 19—20.
[3] 崔霞,梁燕,李翠,秦蕾,李云洲. 化学诱变及其在蔬菜育种中的应用[J]. 西北农林科技大学学报(自然科学版),2013,41(3): 1—8.
[4] 覃鸿妮,蔡一林,杨春蓉,王国强. 玉米诱变系的SSR遗传变异分析[J]. 核农学报, 2008,22(6): 750—755.
[5] Inukai Y, Sakamoto T, Ueguchi-Tanaka M, Shibata Y,Gomi K,Umemura I,Hasegawa Y,Ashikari M,Kitano H,Matsuoka M. Crown rootless 1,which is essential for crown root formation in rice, is a target of an auxin response factor in auxin signaling[J]. Plant Cell, 2005,17: 1387—1396.
[6] 朱保葛,路子显,耿玉轩,邓向东,谷爱秋. 烷化剂EMS诱发花生性状变异的效果及高产突变系的选育[J]. 中国农业科学,1997,30(6): 87—89.
[7] Braaten D C, Thomas J R, Little R D, Dickson K R, Goldberg I, Schlessinger D, Ciccodicola A, D Urso M. Locations and contexts of sequences that hybridize to poly(dG-dT)·(dC-dA) in mammalian ribosomal DNAs and two X-linked genes[J]. Nucleic Acids Research,1998,16(3): 865—881.
[8] 尹冬冬,安调过,李立会,许红星. 分子标记技术在黑麦研究中的应用[J]. 中国生态农业学报, 2011,19(2): 477—483.
[9] Wang F G, Tian H L, Zhao J R, Yi H M, Wang L, Song W. Development and characterization of a core set of SSR markers for fingerprinting analysis of Chinese maize varieties [DB/OL]. Maydica, 2011,56: 1693.
[10] 刘志斋,吴迅,刘海利,李永祥,李清超,王凤格,石云素,宋燕春,宋伟彬, 赵久然, 赖锦盛,黎裕,王天. 基于40个核心SSR标记揭示的820份中国玉米重要自交系的遗传多样性与群体结构[J]. 中国农业科学, 2012,45(11): 2107—2138.
[11] 张雁明,邢国芳,刘美桃,刘晓东,韩渊怀. 全基因组关联分析: 基因组学研究的机遇与挑战[J]. 生物技术通报, 2013(6): 1—5.
[12] 王倩,毛新国,昌小平,贾继增,刘惠民,景蕊莲. 小麦 TaSnRK2.10的多态性及与农艺性状的关联[J]. 中国农业科学2014,47(10): 1865—1877.
[13] Gupta P K, Rustgi S, Kulwal P L. Linkage disequilibrium and association studies in higher plants: Present status and future prospects[J]. Plant Molecular Biology, 2005,57: 461—485.
[14] Zondervan K T, Cardon L R. The complex interplay among factors that influence allelic association[J]. Nature Reviews Genetics, 2004,5(2): 89—100.
[15] 赵曦,王荣焕,于永涛,王天宇,黎裕. 关联分析在玉米遗传学研究中的应用[J]. 玉米科学, 2008,16(1): 52—55.
[16] Agrama H A, Eizenga G C, Yan W. Association mapping of yield and its components in rice cultivars[J]. Molecular Breeding, 2007,19: 341—356.
[17] Eizenga G C, Agrama H A, Lee F N, Yan W, Jia Y. Identifying novel resistance genes in newly introduced blast resistant rice germplasm[J]. Crop Science, 2006,46: 1870—1878.
[18] Tuberosa R,Sanguineti M C, Landi P. Identification of QTLs for root characteristics in maize grown in hydroponics and analysis of their overlap with QTLs for grain yield in the field at two water regimes[J]. Plant Molecular Biology, 2002,48: 697—712.
[19] 张微. 利用RIL群体定位玉米苗期根系QTL的研究[D]. 北京: 中国农业大学硕士学位论文, 2005.
[20] 高世斌,冯质雷,李晚忱,荣廷昭. 干旱胁迫下玉米根系性状和产量的QTLs分析[J]. 作物学报, 2005,31(6): 718—722.
[21] 李红英,卢存福,兰小中,陈玉珍. 玉米自交系AS-9化学诱变后代SSR遗传变异分析[J]. 华北农学报, 2013,28(3): 92—101.
[22] 乔晓,石海春,柯永培. 玉米航天诱变 SP3 株系的遗传变异分析[J]. 玉米科学, 2012,20(3): 15—21.
[23] 李奇,石海春. 玉米自交系48-2和R08辐照后代M3株系遗传变异的SSR分析[J]. 核农学报, 2011,25(6): 1100—1106.
[24] 秦家友,石海春,柯永培,余学杰,袁继超. 玉米辐射诱变系表型及SSR遗传差异研究[J]. 玉米科学, 2012,20(2): 41—47.
[25] Kostova A, Todorovska E, Christova N, Hristov K, Atanassov A. Assessment of genetic variability induced by chemical mutagenesis in elite maize germplasm via SSR markers[J]. Crop Improvement, 2006,16( 1—2): 37—48.
[26] 杨小红,严建兵,郑艳萍,余建明,李建生. 植物数量性状关联分析研究进展[J]. 作物学报, 2007,33(4): 523—530.
[27] 赵振卿,顾宏辉,盛小光,虞慧芳,王建升,曹家树. 作物数量性状位点研究进展及其育种应用[J]. 核农学报, 2014,28(9):1615—1624.
Genetic Variation Analysis of Salt-tolerant Mutant from Maize Inbred Lines (AS-9)
YANG Feng-jiao, LI Hong-ying, LU Cun-fu, CHEN Yu-zhen
(National Engineering Laboratory for Tree Breeding, Key Laboratory of Genetics and Breeding in Forest Trees and Ornamental Plants, Ministry of Education, College of Biological Sciences and Biotechnology, Beijing Forestry University, Beijing 100083, China)
Chemical mutation was an effective way of creating new germplasm resources. To analyze the impact of chemical mutagenesis on AS-9 maize inbred offspring, the salt tolerance and genetic variation between mutant M4 and the corresponding original material (AS-9) were evaluated by using 44 pairs of SSR markers that may be associated with root traits. Seed germination, bud length and root number of M4 were higher than that of AS-9. After treatment with 200 and 250 mmol·L-1NaCl for 7 days, root numbers of IV400 and IV1600 seedlings were higher than that of AS-9, with increases of 23.1% and 19.1%, respectively. IV1600 primary root lengths of 1, 2, 3 were 1.33, 1.70,and 2.15 times longer than that of AS-9, respectively. Twenty five pairs of SSR primers gave profiles amplified in sample of M4 mutants, accounting for 56.82% of the total pairs of primers. The average value of genetic similarity coefficient between IVCK and M4 was 0.6563. With the centered genetic similarity coefficient of -0.04 by UPGMA, the maize inbred line materials were divided into three groups: the original material (IVCK), the M4 mutants including IV1400, IV1600, IV2000, and other M4 mutants (IV200, IV400, IV800, IV1200). Principal component analysis and clustering results were similar. In addition, SSR-PCR products amplified by six pairs of primers were sequenced, the results showed that there was distinct variation between AS-9 and the induced M4, indicating chemical mutagenesis made maize inbred AS-9 produce a wide range of genetic variation.
maize; inbred lines; chemical mutagenesis; SSR markers; genetic variation
10.3969/j.issn.1009-7791.2015.01.001
S513
A
1009-7791(2015)01-0001-07
2014-12-24
国家科技支撑计划项目(2011BAI13B06);国家自然科学基金(31270737) ;北京市自然科学基金(6112016)
杨凤娇,硕士研究生,从事植物分子生物学研究。E-mail: yfj0704029@163.com
注:杨凤娇与李红英为同等贡献作者;陈玉珍为通讯作者。E-mail: chenyuzhen@bjfu.edu.cn

