两种肺复张策略治疗先心病术后呼吸窘迫综合征的疗效比较
郭长英,陈 英,陈慧娟
(郑州市第七人民医院(郑州市心血管病医院),河南 郑州 450016)
两种肺复张策略治疗先心病术后呼吸窘迫综合征的疗效比较
郭长英,陈 英,陈慧娟
(郑州市第七人民医院(郑州市心血管病医院),河南郑州450016)
目的 比较两种肺复张策略(LRM)治疗全身麻醉先心病术后呼吸窘迫综合征(ARDS)患儿的疗效。方法 选取2012年12月~2014年12月我院收治的先心术后ARDS患儿40例作为研究对象,将其随机分为控制性肺膨胀(SI)组和呼气末正压递增(IP)组,各20例。在机械通气(24~48 h)内分别应用SI和PI进行LRM,并比较两组患儿治疗前后的氧合指数、肺顺应性、心率、平均动脉压、中心静脉压的变化。结果 LRM前后患儿的氧合指数、肺顺应性比较,差异均有统计学意义(P<0.05);组间比较平均动脉压(MAP)、中心静脉压(CVP)及心率变化,差异无统计学意义(P>0.05);复张后MAP、CVP及心率均很快恢复到复张前水平。结论 LRM对先心术后ARDS患儿的早期应用,可提高其肺顺应性和氧合指数。
LRM;小儿先心术后,ARDS;疗效
心脏手术能够明显改善患者的生存率和生活质量,肺部并发症是手术早期严重并发症之一[1],导致ARDS常见的危险因素为:手术、体外循环缺血再灌注、输血相关的肺损伤及药物相关性肺损伤等,心脏术后患者ARDS的死亡率达80%[2]。目前治疗ARDS的多项研究推荐综合疗法,肺复张的肺保护策略成为研究热点[3],尤其是小儿先心病术后常见的低心排导致血流动力学不稳定伴随低氧,LRM在先心术后ARDS中的应用,更成为研究中的重点,现报道如下。
1 资料与方法
1.1一般资料
选取2012年12月~2014年12月我院收治的先心术后ARDS患儿40例作为研究对象,其中男15例,女25例;平均年龄(14.2±7.3)个月,体重(10.7±4.6)kg;主动脉阻断时间(65.5±30.9)min;行房间隔缺损修补术5例,行法洛氏四联症根治术22例,行右室双出口(DORV)根治术7例,完全性肺静脉异位引流根治术6例。将患儿随机分为SI组和IP组,各20例。两组患儿一般资料比较,差异无统计学意义(P>0.05)。见表1。
表1 两组患者一般资料比较(±s)
表1 两组患者一般资料比较(±s)
组别 n(男/女) 年龄(月) 体重(kg) 主动脉阻断时间(min)SI组 20(8/12) 13.15±6.73 9.37±3.29 59.50±26.31 IP组 20(7/13) 12.13±7.08 10.08±4.32 61.37±22.29
1.2纳入标准
①全身麻醉体外循环先天性心脏病术后1~8岁患儿;②急性起病(术后48~72 h);严重氧合障碍:氧合指数(PaO2/FiO2)≤300 mmHg且呼气末正压通气(PEEP)>5 cmH20;④床旁X线胸片示肺水肿浸润影;⑤无左房高压的临床证据;⑥需有创正压通气支持;⑦血流动力学相对稳定。
1.3排除标准
①入选后因复苏失败而死亡;②肺复张过程中出现:SpO2下降>10%,SpO2<85%,心律失常或心率(HR)<80次/min(1~2岁)、<60次/min(2~8岁)、增至160次/min或增加20次/min,血压下降,收缩压(SBP)<65 mmHg(1~4岁)或<80 mmHg(5~8岁),出现气压伤;③血流动力学不稳定(DA>20 μg/kg/min,Epi>0.2 μg/kg/min)。
1.4操作方法
患者手术后转入ICU应用机械通气,呼吸机均应用Drager呼吸机,初始参数设置为:同步间歇指令通气(SIMV)模式(PCV+PSV),吸入氧浓度(FiO2)45%,潮气量6 ml/kg,呼吸频率16~24次/min,呼吸末正压(PEEP)3 cmH2O,通气30 min后做血气分析。达到入选标准后,给予芬太尼咪达唑仑联合镇静,可以联用肌松剂达到RASS评分-4~-5分。
SI组改行持续正压通气(CPAP)模式,吸气压力为25 cmH2O,持续30 s[4]。
IP组压力控制通气(PCV)15 cmH2O,FiO2100%,逐步升高PEEP水平,每隔5 min增加5 cmH2O直至25 cmH2O,随后每隔5 min降低5 cmH2O直至2~3 cmH2O[5]。
随后两组均改行分组前通气模式。复张前后观察有无气胸发生。
1.5 监测记录
记录肺复张前5 min及复张后(1 h)时段的血气分析结果,并计算PaO2/FiO2;同时记录患者肺复张前后呼吸机肺顺应性参数;记录肺复张前后MVP压最低值及CVP最高值及心率最高值。
1.6统计学方法
应用SPSS 19.0统计学软件对所得数据进行分析,计量资料以“±s”表示,采用t检验;计数资料采用x2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1氧合指数及肺顺应性
两组肺复张后氧合指数及肺顺应性的变化均高于复张前,差异有统计学意义(P<0.05);患者肺复张过程中的HR、CVP高于肺复张前、MAP低于复张前,但差异无统计学意义(P>0.05)。见表2。
表2 两组患儿各项指标比较(±s)
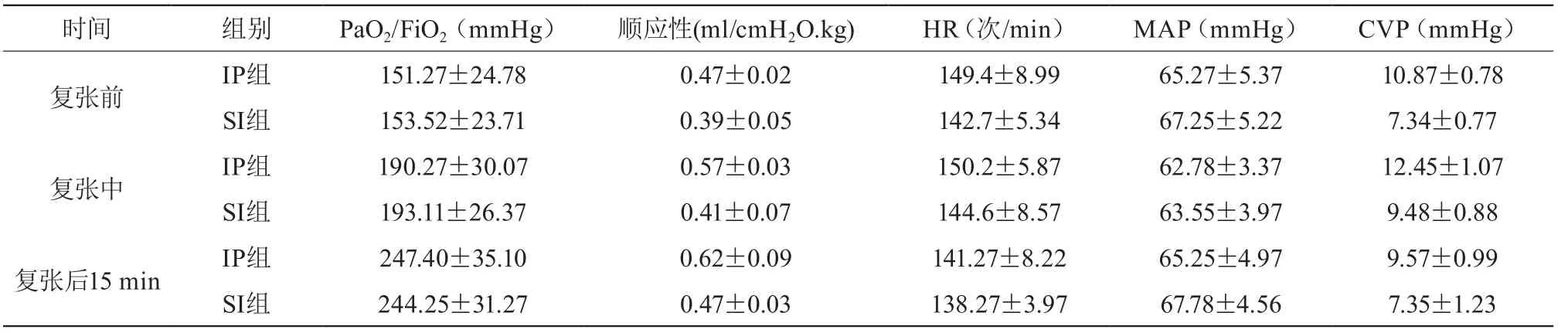
表2 两组患儿各项指标比较(±s)
时间 组别 PaO2/FiO2(mmHg) 顺应性(ml/cmH2O.kg) HR(次/min) MAP(mmHg) CVP(mmHg)复张前 IP组 151.27±24.78 0.47±0.02 149.4±8.99 65.27±5.37 10.87±0.78 SI组 153.52±23.71 0.39±0.05 142.7±5.34 67.25±5.22 7.34±0.77复张中 IP组 190.27±30.07 0.57±0.03 150.2±5.87 62.78±3.37 12.45±1.07 SI组 193.11±26.37 0.41±0.07 144.6±8.57 63.55±3.97 9.48±0.88复张后15 min IP组 247.40±35.10 0.62±0.09 141.27±8.22 65.25±4.97 9.57±0.99 SI组 244.25±31.27 0.47±0.03 138.27±3.97 67.78±4.56 7.35±1.23
2.2并发症
所有患儿未出现气胸,未出现明显心律失常。
3 结 论
LRM通过持续或间歇性增加跨肺压力,促使ARDS的大量塌陷肺泡得到最大可能的开放,改善肺部病变,达到改善氧合[6]。巴西的第一个儿科和新生儿机械通气共识中,推荐血氧饱和度达到90%~95%进行LRM是有必要的[7]。
Gernoth[8]等对心脏术后的机械通气患儿实施肺复张,其动态顺应性、氧合均得到改善。Esan[9]等认为在肺复张使氧合明显改善后,应继续使用高PEEP以保证复张的肺不再塌陷。其次,肺复张实施的时机直接影响复张效果。有研究发现ARDS早期(前72 h)应用LRM的效果优于中晚期使用[10]。一些学者认为,采用步增高PEEP的LRM能使ARDS萎陷的肺泡扩张,在LRM后,需要较高的PEEP来维持肺泡的扩张。PEEP和LRM的联合应用能较好地逆转肺不张和减少它的发生。
目前临床上所采用的LRM种类较多,包括高PEEP水平复张、SI、PCV等。常用的LRM如SI:采用CPAP维持气道平台压在30~40 cmH2O,持续30~40 s,然后调整到基础通气模式。PI是在限制气道峰值压在40 cmH2O的前提下,逐步升高PEEP水平,每次增加5 cmH20,维持30 s,直到PEEP达到25~35 cmH2O,然后逐渐降低PEEP,维持30 s,最后恢复基础通气模式,PEEP保持高于复张前2 cmH2O。增加呼气末正压的肺复张达到增加ARDS患儿换气通气功能和安全性已被证实[11]。Tingay等对早产儿进行SI和逐渐加大潮气量的LRM,增加呼气末残气量较好分布,在引发肺损伤方面无差异[12]。
本次研究中,观察比较两组患儿的动脉血气分析、血流动力学和呼吸力学三方面的指标。通过两种LRM方式治疗后,两组患儿的氧合指数均升高,顺应性明显上升,说明两种方法均能改善ARDS患儿氧合指数和肺顺应性。患者肺复张过程中的HR、CVP高于肺复张前,MAP低于复张前,但差异无统计学意义(P>0.05)。随后的监测中无明显变化,说明两种LRM方式未对患儿的血流动力学产生过度影响。从并发症来看,两组患儿都能够耐受LRM治疗,无气胸等并发症发生。
综合所述,认为高PEEP和SI两种LRM都能一定程度改善ARDS患儿的氧合状态,并能使启改善维持30~60 min,同时患儿对两种LRM耐受性均较好,无明显不良反应。有研究认为LRM因使用较高压力和较长时间,有导致气压伤和血流动力学波动的危险。因此对于小儿ARDS的LRM治疗有效性及安全性尚需要进一步证实。
[1] Milot J, Perron J, Lacasse Y, et al. Incidence and predictorsof ARDS after cardiac surgery. Chest,2001,1(19):884-888.
[2] Rubenfeld GD, Caldwell E, Peabody E, et al.Incidence and outcomes of acute lung injury. N Engl JMed,2005,35(3):1685-1693.
[3] Barbas CS, de Mattos GF, Borges Eda R. Recruitment maneuvers and positive end-expiratory pressure/tidal ventilation titration in acute lung injury/acute respiratory distress syndrome: translating experimental results to clinical practice.Crit Care,2005,9:424–426.
[4] Kheir JN, Walsh BK, Smallwood CD, etal. Comparison of 2 lung recruitment strategies in children with acute lung injury. Respir Care,2013,58:1280-1290.
[5] Boriosi JP, Sapru A, Hanson JH,etal. Efficacy and safety of lung recruitment in pediatric patients with acute lung injury [J].Pediatr Crit Care Med,2011,12:431-436.
[6] Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome. The Acute Respiratory Distress Syndrome Network. [J].N Engl J Med,2000,342:1301-1308.
[7] Valente Barbas CS.Lung recruitment maneuvers in acute respiratory distress syndrome and fancilitating.[J].Crit care Med,2003,31(1):265-271.
[8] Gemoth c,wagner G,Pelosi Petal.Respiratory and hamemodynamic changes durings during decremental open lung positive end-expiratory pressure titration in patients with acute respiratory distress syndrome.[J].Crit care,2009,13(2):59.
[9] Khemani RG,Conti D,A10nzo TA,et a1.Effect of tidal volume in children with acute hypoxemic respiratory failure [J].Intensive Care Med,2009,35:1428-1437.
[9] Jardin F.Recruitment maneuvers during lung protective ventilation in acute respiratory distress syndrome[J].Am J Respir Crit Care Med,2003,1:167-169.
[10] Boriosi JP, Cohen RA, Summers E,etal.Lung aeration changes after lung recruitment in children with acute lung injury: a feasibility study [J]. Pediatr Pulmonol,2012,47:771-779.
[11] Tingay DG, Polglase GR, Bhatia R, etal.Pressurelimited sustained inflation vs. gradual tidal inflations for resuscitation in preterm lambs.[J].Appl Physiol,2015,118:890-897.
[12] Caironi P, Cressoni M,Chiumello D,etal.Lung Opening and Closing during Ventilation of Acute Respiratory Distress Syndrome[J].Am J Respir Crit Care Med,2010,18:578-586.
本文编辑:张 钰
R563.8
B
ISSN.2095-6681.2015.18.050.03

