1-(4-溴苯基)-5-苯基-1H-1,2,3-三氮唑键合人血清白蛋白的作用机制及抗菌活性
张 宁, 岳玉林, 吴秀丽, 吴禄勇, 莫峥嵘, 司宏宗, 舒火明, 何文英*
(1.海南师范大学化学化工学院,海南海口 571158;2.青岛大学计算科学与工程技术研究中心,山东青岛 266071;3.海南经贸职业技术学院,海南海口 571127)
图1 BPTA的化学结构式Fig.1 The structure of BPTA
1,2,3-三氮唑化合物具有广泛的生理活性,它易与生物体内多种酶和受体结合,已经被用于多肽、DNA、RNA和糖类等化合物结构修饰中,并表现出良好的效果,在医药领域发挥越来越重要的作用而成为目前新药研发的重点领域之一[1,2]。1-(4-溴苯基)-5-苯基-1H-1,2,3-三唑(1-(4-bromophenyl)-5-phenyl-1H-1,2,3-triazole,BPTA)(结构见图1)是新合成的一种三氮唑类化合物[3],作为一种潜在开发利用的药物小分子,系统研究它的抗菌活性及其与人体内生物大分子的相互作用还未见报道。血清白蛋白由于在哺乳动物体内起着重要的贮存和运输作用,也是药物的一种非常重要的运输载体,故常用作研究与药物小分子相互作用的模型蛋白[4,5]。
本文在模拟生理条件下结合分子模拟、荧光偏振、同步及三维荧光等方法研究了BPTA与人血清白蛋白(HSA)的相互作用,确定了键合参数及作用力模式,定性分析了BPTA对HSA二级结构及微环境的影响。通过研究BPTA与HSA的相互作用及抗菌活性,不仅揭示了BPTA生物活性的新信息,而且对于设计BPTA类新药,筛选相关药物等都具有非常重要的指导意义。
1 实验部分
1.1 仪器与试剂
F-7000型荧光光度计(日本,日立公司);RF-5301PC型荧光光度计(日本,岛津公司);TU-1901型双光束紫外-可见分光光度计(北京普析通用仪器有限责任公司);BS124S电子天平(德国,赛多利斯);pH-3S酸度计(上海精密仪器厂)。
BPTA(海南师范大学有机化学重点实验室提供,纯度>99.9%,分子量为301)储备液浓度1.70×10-3mol·L-1,用甲醇配制。三羟甲基氨基甲烷(Tris,国药集团化学试剂有限公司)-HCl缓冲溶液:用超纯水溶解并用HCl调节pH至7.40,配制成浓度为0.05 mol·L-1的缓冲溶液。人血清白蛋白(HSA,上海伯奥生物科技有限公司)溶液用pH=7.40 Tris-HCl 缓冲溶液配制,储备液浓度3.0×10-5mol·L-1,于 4 ℃暗处保存。其他试剂均为分析纯。实验用水为超纯水。
1.2 实验方法
1.2.1BPTA的结构优化及与HSA的分子模拟利用SYBYL7.3软件获得化合物的三维结构,再根据Tripos力场对各种最合理分子的起始构象进行能量优化,以能量最低者(生成热)为药效构象;用共轭梯度法进一步优化BPTA分子结构。分子模拟步骤为:先从Brookhaven蛋白质数据库中获得HSA的晶体结构(编号为1h9z),根据Tripos力场,用kollman-all-atom电荷计算出HSA三维结构的势能;再用Surflex程序来确定BPTA与HSA分子之间的相互作用模式[6]。
1.2.2荧光偏振度及同步荧光的测定实验选择激发与发射狭缝宽度均为5 nm,依据文献方法[7],以激发波长280 nm,发射波长348 nm测定荧光偏振;以230 nm为激发波长,290 nm为发射波长测定同步荧光(△λ=60 nm)。
1.2.3三维荧光光谱实验选择择激发和发射狭缝宽度均为5 nm,分别测定激发波长在230~325 nm范围,发射波长在230~480 nm范围的三维荧光光谱。
1.2.4紫外吸收光谱依次移取一定量的HSA和BPTA储备液于10 mL比色管中,用pH=7.40的Tris-HCl 缓冲溶液定容,以试剂空白为参比,扫描HSA-BPTA体系在200~350 nm范围内的紫外吸收光谱。
1.2.5键合参数及热力学参数的测定实验选择激发/发射波长为280/348 nm,采用荧光滴定法,分别测定温度299 K、309 K和319 K下BPTA-HSA体系的荧光强度,再依据相应的公式[8]计算结合常数。
1.2.6位点标记的竞争实验采用荧光滴定法,向BPTA-HSA体系分别加入一定量的Phenylbutazone (PB)、Flufenamic(FA)和Digitoxin(Dig),分别作为位点Ⅰ、位点Ⅱ、位点Ⅲ的标记药物[9]。选择激发/发射波长为280/348 nm,测定HSA-BPTA体系在温度298 K的荧光强度。
1.2.7抗菌活性测定选取大肠杆菌、白色葡萄球菌、金黄色葡萄球菌、枯草芽孢杆菌、蜡状芽孢杆菌、四联球菌、藤黄八叠球菌及白色念珠菌作为实验菌,以环丙沙星药物做对照,用微量稀释法进行抗菌药物的初步筛选[10]。
2 结果与讨论
2.1 BPTA分子的优化结构及光学活性
图2 BPTA的优化结构Fig.2 The optimized structure of BPTA
图2为优化的BPTA分子的三维结构,计算得到其最高占有轨道能量(HOMO)为-8.9604 eV,最低未占分子轨道能量(LUMO)为-4.1663 eV。
图3为常温下BPTA在甲醇中的荧光光谱,图中曲线a为激发波长为296 nm时,BPTA的荧光发射光谱,显示最大发射峰位置在366 nm处;而曲线b为发射波长为366 nm时,BPTA的激发光谱。表明浓度在10-3mol·L-1数量级条件下,BPTA有较强的荧光强度,这是由于BPTA分子中存在部分的共轭π键结构,也存在N的给电子取代基的原因[11]。
图4为BPTA在Tris-HCl缓冲溶液中的紫外-可见光谱,呈现明显的双峰,其最大吸收波长位于206 nm,应是苯环的E2特征吸收带(204 nm)发生的红移,一是溴原子作为助色团的存在,二是溶剂效应,Tris-HCl缓冲液是水溶液体系。另在245 nm 处有一肩峰,推断是BPTA分子中部分共轭骨架的π-π*跃迁导致的K吸收带[12]。通过制作标准曲线,获得BPTA在Tris-HCl缓冲液中的摩尔吸光系数ε为3.365×104L·mol-1·cm-1。
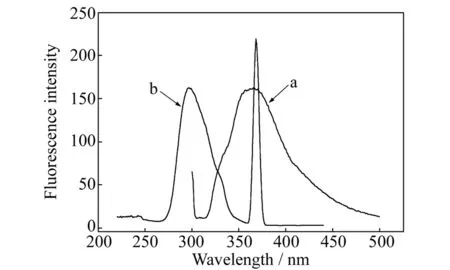
图3 BPTA在甲醇中的荧光发射光谱及激发光谱Fig.3 Fluorescence spectra of BPTA in methanol a:emission spectra;b:excitation spectra.cBPTA=1.3×10-3 mol·L-1.
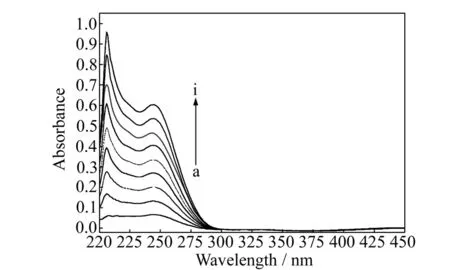
图4 BPTA在Tris-HCl缓冲溶液中的紫外-可见光谱Fig.4 UV-Vis spectra of BPTA in Tris-HCl buffer a-i:cBPTA:3.33,6.67,10,13.33,16.67,20,23.33,26.67,30 (×10-6 mol·L-1);T=298 K.
以上结果表明BPTA分子不仅有较大的空间位阻,也具有良好的光谱特征,可为今后研发BPTA作为新型药物的设计及分析其含量提供科学合理的依据。

图5 BPTA与HSA的模型对接图(HSA的氨基酸残基用飘带状表示,BPTA用棍状表示)Fig.5 The binding mode between BPTA and HSA,only residues around 8 Å of BPTA is displayed The residues of HSA are represented using ribbon model and the BPTA structure is represented using ball and stick model.
2.2 BPTA与HSA作用的结合位点确定
图5为BPTA键合HSA的分子模拟图。可看出,HSA分子有合适的空间容纳BPTA分子,而BPTA分子也可以键合在HSA分子的疏水腔内,整个分子呈非平面结构,且很靠近HSA分子的苯丙氨酸(Phe)134和酪氨酸(Tyr)160,这不仅是BPTA与HSA的键合存在疏水作用的一个有力证据,也表明BPTA能猝灭HSA的內源荧光,与后面的有关荧光光谱法的测定结果一致。另外,还显示出BPTA与HSA氨基酸残基的精氨酸(Arg)117位(距离:2.029 Å 和2.509 Å)及(Arg)186(距离:2.271 Å) 位可形成三个氢键,这就使得体系的亲水性降低,疏水性增大。这些结果均说明BPTA键合HSA的反应是自发进行的,作用力的模式主要是疏水作用,兼有氢键作用。
为确定BPTA与HSA作用的结合位点,选择对HSA具有特异结合性的三种竞争试剂Phenylbutazone (PB)、Flufenamic(FA)和Digitoxin(Dig)分别作为空间区域位点Ⅰ、Ⅱ、Ⅲ 的标记药物[13]。结果表明,与不加竞争试剂时的结合常数K值和结合位点数n值相比,均发生较大程度的变化。其中加入FA标记药物时,K值和n值的变化最明显,说明BPTA与HSA的结合在位点Ⅱ,但结合位点数却很小,进一步说明FA是HSA高选择性的位点Ⅱ标记物,随FA的加入,与BPTA竞争位点Ⅱ,使得BPTA的结合位点数减少。
2.3 BPTA与HSA作用的光谱表征
通过改变BPTA的浓度测定HSA的荧光偏振值。结果显示,在不同温度(309 K与319 K)下,随BPTA浓度的增大(0~40.00×10-6mol·L-1),荧光偏振值的变化不明显,且数值都较小(均小于0.05)。说明温度对荧光偏振值的影响不大;较小的偏振值暗示BPTA与HSA结合得松,结合后的大分子弛豫时间短,使HSA在从螺旋到无规卷曲伸展变化时,由于挠性增大,故荧光偏振就小[14]。
在蛋白质分子中,同步荧光(△λ=60 nm)呈现的是Trp残基的光谱特征[13]。图6为BPTA-HSA体系的同步荧光光谱图。可以看出:BPTA的存在猝灭了HSA的Trp残基荧光,荧光强度从115降至90左右,其最大荧光发射峰位置基本未变,说明BPTA对HSA微环境有一定影响。
蛋白质的约210 nm处的峰是肽键的强吸收峰,其最大吸收峰反映其α-螺旋结构的信息[15]。图7为HSA、BPTA及BPTA-HSA体系的紫外光谱图。可看出HSA最大吸收波长位于206 nm左右,随BPTA浓度的增加,HSA-BPTA体系的吸收强度相应增加,虽最大吸收波长的位置未发生变化,但峰形与BPTA的吸收峰形有明显差异(图4)。以上结果说明:BPTA确实与HSA发生了相互作用,使得HSA的α-螺旋结构发生一定变化。
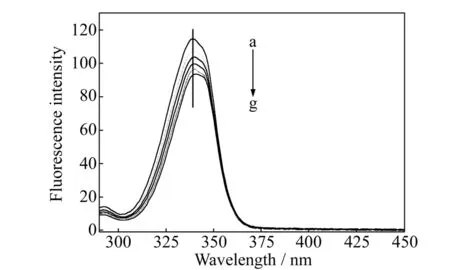
图6 BPTA-HSA体系的同步荧光光谱图(△λ=60 nm)Fig.6 Synchronous fluorescence spectra of BPTA-HSA system(△λ=60 nm) a:cHSA=3.0×10-6 mol·L-1;b-g:cBPTA:6.67,13.33,20.00,26.67,33.33,40.00(×10-6 mol·L-1).

图7 BPTA-HSA体系的紫外(UV)光谱图Fig.7 UV spectra of BPTA-HSA systems cHSA=2.0×10-6 mol·L-1;a-f:cBPTA:0,2.67,5.33,8.00,10.67,13.33(×10-6 mol·L-1);T=298 K.
图8为HSA-BPTA体系的三维荧光光谱。可看出,两种荧光光谱图的峰形均呈现规则形状;随BPTA浓度的加大,BPTA猝灭了HSA的内源色氨酸残基的荧光,且最大发射波长从350 nm红移至360 nm。一是由于BPTA的分子结构中存在的三氮唑环上的N原子为给电子基团,导致荧光光谱产生位移,及吸收光强度的增大(图7);二是加入BPTA后,使得HSA的微环境极性增大,从而形成规则的发射光谱[8]。以上均说明BPTA的存在对HSA的色氨酸残基所处的微环境引起的差异,也表明了HSA分子中构象的变化。

图8 (A) HSA的三维(3D)荧光光谱图(cHSA=3.0×10-6mol·L-1);(B) BPTA-HSA体系的三维(3D)荧光光谱图(cBPTA=4.0×10-5mol·L-1) Fig.8 (A) The 3D fluorescence spectra of HSA(cHSA=3.0×10-6mol·L-1);(B) The 3D fluorescence spectra of BPTA-HSA system(cBPTA=4.0×10-5 mol·L-1)
2.4 BPTA对HSA作用的荧光猝灭机理
在模拟生理条件(pH=7.40 的Tris-HCl缓冲液)下,选取三个不同温度(299 K、309 K及319 K)进行荧光滴定的测定,获得Stern-Volmer图(略)及KSV值(表1),猝灭曲线的斜率即猝灭常数KSV值均为103数量级,猝灭速率常数均大于2.0×1010L·mol-1·s-1,且随温度的增大而减小,再结合吸收光谱(图7),表明BPTA对HSA的荧光猝灭机理为静态猝灭[13]。
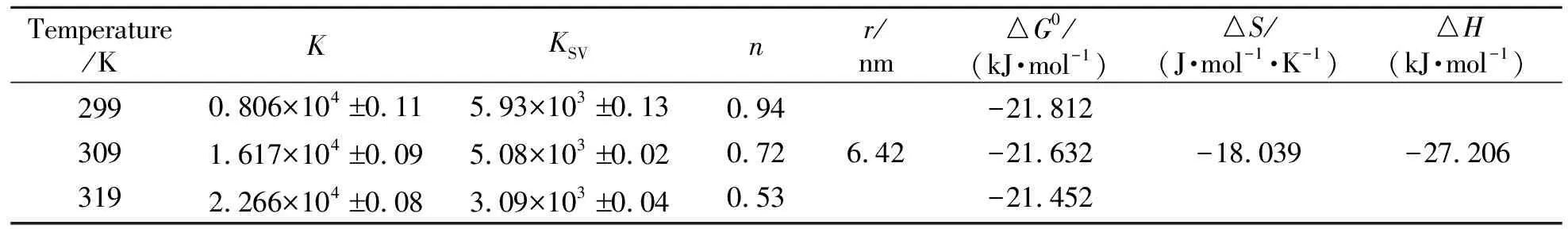
表1 不同温度下BPTA-HSA的键和常数及热力学常数
2.5 BPTA与HSA的键合参数及模式确定
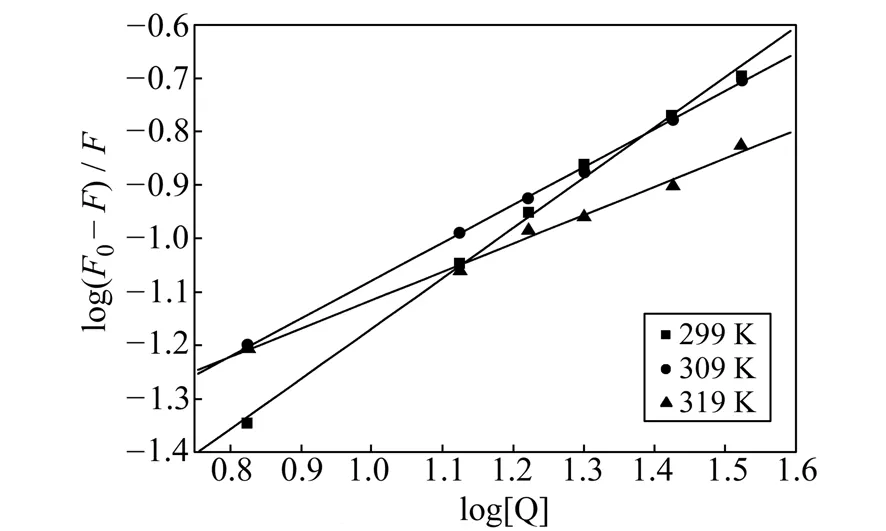
图9 BPTA-HSA体系的Stern-Volmer图Fig.9 The Stern-Volmer plot for BPTA-HSA systems cHSA=3.0×10-6 mol·L-1.pH=7.40;λex=280 nm,λem=348 nm.
在不同温度下进行荧光滴定实验,依据修饰的Stern-Volmer公式求得键合常数及键合位点数[13,16],见表1及图9,可看出BPTA与HSA的键合常数K值(104数量级)都较大,且随温度的增大,K值呈增大趋势,而键合位点数n呈减小趋势。说明BPTA对HSA的键合作用较强,且温度的变化会影响键合常数的大小。
利用Van’t Hoff方程,根据不同温度下KSV的值可求得BPTA与HSA作用的热力学常数(表1),△G值表明BPTA与HSA的键合过程是自发进行的;△H值及△S值表明氢键和范德华力为主要的键合模式。综合分子模拟与热力学计算的结果,得出:BPTA主要以疏水作用、氢键及范德华力键合HSA。
根据Förster 非辐射能量转移理论[13],将HSA看做能量转移给体,BPTA为能量转移受体,测定HSA的荧光光谱与BPTA的吸收光谱重叠图(图略),求得光谱重叠部分的积分值为2.424×10-14cm3·L·mol-1,临界距离R0为4.02 nm,r值为6.42 nm。结果表明:在BPTA与HSA之间确实发生了非辐射能量转移;同时BPTA在HSA的结合位置与Trp残基之间的距离r值小于7 nm,这也与前面的分子模拟结果相一致。
2.6 BPTA的抗菌活性
据报道,在临床上引起系统性真菌感染的菌株主要是念珠菌属;致病性大肠杆菌是医学和兽医学临床感染中最常见的病原菌之一;葡萄球菌是最常见的化脓性球菌,是医院交叉感染的重要来源;枯草芽孢杆菌是革兰氏阳性细菌,是一些重要工业酶制剂的生产菌;蜡状芽孢杆菌是常见的食品污染菌;四联球菌是重要的食品腐败性细菌;藤黄八叠球菌属革兰氏阳性细菌,是一种常用的抗生素测试菌。本文用微量稀释法测定BPTA对以上8种病原菌的抑制活性。实验表明,BPTA对藤黄八叠球菌,大肠杆菌没有表现出抑制活性(呈阴性结果),但是对其他6种菌类均存在明显的抑制活性(呈阳性结果)。这些结果表明BPTA 可作为一种潜在的新型抗菌药物,有待进行更深入地研究及开发应用。
3 结论
研究了新合成的三氮唑化合物BPTA的抗菌活性及其与HSA的相互作用。几种荧光光谱法测定的结果表明BPTA的存在影响了HSA的微环境及二级结构;分子模拟确定了BPTA在HSA 上的键合区域及模式,位点竞争实验确定了BPTA 在 HSA 上的位点Ⅱ键合。热力学参数表明BPTA键合HSA的模式主要为氢键和范德华作用,与分子模拟的结果部分一致。获得不同温度下的键合常数说明BPTA与HSA有较强的键合作用。从分子水平上了解了BPTA与模型蛋白的键合反应及作用机制。以上的结果为进一步开发利用BPTA提供了一定的理论指导。

