Smads蛋白家族在大鼠放射性肝纤维化形成过程中的表达
高世乐,胡宗涛,秦 峰,朱 杰,黄德武,董六一
(1. 解放军第105医院肿瘤三科,合肥 230031;2. 安徽医科大学,安徽省实验动物中心,合肥 230032;3. 安徽医科大学药理学教研室,教育部抗炎免疫药理学重点实验室,国家中医药管理局中药药理三级实验室,合肥 230032)
Smads蛋白家族在大鼠放射性肝纤维化形成过程中的表达
高世乐1,胡宗涛1,秦峰1,朱杰1,黄德武2,董六一3
(1. 解放军第105医院肿瘤三科,合肥 230031;2. 安徽医科大学,安徽省实验动物中心,合肥 230032;3. 安徽医科大学药理学教研室,教育部抗炎免疫药理学重点实验室,国家中医药管理局中药药理三级实验室,合肥 230032)
目的探讨Smad2/3/7、TGF-β1蛋白在大鼠放射性肝纤维化(RHF)形成过程中的表达情况。方法建立雄性SD大鼠RHF模型。将实验大鼠随机分为正常对照组、照射组(2周、4周、8周、12周、26周),除正常对照组外,其余各组大鼠均制备成RHF模型。在照射后第2周、4周、8周、12周、26周末,分别剖检各组大鼠,取肝脏标本备用。光学显微镜下观察大鼠肝脏组织HE染色变化,免疫组织化学法测大鼠肝脏组织Smad2/3/7、TGF-β1蛋白含量表达。结果与正常对照组相比,照射组大鼠肝脏损伤及纤维化程度明显增加,肝脏组织免疫组织化学Smad2蛋白含量增加(P<0.05),Smad3、TGF-β1蛋白含量明显增加(P<0.01),Smad7蛋白含量明显减少(P<0.01)。结论随着大鼠RHF的加重,Smad2/3、TGF-β1蛋白表达增加,Smad7蛋白表达下调。
Smads蛋白家族;大鼠;放射性肝纤维化(RHF)
肝脏是中度辐射敏感器官之一,在受到较大剂量照射时,会出现急性放射性肝损伤、肝功能损害、进行性肝纤维化、乃至个体死亡[1]。由于放疗在腹部肿瘤中的广泛运用,尤其是近年来常规放疗(conventional radiotherapy,CR)、三维适形放疗(three-dimensional conformal radiotherapy,3-DCRT)、调强放疗(intensity modulated radiation therapy,IMRT)、伽马刀治疗(gamma knife treatment,γ-T)在肝脏恶性肿瘤治疗中的应用增加,越来越多的肝脏恶性肿瘤患者因个体差异不能耐受治疗剂量,影响放疗疗程,部分患者甚至影响远期疗效和晚期生活质量。因此制备放射性肝纤维化(radioactive hepatic fibrosis,RHF)动物模型,研究其作用机制对临床防治RHF显得十分重要[2]。
肝纤维化(HF)是各种原因引起的慢性肝病向肝硬化转变的共同病理过程,其机制是肝脏细胞外基质异常增生与过度沉积[3]。HF的形成主要经TGF-β1/ Smads信号传导通路转导,在此过程中,Smad3蛋白是TGF-β1/Smads信号转导通路过程中的关键信号蛋白,TGF-β1起中心环节作用[4]。有文献[5]报道,可通过抑制Smad3蛋白的表达,而抑制TGF-β1/ Smads信号传导通路的转导,从而阻断甚至逆转HF的产生。本文作者初步探讨了Smads蛋白家族在大鼠RHF中的可能作用机制,为临床预防治疗RHF提供理论基础和实验依据。
1 材料与方法
1.1实验动物
清洁级雄性SD大鼠,5~6周龄,体质量200± 20 g,由安徽医科大学实验动物中心提供 [SCXK(皖)2011-007]。饲养于安徽医科大学实验动物中心[SYXK(皖)2011-007],温度20±2℃,相对湿度50%~70%。
1.2试剂
Smad2/3/7、TGF-β1 II抗免疫组织化学试剂盒: 北京博鳌森生物技术有限公司;I抗试剂盒: 武汉博士德生物工程有限公司;0.01 mmol/L磷酸盐缓冲液(PBS): 北京中杉金桥生物技术有限公司,ZLI-9061;0.01 mmol/L pH6.0柠檬酸盐缓冲液(CBS): 北京中杉金桥生物技术有限公司,ZLI-9066。
1.3仪器
NOVA型切片机: 瑞典LKB;QP切片漂烘温控仪: 安徽电子科学研究所;美国VARIN21-EX直线加速器: 美国瓦里安医疗器械公司;单光子共聚焦成像系统: Lecia公司;Nikon ACT-1 中文版(Nikon 80i萤光显微镜): 新飞达光学仪器公司;JEDR801D形态学图像分析系统Version6.0: 捷达科技有限公司。
1.4方法[6]
将实验大鼠随机分为正常对照组和5个照射组(2周、4周、8周、12周、26周),各组大鼠均给予体积分数10%水合氯醛0.3 mL/100 g麻醉,全身麻醉生效后,大鼠取仰卧位,固定四肢,直线加速器下照射大鼠右半部肝脏,每只大鼠右侧胸腔、胃肠、左肝及其它周边重要器官均用10 cm厚铅块遮挡,源皮距100 cm,剂量率600 cGy/min,3 000 cGy/1F,照射野2 cm×2 cm;正常对照组只麻醉,不照射。照射组大鼠于照射后第2周、4周、8周、12周、26周周末,分批全身麻醉后剖检,取肝右叶体积分数10%甲醛液固定,常规石蜡包埋。正常组大鼠于第4周末处死做对照,标本收集同上。
1.4.1肝脏组织HE病理组织学观察肝脏组织脱蜡至水、透明、包埋、切片,厚4 μm;依次给予二甲苯脱蜡、酒精复水、苏木精染色、酒精脱水、伊红染色、烤干、二甲苯透明、封片。光学显微镜下观察,肝损伤评分标准[7]见表1。
1.4.2肝脏组织免疫组织化学法测定Smad2/3/7、TGF-β1含量采用链霉亲和素生物素过氧化物酶复合物(SABC)法,石蜡切片常规二甲苯脱蜡、酒精水化、柠檬酸盐缓冲液抗原修复,再自然冷却;体积分数3%H2O237 ℃温育,5%正常山羊血清37 ℃封闭,加I抗(50 μL),4 ℃过夜;次日复温,加II抗,滴加SABC液,DAB显色5 min,苏木精复染,二甲苯透明,中性树胶封片,再烤干。

表 1 肝纤维化病理分级判定标准
在各肝组织内随机选取10个视野(×400),染色,以胞膜、胞质出现棕黄色或黄褐色沉淀物为阳性表达。
1.4.3统计学方法用SPSS15.0统计分析软件进行处理,实验数据以平均数±标准差(x-±s)表示,多组数据间采用单因素方差分析或卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1各组大鼠肝脏病理组织学变化
正常对照组大鼠肝小叶结构形态正常,肝细胞索由中央静脉向四周排列整齐,无明显变性、坏死,汇管区、胆管结构正常(图1A)。照射组大鼠第2周末胶原纤维从汇管区或中央静脉向外延伸(图1B);第4周末胶原纤维延伸明显,但尚未相互连接包绕整个肝小叶(图1C);第8周末胶原纤维延伸连接,包绕整个肝小叶(图1D);第12周末胶原纤维包绕分割肝小叶,正常肝小叶结构破坏,假小叶形成以六方形为主(图1E);第26周末肝小叶完全破坏,假小叶形成以小圆形为主,假小叶间可见增粗的胶原纤维(图1F)。
照射组各组大鼠肝脏组织胶原纤维半定量评分同正常对照组相比,自第2周开始升高,至第26周达峰值,除第2周差异无统计学意义外,其余各组差异均P<0.01,反映照射组大鼠自第2周开始至第26周,随着照射后时间的延长,肝脏内胶原纤维逐渐增多,范围由汇管区、中央静脉逐渐包绕至整个肝小叶,肝脏损伤逐步加重(表2)。

图 1 大鼠肝脏病理组织学变化(HE×400)

表 2 大鼠肝脏组织胶原纤维半定量评分(HE×400)
2.2大鼠肝脏组织Smad2/3/7、TGF-β1含量的变化
2.2.1Smad2蛋白含量的变化正常对照组大鼠肝脏组织Smad2蛋白表达较少,为棕黄色或棕褐色颗粒沉积于肝细胞胞质、胞膜以及中央静脉或汇管区(图2A)。照射组第2周末Smad2蛋白表达较正常对照组稍增多(图2B);第4周末Smad2蛋白表达较正常对照组增多,且多于第2周末(图2C);第8周末Smad2蛋白表达较正常对照组进一步增多,且多于第2周和第4周末,达到峰值(图2D);第12周末Smad2蛋白表达较正常对照组、第2周和第4周末进一步增多,但略低于第8周末(图2E);随着照射时间的延长,第26周末Smad2蛋白表达较第12周末增加,但仍低于第8周末(图2F)。

图 2 大鼠肝脏组织免疫组织化学Smad2蛋白表达(×400)
2.2.2Smad3蛋白含量的变化正常对照组大鼠肝脏组织Smad3蛋白表达较少,为棕黄色或棕褐色颗粒沉积于肝细胞胞质、胞膜以及中央静脉(图3A)。照射组第2周末Smad3蛋白表达较正常对照组增多(图3B);第4周末Smad3蛋白表达较正常对照组及第2周末组进一步增多(图3C);第8周末Smad3蛋白表达较正常对照组、第2周和第4周末持续增多(图3D);第12周末Smad3蛋白表达较正常对照组、第2周和第4周末、第8周末明显增多,达到峰值(图3E);但第26周末Smad3蛋白表达较第12周末稍减少,仍高于其余各组表达(图3F)。
2.2.3Smad7蛋白含量的变化正常对照组大鼠肝脏组织Smad7蛋白表达较多,为棕黄色或棕褐色颗粒沉积于肝细胞胞质、胞膜以及中央静脉(图4A)。照射组第2周末Smad7蛋白表达较正常对照组稍减少(图4B);第4周末Smad7蛋白表达较正常对照组及第2周末组进一步减少(图4C);第8周末Smad7蛋白表达较正常对照组、第2周和第4周末继续减少(图4D);第12周末Smad7蛋白表达较正常对照组、第2周和第4周末、第8周持续减少,达到谷值(图4E);但第26周末Smad7蛋白表达较第12周末稍增加,仍低于其余各组表达(图4F)。

图 3 大鼠肝脏组织免疫组织化学Smad3蛋白表达(×400)
图 4 大鼠肝脏组织免疫组织化学Smad7蛋白表达(×400)
2.2.4TGF-β1蛋白含量的变化正常对照组大鼠肝脏组织TGF-β1蛋白表达较少,为棕黄色颗粒沉积于肝细胞胞质、胞膜(图5A)。照射组第2周末TGF-β1蛋白表达较正常对照组增多(图5B);第4周末TGF-β1蛋白表达较正常对照组及第2周末组进一步增多(图5C);第8周末TGF-β1蛋白表达较正常对照组、第2周和第4周末持续增多(图5D);第12周末TGF-β1蛋白表达较正常对照组、第2周和第4周末、第8周末明显增多,达到峰值(图5E);但照射组第26周末TGF-β1蛋白表达较第12周末稍减少,仍高于其余各组表达(图5F)。
2.2.5Smad2/3/7及TGF-β1蛋白平均吸光度值表达免疫组织化学法测定结果详见表3。
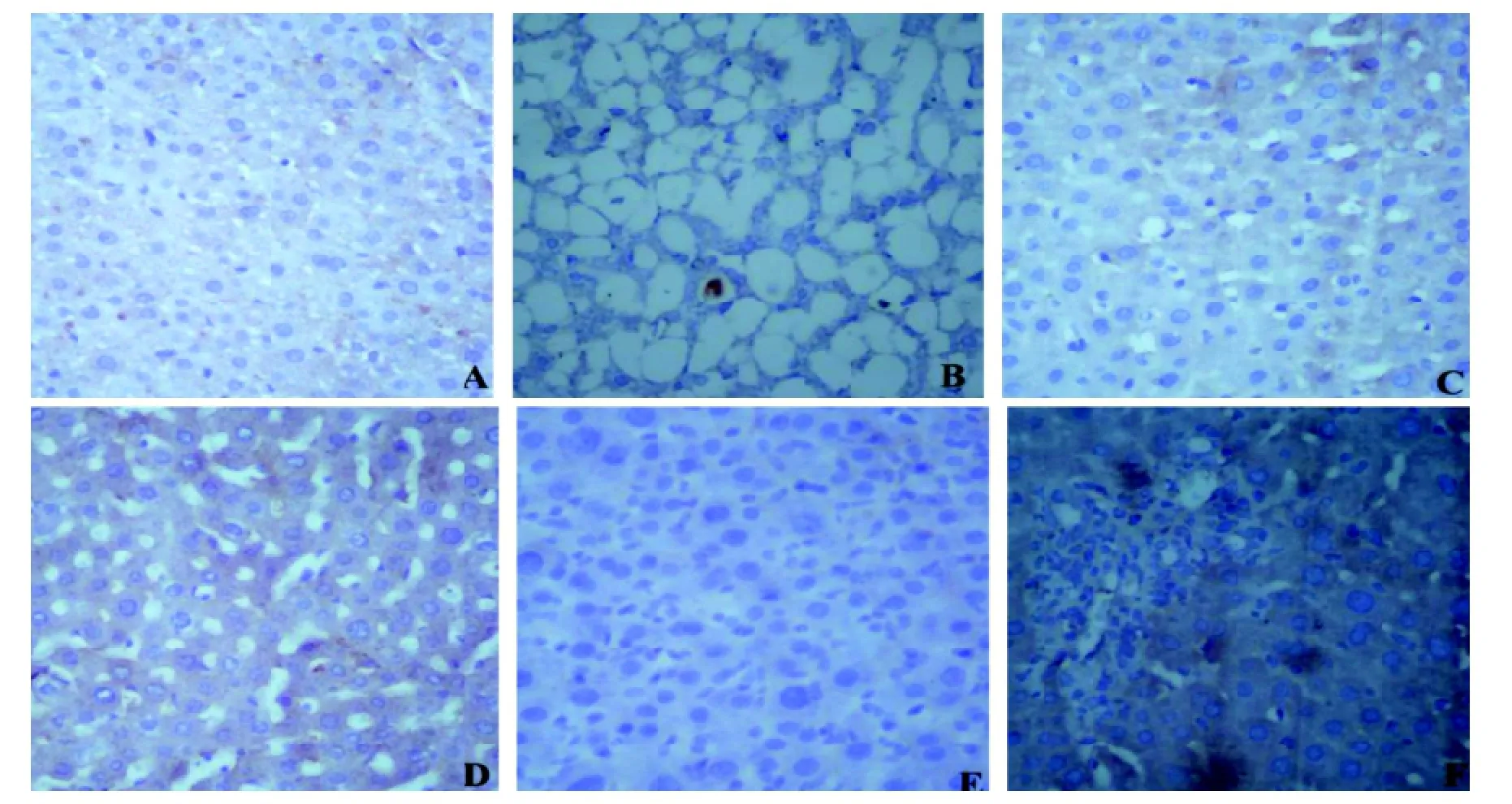
图 5 大鼠肝脏组织免疫组织化学TGF-B1蛋白表达(×400)

表 4 Smad2、Smad3、Smad7、TGF-β1蛋白平均吸光度值表达
3 讨论
RHF是肝脏恶性肿瘤放疗过程中的主要并发症,局部常规分割剂量Dt 50~60 Gy[8],单次大剂量照射(>30 Gy)可引起明显肝损伤[9]。在治疗剂量的同时,不可避免地引起放疗区正常肝脏细胞的损伤,引起急性放射性肝损伤和肝纤维化。因此,探讨RHF的发生机制,为临床预防治疗提供理论依据,确保有效临床靶区剂量治疗的同时,减少肝脏损伤,提高治疗效果。
RHF在国内、外已成研究热点,彭瑞云等[7]通过建立大鼠RHF模型,指出肝脏受损伤时,HSC激活,细胞外基质增生过多与降解减少,是导致肝纤维化形成的重要机制。HSC激活后经TGF-β1/ Smads信号转导通路转导,Smads蛋白家族是把TGF-β1与其受体结合后产生的信号从胞质转导到细胞核内的信号中介分子。
Smads蛋白家族[10]主要有: ①受体激活型Smad (R-Smad),包括Smad1、2、3、5、8;②通用型Smad(Co-Smad),仅有Smad4;③抑制型Smad (I-Smad),包括Smad6、7。其中R-Smad对TGF-β1/ Smads 信号转导起促进作用,I-Smad起抑制作用,其转导过程均需Co-Smad参与完成[11]。通过以下途径完成: TGF-β1先与TβRⅡ二聚体结合,随后与TGF1-βⅠ二聚体形成异四聚体进而作用于胞质内下游分子,开启信号传导,激活Smad2和Smad3,使Smad2 和Smad3分子磷酸化,磷酸化后的Smad 2 和Smad 3 与Smad 4 形成异源寡聚物,将TGF-β1信号从胞质向胞核部位聚集,调控靶基因转录[12]。
Smad2 和Smad3具有较高的同源性,都是由高度保守的N-末端结构域又称mad同源体1(MH1)和C-末端结构域(MH2)构成,其结构主要区别在于MH1,Smad2的MH1比Smad3多了2个氨基酸片段,使得Smad3可直接与DNA结合,产生信号转导[13]。有文献[14]报道,Smad2主要表达在静止的肝星状细胞(HSC),Smad3主要表达在活化的HSC,而HSC只有被激活后才转化为肌成纤维细胞,因此Smad3是介导TGF-β1引起肝纤维化的关键分子,Smad 3与肝纤维化形成的关系更为密切,呈正相关作用。研究表明,TGFβ1的大多数促纤维化作用是由Smad3介导的,证实在大鼠实验性肝纤维化过程中伴有Smad3表达水平的明显增加[15,16]。此外,Smad7与TβRⅠ竞争性结合后,干扰Smad 2、3 与Smad 4结合,使与R- Smads结合的TGFβ1- TβR子I- TβR II三重复合物减少,即Smad7抑制TGF-β1/ Smads传导,产生抗纤维化作用[17]。而Smad4是转导TGF-β1信号的重要胞质内信号级联分子,受体激活型Smad需与Smad4结合后形成寡聚体,才能发挥TGF-β1/Smads通路的生物学效应;同样,抑制型Smad也需与Smad4相互结合后,才能抑制TGF-β1信号的传导。因此抑制Smad3蛋白表达,可抑制TGF-β1/Smads信号传导通路,阻止甚至逆转肝纤维化。
本实验采用美国直线加速器单次大剂量照射大鼠右半肝,成功复制了急性放射性肝损伤和肝纤维化模型,模仿人体在放疗过程中产生的肝脏损伤。放射性肝损伤和肝纤维化的诊断要点为:肝脏病理学检查及受损肝细胞区域有放疗史。因此本文作者通过动态观察受照射大鼠肝脏不同时间点肝脏病理组织学以及相关细胞因子免疫组织化学的改变,探讨其可能发生的作用机制。
光学显微镜下观察,自第2周部分受照射大鼠出现肝细胞明显水肿、气球样变;4~8周可见肝细胞点状坏死,汇管区炎性细胞浸润;12周出现碎片状和桥接状坏死,部分形成肝纤维化;26周坏死区纤维间隔形成,可见假小叶,肝纤维化进一步加重,少数发展成肝硬化、甚至肝腹水,与文献报道基本一致。
免疫组织化学观察,可见与肝纤维化发生机制相关的Smad2/3/7、TGF-β1蛋白于肝脏细胞质和胞膜上呈棕黄色或棕褐色颗粒沉积,而正常组无或少量改变。随着照射后时间延长,Smad2/3改变与肝纤维化进展过程呈正比,其中Smad3至第4周上升,第12周时表达呈最高峰,第26周部分损伤下降。而Smad7的表达呈相反,与文献报道基本相符。上述结果初步得出,单次大剂量照射大鼠右半肝脏,可诱发RHF发生,随着肝纤维化的进展,Smad2/3蛋白均表达于细胞质并逐渐增加,提示其发生机制与TGF-β1/Smad信号传导通路有关,有明显的促纤维化作用,并可作为检测RHF的指标。所测指标平均光密度值与正常对照组的差异具有统计学意义(P<0.05或P<0.01)。
在RHF的过程中,对与其发生机制密切相关的TGF-β1/Smads通路的研究,有助于为其防治提供新的可能途径。Smads蛋白为TGF-β1受体下游的主要信号转导因子,对Smads蛋白的干预可明显逆转肝纤维化,可为进一步研究提供方向。Smad2/3的表达对肝纤维化起促进作用,抑制Smad2/3的表达可以减轻肝纤维化;Smad7是TGF-β1信号转导的负性调控蛋白,提高Smad7肝内表达,可阻断肝纤维化的发展。
由此可见,RHF的形成是在Smads蛋白家族的共同作用下完成的,阻止和逆转肝纤维化,是防止肝纤维化发生的关键,深入了解TGF-β1/Smads信号转导通路对于防治肝纤维化具有重要意义。
[1]Nishmura SL. Integrin-mediated transforming growth factorbeta activation,a potential therapeucic target in fibrogenic disorders [J]. Am J Pathol,2009,175(4):1362-1370.
[2]吕涛,姚希贤. TGF-β1/Smad信号传导通路与肝纤维化[J].河北医科大学学报,2012,33(6):735-740.
[3]Parsons CJ,Takashima M,Rippe RA. Molecular mechanismsof hepatic fibrogenesis [J]. J Gastroen Hepatol,2007,22:79-84.
[4]Baucer M,Schuppan D. TGF-beta l in liver fibrosis: time to change paradigms? [J]. FEBS Lett,2001,502(1-2):1-3.
[5]Takayama S,Hatori M,Kunhara Y,et al. Inhibition of TGF-betal suppresses motility and invasiveness of oral squamous cell carcinoma cell lines via modulation of integrins and downregulation of matrix-metallopteinascs [J]. Oncol Rep,2009,21(1):205-210.
[6]胡宗涛,高世乐,秦峰,等. 芍药苷对大鼠放射性肝纤维化的保护作用及机制研究[J]. 解放军药学学报,2012,4(28): 283-286.
[7]赵军宁,宋军,王晓东,等. 芍药苷对CCl4肝纤维化大鼠的作用研究[J]. 中药药理与临床,2009,25(2):8-10.
[8]王若峥,张国庆. 肿瘤放射治疗学[M]. 北京: 科学出版社,2009.
[9]彭瑞云,王德文,高亚兵,等. 肥大细胞在放射性肝纤维化中的改变与作用的研究[J]. 中华医学与防护杂志,1994,14(1):30-31.
[10] Savage C,Das P,Finelli AL ,et al. Caenorhabditis elegans genes sma-2,sma-3,and sma-4 define a conserved family of transforming growth factor β pathway components [J]. Proc Natl Acad Sci USA,1996,93(2):790-794.
[11] 丁秀娟. TGF-β信号转导通路与肺癌关系的研究现状[J].实用肿瘤学杂志,2008,22(6):562-565.
[12] Bai S,Cao X. A nuclear antagonistic mechanism of inhibitory Smads in transforming growth factor beta signaling [J]. J Biol Chem,2002,277(6):4176-4182.
[13] Roberts AB,Russo A,Felici A,et al. Smad3 a key player in pathogonetic mechanisms dependment on TGF-β [J]. Ann NY Acad Sci,2003,995:1-10.
[14] Liu C,Gaca MD,Swenson ES,et al. Smad2 and Smad3 are differentially activated by transforming growth factor-β (TGF-β) in quiescent and activated hepatic stellate cells[J]. J Biol Chem,2003,278(13):11721-11728.
[15] Flanders KC. Smad3 as a mediator of the fibrotic response [J]. Int J Exp Pathol,2004,85:47-64.
[16] 高世乐,胡宗涛,董六一. 赤芍总苷对大鼠放射性肝纤维化的保护作用及机制[J]. 中药药理与临床,2012,28(2): 65-68.
[17] 郑著家,高歌,李长福. 中药红景天对肝组织中ALR mRNA的影响及可能的抗纤机制探讨[J]. 实用肿瘤学杂志,2008,22(2):108-109.
Expression of Smads Protein Family in Radiationinduced Rats Liver Fibrogenesis
GAO Shi-le1,HU Zong-tao1,QIN Feng1,ZHU Jie1,HUANG De-wu2,DONG Liu-yi3
(1. The 3rd Tumor Section,105th Hospital of Chinese PLA,Hefei 230031,China;2. Anhui Laboratory Animal Center,Anhui Medical University,Hefei 230032,China;3. Department of Pharmacology,Key Laboratory of Anti-inflammatory and Immunopharmacology,Ministry of Education,Key Laboratory of Chinese Medicine Research and Development,State Administration of Traditional Chinese Medicine,Anhui Medical University,Hefei 230032,China)
ObjectiveTo investigate the expression of Smad2/3/7、TGF-β1proteins in radioactive liver fibrosis process of rats. MethodsThe experimental animal model of radioactive liver fibrosis was established in male SD rats. The rats were randomly divided into normal control group and irradiated groups (2,4,8,12 and 26 weeks),except normal control group,other groups all were made into model of radioactive liver fibrosis. The rats were sacrificed and isolated liver tissue as backup on 2nd、4th、8th、12th、26th weekend after radiation. The changes of rats liver tissue was detected by HE staining under light microscope. The expression of rats liver tissue Smad2/3/7、TGF-β1 proteins was detected by immunohistochemitry staining. ResultsCompared with the normal control group,the liver injury and liver fibrosis of irradia ted groups were increased obviously,Smad2 proteins content of liver tissue increased(P<0.05),Smad3、TGF-β1 proteins content increased obviously (P<0.01),and Smad7proteins content reduced obviously (P<0.01). ConclusionWith the aggravation of radioactive liver fibrosis in rats,the expression of Smad2/3、TGF-β1 proteins increased,the expression of Smad7 proteins reduced.
Smads proteins family;Rats;Radioactive liver fibrosis(RHF)
Q95-33
A
1674-5817(2015)03-0188-07
10.3969/j.issn.1674-5817.2015.03.003
2014-08-25
解放军第105医院重点课题(No.2010YG12)
高世乐(1982-),男,硕士,研究方向: 放射性肝纤维化。E-mail: gslhf0551@163.com胡宗涛(1972-),共同第一作者,男,博士,副主任医师,研究方向: 肿瘤放疗。E-mail: huxuyan@163.com
董六一(1973-),男,博士,教授,研究方向: 肿瘤药理学。E-mail: dongly@ahmu.edu.cn

