MnO2纳米空心球的制备及其电化学性能
汪晓莉,郑玉婴,刘先斌
MnO2纳米空心球的制备及其电化学性能
汪晓莉,郑玉婴,刘先斌
(福州大学材料科学与工程学院,福建福州 350116)
采用水热法通过添加Ce离子制备了MnO2纳米空心球电极材料。Ce离子对MnO2的形貌和结晶程度有很大的影响,添加Ce离子后生成由纳米棒组成的中空球,中空球比表面积(BET)达到315.2 m2·g-1。MnO2电极电化学测试结果表明:当铈锰摩尔比为0.2时电极材料具有较好的电化学性能,其比电容达到178.6 F·g-1,与未加Ce离子相比其比电容提高了2.6倍,而且经过1000次循环稳定性测试后比电容仍保留了90.5%。这些结果表明添加Ce离子有利于形成中空结构,并提高了MnO2电极的比电容。
二氧化锰;纳米结构;水热;电化学;超级电容器
引 言
目前,随着电动汽车和便携式电子产品需求的日益增加,超级电容器已经成为最有前途的能量储存设备之一,它是介于传统电容器和二次电池之间的一种环境友好、无可替代的新型储能、节能装置,既具有电容器快速充放电的特点又具有电化学电池的储能机理[1-2]。电极材料作为决定超级电容器性能的重要因素,成为研究的重点。对电极的研究主要集中在制备出高比能量、高电容、高比功率及高性价比的活性物质。过渡金属氧化物,如RuO2[3]、Co3O4[4]、MnO2[5]和NiO[6],因其高于碳材料的理论比电容和高于导电聚合物的循环稳定性而受到广泛关注。
MnO2具有多样化的晶体结构、良好的电化学性能以及对环境友好和成本低等特征[7],中空结构具有比表面积大、密度小和孔容大等优异的性能。基于这些特点,制备出超级电容器用中空MnO2电极材料具有很大的应用前景。近几年,有很多研究通过使用表面活性剂[8]和模板(如球形二氧化硅[9]、碳球[10]、聚苯乙烯微球[11]和胶束[12])来制备中空MnO2电极材料,这种制备方法在后续过程中需要去除模板和表面活性剂,增加了实验过程,破坏了中空结构。与模板法相比,基于自组装的无模板法更加简便和环保。目前,有一些研究通过添加Fe3+[13]、K+[14]、NH+4[14]和Cu2+ [15]来影响MnO2的结晶结构和形貌,这些研究表明通过改变离子的价态和离子的种类可以控制合成不同结构和形貌的MnO2。所以,本研究通过添加Ce来研究其对MnO2结构和形貌的影响,并探讨不同添加量和不同反应时间对MnO2结构形貌和电化学性能的影响。
1 实验部分
1.1 样品的制备
实验所用试剂浓硫酸、MnSO4·H2O、KMnO4、-甲基吡咯烷酮(NMP)、乙炔黑和聚偏氟乙烯(PVDF)均为AR,来自上海市国药集团化学试剂有限公司;Ce(NO3)3·6H2O(AR)来自上海晶纯生化科技股份有限公司。所得纳米中空球结构如图1所示。
具体实验步骤如下:将1.69 g MnSO4·H2O溶解在50 ml去离子水中,依次缓慢加入2 ml浓硫酸、0.948 g KMnO4,再加入不同比例的Ce(NO3)3·6H2O,磁力搅拌10 min形成均匀的均相溶液。将上述混合溶液转入100 ml反应釜中,在150℃下反应。过滤,用去离子水反复洗涤,直到滤液pH接近7,烘干得到样品。记为CM()。
1.2 样品的表征
样品的晶型结构和晶粒大小采用日本理学Rigaku-Dmax/3C型X射线衍射仪表征,Cu靶,Ka辐射,扫描范围2=10°~90°,扫描步长0.02°,扫描速率5(°)·min-1。样品的表面微观形貌通过德国蔡司型(FE-SEM,Supra-55)场发射扫描电子显微镜进行观察,用日本产JEM-100CXII透射电子显微镜(TEM)观察样品内部组织形态与结构。样品的比表面积(BET)利用美国麦克仪器公司比表面积与孔径分析仪(ASAP2020)测定。
1.3 电极制备与电化学测试
研究电极按MnO2:乙炔黑:PVDF=80:15:5(质量比)混合均匀,滴加几滴NMP,将混合物调成糊状之后,均匀涂覆于预先处理好的泡沫镍集流体(1 cm×1 cm)上形成电极,干燥后压片成型,用于后续电化学测试。
表征电极材料最重要的指标就是材料的电化学性能,这些性能的测试在中国上海辰华公司的CHI660D电化学工作站上进行,主要包括循环伏安(CV)和恒电流充放电。测试采用三电极体系,实验所制备的电极作为工作电极,Pt片电极和Ag/AgCl电极分别作为辅助电极和参比电极。所有测试的电解液均为1 mol·L-1的Na2SO4水溶液,测试电位范围为0~0.8 V。
2 结果与讨论
2.1 MnO2球的结构和形貌的表征
图2和图3分别为不同反应时间下得到的MnO2的XRD谱图和SEM图。从XRD图可以看出不同反应时间下样品的结晶性明显不同。当反应时间为10 min时,得到的MnO2结晶性略差,没有出现(002)、(541)和(312)晶面的衍射峰。随着水热反应时间的增加,样品的结晶程度增加,CM(0.5 h)样品在(002)和(541)晶面出现了衍射峰,CM(1 h)和CM(2 h)样品与CM(10 min)和CM(0.5 h)样品相比还出现了(312)晶面的衍射峰,而且在(110)、(200)、(310)、(211)、(411)和 (521) 晶面的衍射峰强度增强明显,峰更尖锐,出现的特征峰与文献报道的结果基本相同[16],因此样品的主晶相为a-MnO2。由SEM图可以看出,反应时间为10 min和2 h时MnO2纳米颗粒相互黏结堆积,反应时间为0.5 h和1 h时MnO2的球形较好且球径较均匀。
为了研究Ce离子对MnO2的形貌和结晶状态的影响,控制其他变量,研究了一系列不同铈与锰摩尔比的MnO2样品。图4~图6给出了反应1 h下得到的MnO2样品的XRD谱图和形貌图。
从XRD谱图可以看出Ce离子对样品的结晶结构有很大的影响。CM0(铈锰摩尔比为0)的衍射峰较弱,仅在(211)和(310)晶面出现较强的衍射峰,说明样品结晶性较差。这是因为不添加Ce离子时反应体系生成的MnO2是均相成核过程,纳米颗粒通过粒子表面自由能聚集在一起,MnO2纳米颗粒倾向于形成无定形的固体球[13,17],得到的样品形貌如图5(a)所示,没有形成MnO2纳米球,样品由纳米棒杂乱地堆积在一起。添加Ce离子后,相比CM0样品,晶面衍射峰强度都有了明显的增大,而且还出现了(600)、(002)、(541)和(312)晶面的衍射峰,表现出a-MnO2的特征峰。加入Ce离子后,得到的样品纳米棒簇更加紧凑地聚集在一起,随着Ce离子量的增加,这些纳米棒簇逐渐聚集成纳米球。这是因为添加Ce离子后增加了溶液的化学势,这有利于一维纳米结构的生长。而且Ce离子的存在增加了反应体系中离子的强度,降低了反应速率,提高了成核速率以及纳米颗粒的聚集速率,随着反应的进行,这些纳米棒从球表面生长出来,形成了由外层纳米棒组成的稳定的球结构。当Ce离子量过多时,纳米颗粒的聚集速率过快,导致纳米球之间互相黏结成更大的颗粒,如图5(d)所示,CM1纳米球互相黏结。当Ce离子适量时,成核速率和纳米棒的聚集速率适宜,得到的样品球形比较明显,如图5(c)和图6(a)所示,CM0.4和CM0.2样品的球形比较明显。进一步对CM0.2(1 h)样品进行TEM和HRTEM表征,如图6(b)所示,从该结构黑暗的边缘和苍白的中心之间的对比可以看出为中空结构,而且纳米中空球的球径约为260 nm。
2.2 X射线光电子能谱(XPS)分析
为了分析CM样品的组成及Ce离子的化学状态,利用X射线光电子能谱仪对CM0.2(1 h)样品进行全谱扫描和表面Ce元素精细谱分析。图7(a)是CM0.2(1 h)样品在0~1200 eV范围内的XPS全谱图。从图中可以看出,样品中含有 C、O、Mn、Ce元素,在结合能为285 eV位置处的峰对应于C1s[18],在530 eV对应于O1s,在642 eV和50 eV分别对应于Mn2p和Mn3s[19]。根据XPS图谱定量分析,可知CM0.2(1 h) 样品的Ce离子含量为0.7%。为了进一步分析Ce离子的存在状态,对Ce元素进行了精细谱分析,如图7(b)所示,Ce3d在870~930 eV范围内有3组峰。结果表明样品中有两种氧化态的Ce离子,分别是Ce3+和Ce4+,在916 eV对应于Ce3+,在902 eV和886 eV对应于Ce4+[20-21],Ce4+是由Ce3+在氧化性介质中部分氧化生成的。
2.3 样品的BET表征
图8是MnO2空心球样品的N2吸附-脱附等温线以及对应的孔径分布。可以看出所有样品的N2吸附-脱附等温线上都有一个吸附滞后环,这是由于N2在这个区域发生毛细凝聚,产生了滞后效应即吸附曲线和脱附曲线不重合,说明获得的空心球是介孔材料[19]。从孔径分布中可以看出,MnO2的孔径主要分布在1~10 nm范围内,大于10 nm的孔很少,说明得到的MnO2属于中孔材料。
图8(a)~(c) 是添加不同量Ce离子反应1 h得到的MnO2的N2吸附-脱附等温线和孔径分布曲线。图8(a)是未添加Ce离子的MnO2,表现出较低的比表面积(81.4 m2·g-1),随着Ce离子量的增加,CM0.2(1 h)和CM0.4(1 h)的比表面积分别增加到315.2 m2·g-1和175.3 m2·g-1,而且中孔特征明显。这说明Ce离子对MnO2结晶结构有很大的影响,Ce离子的浓度是形成中空结构的一个重要参数。图8(b)、(d)、(e)是不同反应时间得到的MnO2的N2吸附-脱附等温线和孔径分布曲线,随着反应时间从10 min增加到1 h,比表面积由184.1 m2·g-1增加到315.2 m2·g-1。由此可以看出,铈锰摩尔比为0.2、反应时间为1 h时,得到的MnO2比表面积最大。表1列出了不同反应条件下的MnO2空心球的N2吸附-脱附参数。
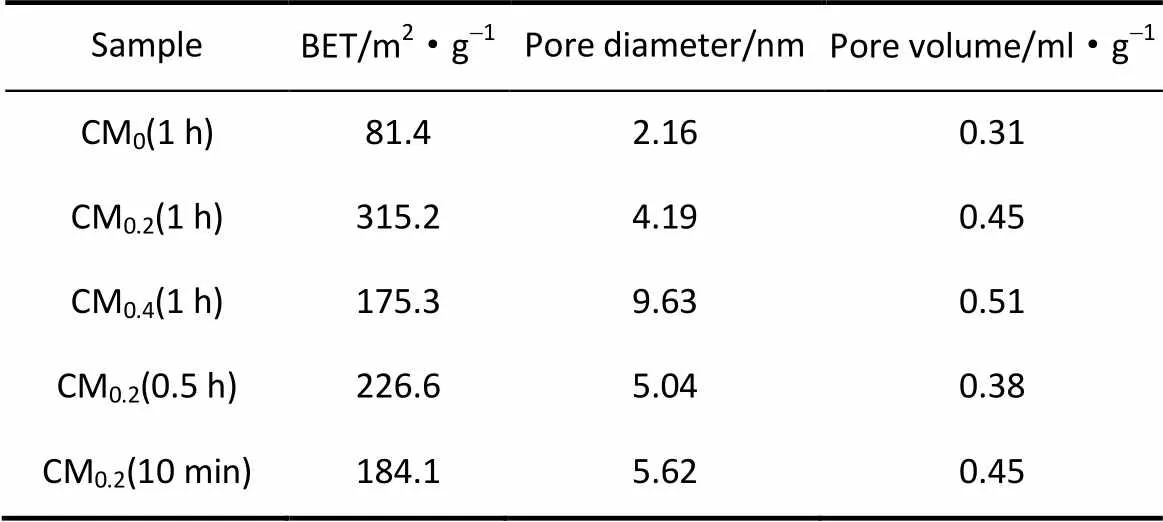
表1 不同条件下MnO2空心球的比表面积、孔径和孔容量Table 1 BET, pore diameter and pore volume of MnO2 nanosphere samples obtained at different condition
基于上述的实验结果,对MnO2纳米空心球的形成机理进行了分析。当不添加Ce离子时,反应体系生成的MnO2是均相成核过程,纳米颗粒通过粒子表面自由能聚集在一起,作为晶核生长成较大的MnO2颗粒。加入Ce离子后,纳米颗粒的形成过程发生了变化。KMnO4和MnSO4·H2O形成的MnO2小颗粒并不稳定,逐渐聚集成大的颗粒来降低表面能形成稳定的结构,Ce离子的存在增加了反应体系中离子的强度,这使得小的MnO2颗粒能快速聚集并形成大的固体球[13]。随着反应的进行,这些纳米棒从球表面生长出来,形成了由外层纳米棒组成的稳定的球结构。新形成的纳米棒松散且比内部纳米结构大,球内部的表面能大于外表面的表面能[22],所以纳米球内部伴随着奥斯特瓦尔德熟化过程,内部纳米结构逐渐融化,并且为外部成核过程提供了原材料[16-17,23]。随着反应的进行,内腔结构逐渐增大,其比表面积也会逐渐增加,最终形成了中空结构。
2.4 电极电化学性能研究
图9(a)是反应1 h得到的MnO2电极在电流密度为0.1 A·g-1时的充放电曲线。从图中可以看出,添加Ce离子后MnO2电极的比电容增加了,而且随Ce离子量的增加MnO2电极的比电容先增加后减少。通过公式可以计算出CM0、CM0.1、CM0.4和CM1的比电容分别为50、77.4、140.5和112.1 F·g-1;CM0.2比电容达到最大,为178.6 F·g-1。图9(b)是CM0.2在不同反应时间内得到的MnO2电极在电流密度为0.1 A·g-1时的充放电曲线。从图中可以看出,反应1 h时电极材料的比电容最大。反应10 min、0.5 h和2 h时材料的比电容分别为155.1、149.3和51.9 F·g-1。
为了进一步表征MnO2电极在不同扫描速率下的伏安特性,测试了CM0.2(1 h)电极在1、5、10和20 mV·s-1时循环伏安曲线,如图9(c)所示。电极在1 mV·s-1和5 mV·s-1的低扫速下工作时,电流相应几乎都为恒定值,阴极过程和阳极过程基本上对称,这表明电极以较恒定的速率进行充放电电极的阴极过程和阳极过程的电容容量相当,伏安曲线呈现明显的矩形形状,表现出理想的电容行为,这一特征表明其具有很好的可逆性。在较大扫速下工作时,电流增大较快,这表明MnO2电极上有反应速度较慢的电化学反应发生,但是也显示出矩形特征,没有明显的氧化还原峰,说明其也具有较好的可逆性。
图9(d)是CM0.2(1 h)和CM0(1 h)电极在电流密度1 A·g-1时的比电容与循环次数曲线。从图中可以看出,CM0.2(1 h)电极的初始比电容为122.6 F·g-1;在前200个循环时比电容又增加到125.7 F·g-1;在第300个循环时比电容相对起始比电容并没有衰减;经过300个循环之后比电容开始减小;1000个循环后比电容为110.9 F·g-1,保持了90.5%,具有较好的循环稳定性。CM0(1 h)电极的初始比电容为37.6 F·g-1;经100次循环后比电容减小到36.9 F·g-1;1000个循环后比电容为32.5 F·g-1,保持了86.4%。
3 结 论
采用水热法、通过加入Ce离子制备了不同孔容的中空MnO2电极材料,得到如下结论:加Ce离子后有利于形成球形和中空结构,其中空结构比表面积高达315.2 m2·g-1;恒电流充放电测试发现,当铈锰摩尔比为0.2、反应时间为1 h时,在0.1 A·g-1电流密度下,材料的比电容达到了178.6 F·g-1,比未加Ce离子的比电容提高了2.6倍;CM0.2(1 h)电极在1 A·g-1时的比电容为122.6 F·g-1,经1000次充放电循环后比电容仍保留了90.5%,表明材料具有较好的大电流放电能力和循环稳定性。
符 号 说 明

CMx(t)——不同反应时间和不同铈锰摩尔比制备的MnO2样品,其中x为铈与锰的摩尔比(0,0.1,0.2,0.4,1),t为水热反应时间(10 mim,0.5 h,1 h,2 h)。
References
[1] Lee S W, Kim J, Chen S, Hammond P T, Shao-Horn Y. Carbon nanotube/manganese oxide ultrathin film electrodes for electrochemical capacitors [J]., 2010, 4(7): 3889-3896
[2] Wang G, Zhang L, Zhang J. A review of electrode materials for electrochemical supercapacitors [J]., 2012, 41(2): 797-828
[3] Hu C C, Chen W C, Chang K H. How to achieve maximum utilization of hydrous ruthenium oxide for supercapacitors [J]., 2004, 151(2): A281-A290
[4] Zhu T, Chen J S, Lou X W. Shape-controlled synthesis of porous Co3O4nanostructures for application in supercapacitors [J]., 2010, 20(33): 7015-7020
[5] Qu Q, Zhang P, Wang B, Chen Y, Tian S, Wu Y, Holze R. Electrochemical performance of MnO2nanorods in neutral aqueous electrolytes as a cathode for asymmetric supercapacitors [J]., 2009, 113(31): 14020-14027
[6] Zhang X, Shi W, Zhu J, Zhao W, Ma J, Mhaisalkar S, Maria T L, Yang Y, Zhang H, Hng H H, Yan Q. Synthesis of porous NiO nanocrystals with controllable surface area and their application as supercapacitor electrodes [J]., 2010, 3(9): 643-652
[7] Duan X, Yang J, Gao H, Ma J, Jiao L, Zheng W. Controllable hydrothermal synthesis of manganese dioxide nanostructures: shape evolution, growth mechanism and electrochemical properties [J].., 2012, 14(12): 4196
[8] Bae K H, Lee K, Kim C, Park T G. Surface functionalized hollow manganese oxide nanoparticles for cancer targeted siRNA delivery and magnetic resonance imaging [J]., 2011, 32(1): 176-184
[9] Tang X, Liu Z, Zhang C, Yang Z, Wang Z. Synthesis and capacitive property of hierarchical hollow manganese oxide nanospheres with large specific surface area [J]., 2009, 193(2): 939-943
[10] Wang N, Gao Y, Gong J, Ma X, Zhang X, Guo Y, Qu L. Synthesis of manganese oxide hollow urchins with a reactive template of carbon spheres [J]., 2008, 2008(24): 3827-3832
[11] Caruso R A, Susha A, Caruso F. Multilayered titania, silica, and laponite nanoparticle coatings on polystyrene colloidal templates and resulting inorganic hollow spheres [J]., 2001, 13(2): 400-409
[12] Schmidt H T, Ostafin A E. Liposome directed growth of calcium phosphate nanoshells [J]., 2002, 14(7): 532-535
[13] He X, Yang M, Ni P, Li Y, Liu Z H. Rapid synthesis of hollow structured MnO2microspheres and their capacitance [J].:, 2010, 363(1): 64-70
[14] Huang X, Lv D, Yue H, Attia A, Yang Y. Controllable synthesis ofa-andb-MnO2: cationic effect on hydrothermal crystallization [J]., 2008, 19(22): 225606
[15] Xu M, Kong L, Zhou W, Li H. Hydrothermal synthesis and pseudocapacitance properties ofa-MnO2hollow spheres and hollow urchins [J]., 2007, 111(51): 19141- 19147
[16] Yu P, Zhang X, Wang D, Wang L, Ma Y. Shape-controlled synthesis of 3D hierarchical MnO2nanostructures for electrochemical supercapacitors [J]., 2008, 9(1): 528-533
[17] Song X, Gao L. Facile synthesis and hierarchical assembly of hollow nickel oxide architectures bearing enhanced photocatalytic properties [J]., 2008, 112(39): 15299-15305
[18] Feng H, Cheng R, Zhao X, Duan X, Li J. A low-temperature method to produce highly reduced graphene oxide [J]., 2013, 4: 1539
[19] Li B, Rong G, Xie Y, Huang L, Feng C. Low-temperature synthesis ofa-MnO2hollow urchins and their application in rechargeable Li+batteries [J]., 2006, 45(16): 6404-6410
[20] Kim M, Hinklin T R, Laine R M, Core-shell nanostructured nanopowders along (CeO)(Al2O3)1-xtie-line by liquid-feed flame spray pyrolysis (LF-FSP)[J].., 2008, 20(16): 5154-5162
[21] Shen Y, Huang Y, Zheng S,Guo X,Chen Z, Peng L. Nanocrystals of CeVO4doped by metallic heteroions [J]., 2011, 50(13): 6189-6194
[22] Li D, Wu X, Chen Y. Synthesis of hierarchical hollow MnO2microspheres and potential application in abatement of VOCs [J]., 2013, 117(21): 11040-11046
[23] Zhang M, Shao C, Guo Z, Zhang Z, Mu J, Zhang P, Cao T, Liu Y. Highly efficient decomposition of organic dye by aqueous-solid phase transfer andphotocatalysis using hierarchical copper phthalocyanine hollow spheres [J]., 2011, 3(7): 2573-2578
Synthesis and electrochemical properties of MnO2hollow nanospheres
WANG Xiaoli, ZHENG Yuying, LIU Xianbin
School of Materials Science and EngineeringFuzhou UniversityFuzhouFujianChina
Electrode material of MnO2hollow nanosphere was synthesizeda simple hydrothermal process in the presence of Ce ion. Ce ion played a crucial role in controlling the morphology and crystalline structure of MnO2. The hollow nanosphere consisted of nanorods, and Brunauer-Emmet-Teller (BET) specific surface area of the hollow nanosphere was 315.2 m2·g-1. Electrochemical behavior of MnO2electrode material was measured by cyclic voltammetry and galvanostatic charge-discharge. Better electrochemical properties of MnO2electrode could be obtained when mole ratio of Ce to Mn was 0.2, and specific capacitance of as-prepared MnO2electrode was 178.6 F·g-1, 2.6 times higher than MnO2electrode without Ce ions. Moreover, MnO2electrode exhibited remarkable cyclability, and specific capacitance retained 90.5% even after 1000 cycles. Ce ion was favorable for forming a hollow structure, and improved specific capacitance of MnO2electrode.
manganese dioxide; nanostructure; hydrothermal; electrochemistry; supercapacitor
2014-09-24.
ZHENG Yuying, yyzheng@fzu.edu.cn
10.11949/j.issn.0438-1157.20141446
TQ 15
A
0438—1157(2015)03—1201—07
福建省高校产学合作科技重大项目(2012H6008);福州市科技计划项目(2013-G-92)。
2014-09-24收到初稿,2014-10-30收到修改稿。
联系人:郑玉婴。第一作者:汪晓莉(1990—),女,硕士研究生。
supported by the Industry-University Cooperation Key Project of Science and Technology of Fujian Province(2012H6008) and the Fuzhou Science and Technology Plan Project(2013-G-92)

