应用活体生物发光成像技术研究纳米雄黄的抗小鼠恶性黑色素瘤肝肺转移作用
席晓霞, 席栋宾, 范临兰, 魏虎来
(1. 兰州大学基础医学院医学实验中心, 甘肃省新药临床前研究重点实验室,兰州 730000; 2. 酒泉市人民医院, 酒泉 735000)
·论著·
应用活体生物发光成像技术研究纳米雄黄的抗小鼠恶性黑色素瘤肝肺转移作用
席晓霞1, 席栋宾2, 范临兰1, 魏虎来1
(1. 兰州大学基础医学院医学实验中心, 甘肃省新药临床前研究重点实验室,兰州730000; 2. 酒泉市人民医院, 酒泉735000)
目的采用小动物活体成像技术研究纳米雄黄对小鼠B16-luc恶性黑色素瘤的抗转移作用和机制。方法以萤火虫荧光素酶(luciferase, luc)基因标志小鼠B16黑色素瘤细胞(B16-luc), BALB/c小鼠的尾静脉注射B16-luc细胞制作小鼠黑色素瘤肺转移瘤模型, 每日4 mg/kg和8 mg/kg纳米雄黄灌胃24 d, 阳性对照组隔日腹腔注射顺铂(DDP) 2 mg/kg,阴性对照组灌胃生理盐水0.02 L/kg。小动物活体成像系统动态观察肿瘤细胞转移情况。治疗末期处死动物,取出肺和肝,置活体成像系统下直接成像,并肉眼观察肺和肝表面转移瘤结节形成; 另对肺、肝肿瘤组织作HE染色,光镜下观察组织形态变化。 结果活体成像显示纳米雄黄可显著抑制小鼠黑色素瘤细胞在肺和肝中的转移(P<0.05),解剖肉眼可见肝、肺表面转移灶显著减少或消失,病理学检查显示纳米雄黄治疗组小鼠的肺脏内转移瘤结节小、数量较少,大多数瘤结节中央呈坏死液化改变,肝脏内未见到转移瘤结节。结论纳米雄黄可有效抑制小鼠恶性黑色素瘤B16-luc细胞的肺转移和肝转移能力。
纳米雄黄; 小鼠恶性黑色素瘤; 活体成像技术
雄黄的主要抗肿瘤成分为As2S2或As4S4(arsenic disulfide or arsenic tetrasulfide),自身难溶于水,临床上常采用口服给药易增加胃肠道刺激。雄黄被制备成纳米级颗粒,可降低其粒径, 增加溶解度、减少用药量和提高生物利用度。近年来,纳米雄黄在白血病和部分实体肿瘤的临床治疗中取得了良好的疗效[1-3]。已有研究也证实纳米级雄黄微粒具有明显的抗肝癌和抗肺癌作用[4], 并可通过调控细胞凋亡过程的关键基因而诱导耐药性白血病细胞凋亡, 特别是对肿瘤干细胞(cancer stem cells, CSC)和白血病干细胞(leukemia stem cells, LSC)也具有良好的增殖抑制作用[5]。鉴于小鼠B16恶性黑色素瘤的增殖、生长、转移特性等与人恶性黑色素瘤类似, 故成为研究恶性黑色素瘤的理想动物模型, 并已在药物筛选、恶性黑色素瘤发生、发展、转移的研究中得到了广泛应用[6,7]。目前恶性黑色素瘤有效药物及治疗方案的选择仍然是面临的棘手问题。本研究通过BALB/c雄性小鼠的尾静脉注射接种荧光素酶标记的B16黑色素瘤细胞(B16-luc), 以制备小鼠肺转移瘤模型,利用小动物活体光学成像技术比较雄黄纳米微粒的抗恶性黑色素瘤转移效应。
1 材料与方法
1.1材料
1.1.1实验动物SPF级雄性BALB/c小鼠24只,8周龄,体质量20~22 g,由兰州大学医学实验中心提供 [SCXK(甘)2013-0002]。实验操作及动物饲养在兰州大学医学实验中心SPF级动物实验设施进行[SYXK(甘)2013-0003]。动物实验伦理和福利严格遵循科技部《关于善待实验动物的指导性意见》的原则。
1.1.2仪器、试剂小动物活体成像系统(IVIS LuminaⅡ型,美国PerkinElmer公司); 动物气体麻醉机(美国Matrx公司); 异氟烷(中国河北九派有限公司); D-luc(美国冷泉港生物科技股份有限公司); 顺铂(DDP, 齐鲁制药有限公司); 新生小牛血清(中国兰州荣晔生物科技有限公司); RPMI 1640(BRL美国Gibco公司产品)。
雄黄原药粉由西安中药集团公司提供,采用高能球磨法制备成纳米级微粒[5]。用KCl饱和的硝酸溶液滴加至完全溶解,用NaOH调节pH至7.2左右,PBS定溶,配制成2 mg/mL的储存液,过滤除菌,4℃保存备用。
1.1.3小鼠恶性黑色素瘤细胞生物素酶标记B16小鼠恶性黑色素瘤细胞(B16-luc),为B16细胞经慢病毒载体转染萤火虫荧光素酶基因(firefly luciferase gene,luc)而成,可稳定表达生物素酶。由美国冷泉港生物科技股份有限公司提供。
1.2方法
1.2.1B16-luc细胞培养B16-luc细胞接种于含体积分数12%的新生牛血清、2 mmol/L-谷氨酰胺、100 U/mL青霉素和100 μg/mL链霉素的RPMI 1640完全培养基中, 置37℃、5% CO2培养箱饱和湿度条件(MCO-15AC型CO2培养箱,日本三洋公司)下培养。体积分数0.25%胰蛋白酶消化、传代、取对数生长期的细胞用于实验。
1.2.2小鼠恶性黑色素瘤肝肺转移模型制备及活体生物发光观察将对数生长期的 B16-luc 细胞消化制备成单细胞悬液,无菌生理盐水调整细胞浓度为2×106/mL。将24只BALB/c小鼠随机分为4组, 每组6只, 每只BALB/c小鼠尾静脉接种 0.1 mL单细胞悬液(2×105个细胞),以制作小鼠黑色素瘤肺转移瘤模型。次日(1 d)起实验组每日分别按4 mg/kg(低剂量组)和8 mg/kg(高剂量组)灌胃纳米雄黄进行治疗, 阳性对照组隔日腹腔注射DDP 2 mg/kg,阴性对照组灌胃生理盐水0.02 L/kg。并于0 d、6 d、12 d、18 d、24 d分别用小动物活体成像系统动态观测小鼠体内肿瘤生长及转移情况。观测前每只小鼠腹腔注射0.15 g/L的D-luc,10 min之后将小鼠置入动物气体麻醉机的麻醉盒,用异氟烷进行诱导麻醉,然后置活体成像系统曝光成像,用Lumina ⅡLiving Image 4.0 软件采集并分析光子数值。分别按下式计算抑制转移率(IR): IR(%)=(1-实验组肿瘤光子数/阴性对照组肿瘤光子数)×100%。
1.2.3小鼠黑色素瘤肝、肺转移瘤的形态学和病理观察纳米雄黄末次治疗后,腹腔注射D-luc,脱臼处死小鼠,快速取出肺脏和肝脏,并肉眼观察肺脏和肝脏表面转移瘤结节形成。用PBS清洗脏器表面血迹,放入预先清洗消毒的平皿,分别置于活体成像系统下曝光成像,并采集照片。然后将新鲜肺脏、肝脏肿瘤组织用福尔马林溶液固定,石蜡包埋,切片,HE染色,光镜下观察肺脏和肝脏组织形态的变化。
1.2.4统计学处理
应用 SPSS13.0 软件对数据进行统计分析,实验数据以均数±标准差(± s)表示,组间分析比较采用t检验,P<0.05 表示差异有统计学意义。
2 结果
2.1纳米雄黄抑制小鼠B16-luc黑色素瘤的肺转移和肝转移
在小鼠肺部成功形成B16-luc黑色素瘤肺转移瘤,随着时间的延长肺部生物发光强度逐渐增强(P<0.05), 并在肝脏部位亦出现转移细胞发光(图1)。高剂量和低剂量纳米雄黄及DDP治疗后均明显抑制小鼠B16-luc细胞在肺部的转移生长,且抑制作用随着用药时间的延长而增大,发光强度较阴性对照组小鼠减低; 在各时间点,纳米雄黄高剂量组的转移抑制率均比低剂量组和阳性对照高(P<0.05, 图1, 图2)。与肺转移瘤结节计数法所获转移抑制率相一致(图3B)。纳米雄黄治疗后肝部均未现生物发光。
2.2小鼠B16-luc黑色素瘤肝肺转移瘤的病理改变
对照组肺脏体积较大、其表面有大量的黑色肿瘤转移灶; 肝脏体积也较大、表面亦有少量转移瘤结节。经纳米雄黄治疗后, 小鼠的肺脏体积缩小、表面转移灶显著减少, 以高剂量治疗者最为显著; 肝脏表面肉眼不可见明显的转移肿瘤结节。肺脏和肝脏转移瘤的肉眼观察结果与活体生物发光成像和器官生物发光成像结果相吻合(图1, 图3)。肺脏和肝脏病理切片观察可见, 对照小鼠肺脏内有多量的转移瘤结节灶, 肝脏内有少量的转移瘤结节灶, 结节灶细胞内可见大量黑色素沉着。部分肿瘤转移灶中央区可见少量坏死改变; 纳米级雄黄治疗小鼠的肺脏内转移肿瘤结节灶数量明显减少, 体积较小, 大多数瘤结节中央区域呈液化坏死样改变。肝脏内未见到转移瘤结节灶(图4)。上述结果证实纳米雄黄可有效抑制黑色素瘤细胞经血道导致的肺脏、肝脏转移。

图2 纳米雄黄治疗对小鼠B16-luc细胞肝肺转移的抑制作用Figure 2 The anti-metastasis effects of realgar nanoparticle treatment on the hepatic and pulmonary metastasis of B16-luc cells in mice
3 讨论
B16-luc小鼠黑色素瘤由美国Jackson 实验室建立,可在体外传代培养和制备实验动物移植性肿瘤,并已筛选出了多种转移性强的B16-luc细胞亚系,广泛地用于肿瘤发生、转移过程和影响肿瘤发展、转移等研究领域, 具有较大的应用价值[7,8]。
恶性黑色素瘤是常见的皮肤肿瘤,恶性程度极高,占皮肤肿瘤死亡病例的大部分。恶性肿瘤最显著的生物学特征是侵袭和转移,而肿瘤的侵袭和转移主要依赖新生血管的形成。因此,能否阻止侵袭和转移是恶性肿瘤治疗成败的关键因素。本研究采用尾静脉接种B16-luc细胞建立BALB/c小鼠恶性黑色素瘤肝肺转移瘤模型,纳米雄黄治疗可显著抑制小鼠肺和肝中黑色素瘤转移灶的形成,且多数转移结节中心区域出现坏死液化现象,证实纳米雄黄可有效抑制小鼠黑色素瘤的肺和肝转移。李秀荣等[9]研究表明纳米雄黄可通过上调色素上皮细胞衍生因子(PEDF)基因和下调血管内皮细胞生长因子(VEGF)基因的表达抑制人皮肤鳞癌A431新生血管生成。本文作者[10,17]前期研究也证实纳米雄黄显著抑制小鼠乳腺癌和恶性黑色素瘤肿瘤新生血管的形成。据此,作者推测纳米雄黄可能通过抑制肿瘤新生血管生成进而阻断肿瘤细胞的迁移和营养通道而发挥抗转移的作用。有关纳米雄黄抗肿瘤转移的确切细胞分子机制有待进一步深入研究。
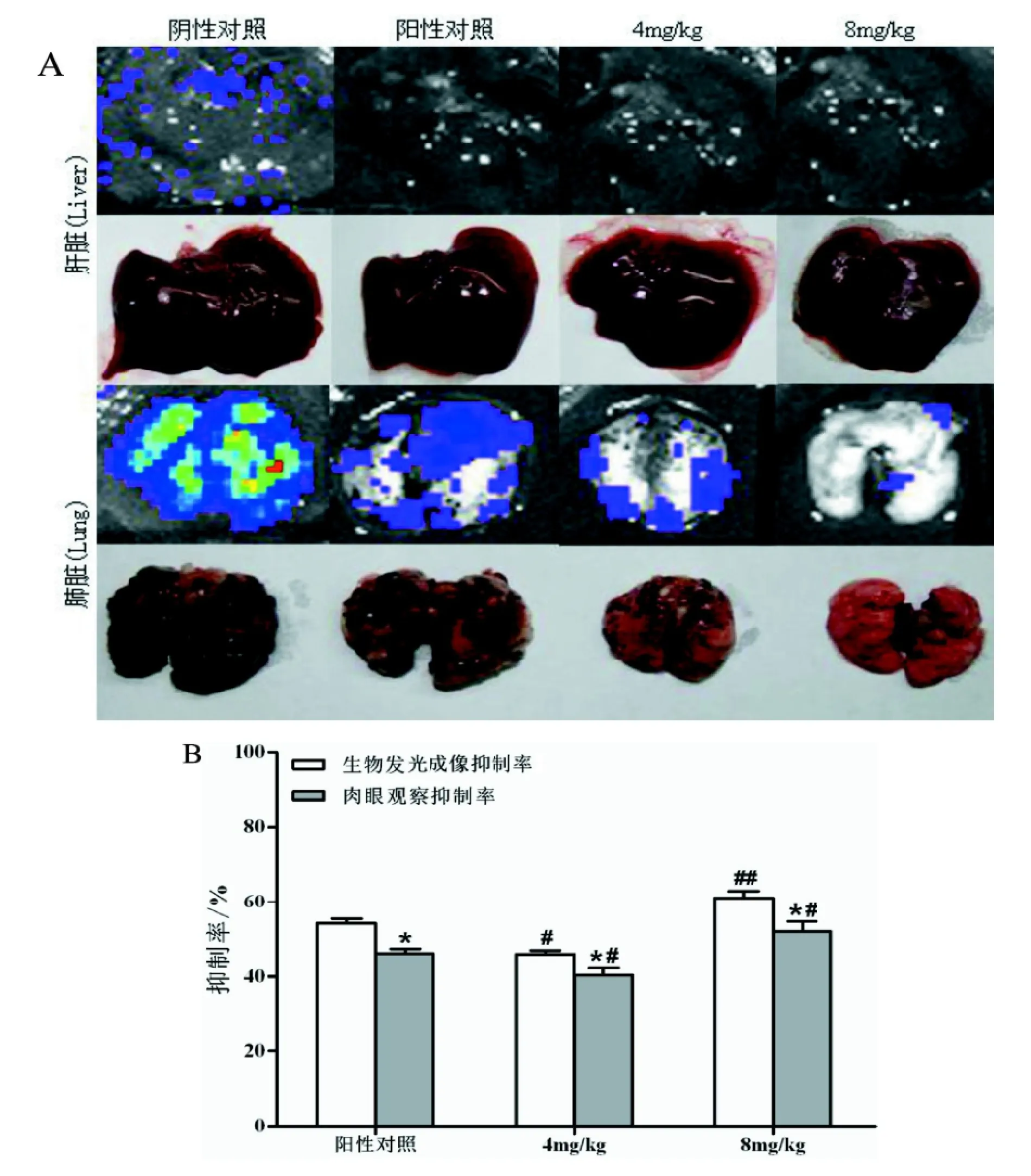
图3 纳米雄黄抗小鼠B16-luc黑色素瘤肝肺转移瘤原位肉眼观察和生物发光成像的比较Figure 3 The in situ comparision of anti-metastasis effects of realgar nanoparticle in liver and lung of B16-luc bearing mice by visual observation and bioluminescence imaging
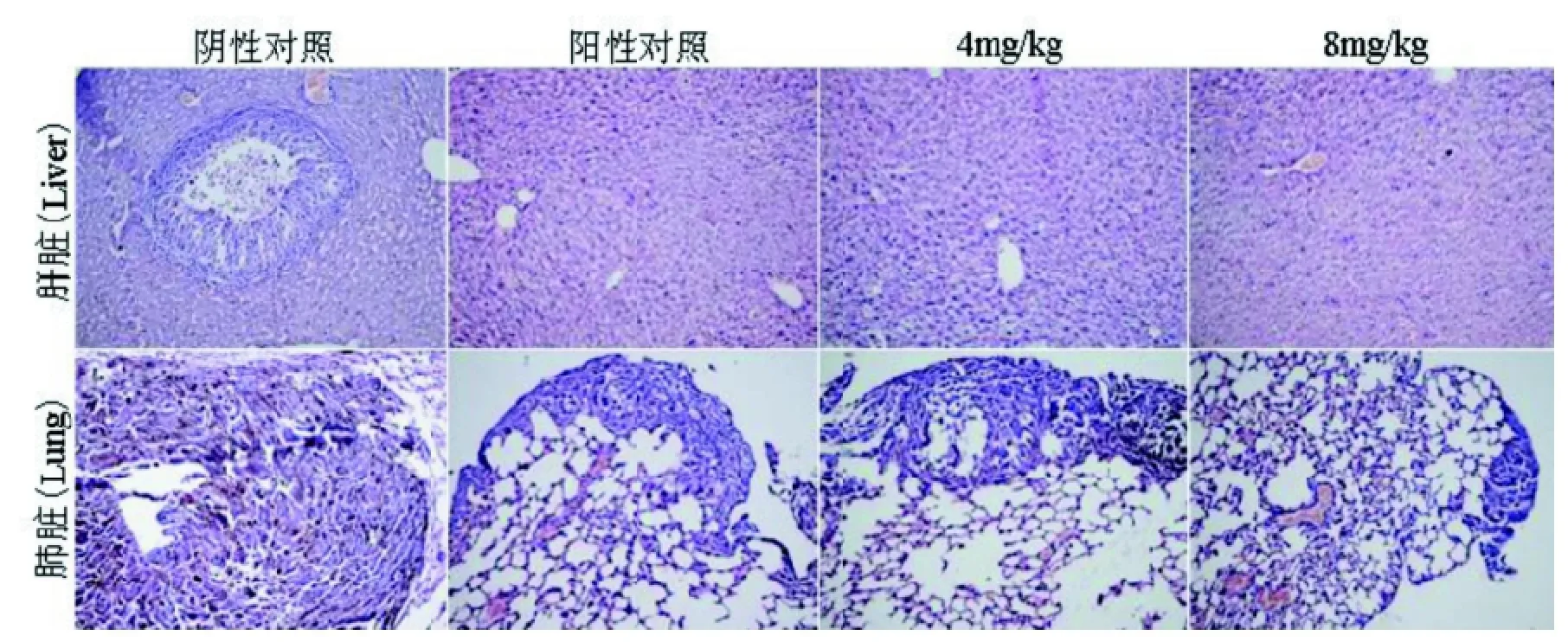
图4 纳米雄黄治疗后小鼠B16-luc黑色素瘤肝肺转移瘤组织的病理变化(HE ×20)Figure 4 Pathological observation on hepatic and pulmonary metstsis tumors in B16-luc melanoma-bearing mice treated with realgar nanoparticles (HE×20)
光学活体成像技术(optical in vivo imaging)是利用荧光(fluorescence)或生物发光(bioluminescence)成像原理直接监测动物活体内细胞的生物学行为或特定分子事件,能够在肉眼尚不能观察到肿瘤的时候即可观察、量化活体内肿瘤的生长和转移情况,具有动态、简便、直观、精确、定量、特异性和灵敏度高等特点。该技术既能避免常规动物实验中大量处死实验动物,又可动态跟踪同一目标随时间的变化趋势,避免因传统实验方法和个体差异对实验结果的干扰。与传统的肿瘤转移瘤结节计数法相比,生物发光法更灵敏,更准确;避免了因肿瘤转移瘤结节融合,肿瘤组织内坏死组织和细胞的干扰而导致的主观因素的影响,能更客观的反应药物对肿瘤的抑制作用。因此,活体成像技术已成为广泛应用于生物医学、动物医学及药物开发研究领域的前沿技术[11-19]。与传统动物实验技术相比,本文采用的小动物光学活体成像技术研究雄黄纳米微粒的抗小鼠黑色素瘤肺肝转移作用具有显著技术优势,能够在活体动物水平方便、经济和动态评价药物的抗转移效应。
[1]徐凌云, 曾繁典, 叶寒青, 等. 纳米雄黄抗肿瘤作用及在荷瘤小鼠组织中的分布[J]. 中国新药杂志, 2006, 15(21): 1845-1849.
[2]刘嵘, 濮德敏, 程艳香, 等. 纳米雄黄混悬液对人宫颈癌细胞RCAS1表达的影响[J]. 中国医院药学杂志, 2008, 28 (6):459-462.
[3]刘嵘, 濮德敏, 赵立波, 等. 纳米雄黄混悬液诱导Siha细胞凋亡及对HPV16E6/E7表达的影响[J]. 中国中药杂志, 2008, 33(1):54-58.
[4]杨玥, 易娟, 陈静, 等. 纳米雄黄对肺癌A549细胞及其肿瘤干细胞的凋亡诱导作用[J]. 中药药理与临床, 2010, 26(6):36-39.
[5]王永胜, 易娟, 陈静, 等. 纳米雄黄对耐药性白血病细胞的凋亡诱导作用[J]. 中药药理与临床, 2010, 26(5):33-36.
[6]曹卉, 金桂花, 金美兰. BALB/c小鼠黑色素瘤B16抑制肿瘤模型的建立[J]. 延边大学医学学报, 2007, 30(3): 160-163.
[7]石莹, 夏俊, 杨同怀, 等. 三氧化二砷抑制小鼠B16 黑色素瘤肺转移作用的研究[J]. 中国中西医结合杂志, 2011, 31 (10):1398-1402.
[8]王园园, 王义善, 杨桂青, 等. 狼毒提取液对小鼠恶性黑色素瘤B16细胞体内转移能力的影响[J]. 中国实验方剂学杂志, 2013,19(1):195-198.
[9]李秀荣, 李慧杰, 林艳艳, 等. 纳米雄黄抑制A431细胞株新生血管的机制研究[J]. 现代肿瘤医学, 2013, 21(2):232-234.
[10] 席晓霞, 范临兰, 田永刚, 等. 纳米雄黄抗小鼠原位乳腺癌作用及其机制[J]. 中国临床药理学与治疗学, 2013, 18(9):981-987.
[11] 李晓颖, 高凯, 董伟, 等. 荧光素酶标的人肝癌细胞裸鼠异种移植瘤模型的生物发光成像和PET-CT成像比较[J]. 中国比较医学杂志, 2011, 21(3):10-13.
[12] Liao CP, Zhong C, Saribekyan G, et a1. Mouse models of prostate adenoeareinoma with the capacity to monitor spontaneous carcinogenesis by bioluminescence or fluorescence [J]. Cancer Res, 2007, 67(15):7525-7533.
[13] Gracla T, Jackson A, Bachelier R, et a1. A convenient clinically relevant model of human breast cancer bone metastasis[J]. Clin Exp Metastasis, 2008, 25(1):33-42.
[14] Lyer M, Sato M, Johnson M, et a1. Applications of molecular imaging in cancer gene therapy[J]. Curt Gene Ther, 2005, 5 (6): 607-608.
[15] 李艳, 张海燕, 王喆, 等. 通过活体动物光学成像系统建立乳腺癌动物模型[J]. 肿瘤, 2009, 29(1):76-80.
[16] 徐元基, 周涛, 杜芝燕, 等. 采用活体成像技术检测肿瘤生长及转移模型的建立[J]. 中国实验动物学报, 2008,16(1):19-22.
[17] 席晓霞, 范临兰, 席栋宾, 等. 纳米雄黄的抗B16小鼠恶性黑色素瘤和抗新生血管形成作用研究.中国兽医科学, 2015, 45(1):97-103.
[18] 范临兰, 李楠, 席晓霞, 等. 小动物活体生物发光成像技术在肿瘤转移研究中的应用[J]. 实验室科学, 2014, 17(2):12-19.
[19] 苏云术, 周鸿敏, 徐利军. B16-F10-luc-G5黑色素瘤细胞生物学特性的研究[J]. 现代肿瘤医学, 2013, 21(10):2169-2173.
Anti-metastatic Actions of Realgar Nanoparticles on Hepatic and Pulmonary Metastasis of Murine Malignant Melanoma with in vivo Bioluminescence Imaging System
XI Xiao-xia1, XI Dong-bin2, FAN Lin-lan1, WEI Hu-lai1
(1. Laboratory Center for Medical Sciences, Key Laboratory of Preclinical Study for New Drugs of Gansu Province, School of Basic Medical Sciences, Lanzhou University, Gansu Lanzhou 730000, China;2. The People's Hospital of Jiuquan City, Jiuquan 735000, China)
ObjectiveTo study the anti-metastasis action and mechanisms of realgar nanoparticles (nano-realgar) on malignant melanoma B16-luc cells in mice by application of in vivo bioluminescence imaging assay. MethodsThe firefly luciferase (luc) gene was transferred into murine B16 melanoma cells with a lentiviral vector(B16-luc cells). B16-luc cells were injected into tail vein of BALB/c mice to establish the pulmonary and hepatic melanoma metastasis model. The model mice were treated with 4 mg/kg and 8 mg/kg nano-realgar once a day by ig for 24 days, and the optical in vivo imaging system was used continuously and dynamically to observe the tumor metastatic situation in mice. At the end of the treating period the mice were sacrificed, and the lungs and liver were removed, and the fluorescence images of the organs were acquired directly with the optical in vivo imaging system, and the metastasis nodules on the lung and liver surface were also observed for perusal. Finally the lung, liver and tumor stained with HE staining, and the morphological changes were observed under microscope. ResultsObservation with optical in vivo imaging system showed that nano-realgar administration could markedly suppressed the pulmonary and hepatic metastasis of B16-luc cells (P<0.05). After nanorealgar treatment, the numbers of pulmonary and hepatic metastasis nodules significantly reduced even disappeared, and pathological examinations revealed that, in the nano-realgar treated mice, the metastasis nodules in lungs seems small and little, the liquefactive necrosis appeared in the central area of most nodules, and no metastasis nodules was found in liver. ConclusionRealgar nanoparticles are able to inhibit significantly the abilities of pulmonary and hepatic metastasis of B16-luc malignant melanoma cells in mice.
Realgar nanoparticle; Murine malignant melanoma; Optical in vivo imaging
R73-3 Q95-33
A
1674-5817(2015)05-0345-06
10.3969/j.issn.1674-5817.2015.05.001
2014-12-02
中央高校基本科研业务费专项资金自由探索面上项目 (LZUjbky-2015-157), 甘肃省自然科学研究基金计划项目(1208RJZA183)和甘肃省中医药科学技术研究课题(GZK-2010-17)
席晓霞(1979-), 女, 博士, 实验师, 研究方向: 医学实验动物学/兽医学。E-mail: xixx@lzu.edu.cn
魏虎来, 男, 教授, 博士生导师, 研究方向: 细胞分子生物学/医学实验动物学。E-mail: weihulai@lzu.edu.cn

