基于纳米RuOx的微型电化学胰岛素传感器
王 君,周 洁,许迎科,王慷慨,王 菊,刘 涌,刘清君,王 平
基于纳米RuO的微型电化学胰岛素传感器
王 君1,周 洁1,许迎科1,王慷慨2,王 菊2,刘 涌2,刘清君1,王 平1
(1. 浙江大学生物传感器国家专业实验室 杭州 310027; 2. 浙江大学硅材料国家重点实验室 杭州 310027)
采用MEMS工艺及C-MEMS工艺制备碳微电极,在其上修饰纳米氧化钌RuO颗粒后,表现出对胰岛素的电催化氧化特性,可实现胰岛素的电化学检测。以此构建的微型电化学胰岛素传感器,具有较好的电化学性能,其检测灵敏度为1 nA/μM,检测限为800 nM。该传感器结合流动注射分析系统,可获得稳定的测量,且所需样品量少,易实现长时、连续检测,具有潜在的临床应用价值,也可构建细胞传感器,在胰腺β细胞分泌胰岛素的机理研究中具有良好的应用前景。
碳微电极; 电化学生物传感器; 胰岛素检测; 纳米金属氧化物
胰岛素是胰腺β细胞分泌的多肽类激素,具有调节碳水化合物和血糖水平的作用。胰岛素也是机体内唯一降低血糖的激素,通过检测血清或血浆中胰岛素含量,对临床上糖尿病相关疾病的诊断非常有价值[1]。在过去十几年,出现了许多胰岛素检测方法,如基于放射性免疫测定[2]、质谱分析[3]、荧光光谱法[4]、表面等离子体共振技术[5]等。但这些方法或操作繁琐、或灵敏度不高、或难以应用到现场即时检测。随着糖尿病患者人数的逐年增加,目前全球范围内患者人数已超过3.47亿[6]人,因此,研究一种高灵敏度、价格便宜、操作简单、自动检测胰岛素的方法具有重要的意义。在众多测试方法中,电化学技术具有简便、快捷的特点,因而得到了极大的关注,包括电化学阻抗谱测试[7]和电流型检测[8]两种方式。前者将胰岛素抗体固定在电极表面,通过电极阻抗的变化测试胰岛素浓度,其检测限可达到1.2 pM,但传感器每测试一次需要采用甘氨酸盐酸盐缓冲液进行洗脱,不利于实现连续测量。
电流型检测方法是给予电极一个特定的电压,使得胰岛素发生氧化,并产生氧化电流,通过电流与浓度的线性关系得出胰岛素浓度信息。文献[9]在玻碳电极上修饰一层含钌敏感膜(Ru-O/CN-Ru复合物)。后来的研究者对测试条件进行了改进,相继在玻碳电极、碳纤维微电极和碳糊电极上成功地实现了胰岛素的电化学检测[10],其敏感膜材料主要为基于钌或铱的化合物。
目前,胰岛素的电化学检测大多在传统柱状电极上进行,而碳纤维微电极虽然尺寸微小,但其制备封装较繁琐,且难以保证不同电极之间的一致性。本文采用光刻胶热解制备碳材料,构建平面微电极阵列,在其上电化学修饰一层RuO纳米颗粒,实现了胰岛素电化学检测的微型传感器的设计,结合流动注射分析系统,可对胰岛素进行稳定、快速、连续的测量。
基于C-MEMS工艺制备的平面碳微电极,可为胰岛素传感器的构建提供一种新的生物相容性及电化学性能优良的电极材料,提高检测电极的一致性,在传感器的微型化、批量生产、降低成本等方面具有重要的意义,也为小型便携式检测器的研究提供可能。此外,碳微电极尺寸可根据不同检测需要进行灵活设计,将C-MEMS工艺与传统MEMS工艺相结合,易于实现多参数、高通量检测的微纳集成芯片的研究,以及细胞水平的生物学研究,如胰岛β细胞分泌胰岛素的单细胞水平的实时检测等。
1 胰岛素电化学检测原理
胰岛素的一级结构中含有两条肽链,由51个氨基酸组成[11],包括A链的21个氨基酸和B链的30个氨基酸,A、B两条肽链直接通过胱/氨酸残基的二硫键相连,如图1所示,包含3个二硫键和4个酪氨酸残基。此外,A链中有两个半胱氨酸残基横跨5个肽键生成二硫键。胰岛素分子的部分功能基团具有电活性,其氧化还原活性位点通常为酪氨酸残基的羟基和二硫键,但研究最多的是3个二硫键。其中A链中的二硫键暴露于三维结构表面,已被证实具有电活性;一个二硫键部分被掩盖,反应较慢;第3个二硫键深埋于分子中,一般不参与反应。而具有电化学活性的酪氨酸残基通常深埋于三维结构内部构成疏水中心,因此较难在电极表面进行电化学氧化。利用A链中二硫键易被氧化的特性可实现胰岛素的电流型检测。如采用镍粉修饰碳电极表面,利用高活性的氧化还原对Ni(OH)2/NiOOH,可实现pM级胰岛素的检测[12],但测试需在碱性溶液中进行。在生理pH条件下进行胰岛素检测常用氧化钌进行碳电极表面修饰,其工作电位在0.6~0.7 V之间,检测限为20~50 nM,通过碳纳米管改性,可将检测限降低1个数量级,达到1 nM。

图1 胰岛素一级结构
2 材料和方法
2.1 传感器加工流程
传感器采用碳微电极阵列的设计,由于碳电极具有较宽的电位窗口和较强的化学惰性,背景电流小,不易受溶液中氧气的干扰等优点,因此选用碳作为工作电极。采用标准微加工工艺MEMS和C-MEMS工艺[13]结合的方法进行制备,如图2a所示,以0.5 mm厚的透明石英玻璃作为基底。首先依次用丙酮、乙醇、去离子水对基片进行超声清洗20 min,然后在120 ℃烘箱内20 min烘干。旋涂光刻胶时,分两级转速,先慢后快,第一级500 转/min旋涂5 s,第二级3 000 转/min旋涂60 s。热解之前需对光刻胶进行前烘,温度90~110 ℃、时长50~100 s,蒸发掉光刻胶内的水分。然后采用光刻工艺制备出微电极雏形。

a. 碳微电极制备流程示意图
b. 热解碳膜实物 c. C-MEMS工艺制备的碳微电极
图2 碳微电极制备工艺C-MEMS示意图
热解过程采用天津市中环实验电炉有限公司生产的1 200 ℃开启式真空气氛管式电炉,真空度高达10−4~10−5Pa。热解过程的升温程序为20~600 ℃之间,升温速率5 ℃/min;600 ℃停留30 min,这时C-H键开始断裂;600~1 000 ℃之间,升温速率5 ℃/min;最后在1 000 ℃条件下保温1 h,而后进入自然退火过程,石英管中始终保持高真空环境。经过慢速高温退火之后,碳微电极形态保持完好,如图2b、图2c所示,制备的碳微电极直径为20 μm。随后采用SU-8光刻胶作为绝缘层,经过一次光刻、显影处理,可实现电极引线部分的覆盖,而圆形工作电极及焊盘部分均暴露,以便后续的封装测试等。
2.2 纳米RuO的修饰
碳微电极本身对胰岛素没有氧化特性,可在其上修饰一层RuO纳米颗粒,作为胰岛素发生电催化氧化的催化剂。RuO的电镀在三电极系统中进行(工作电极为碳电极,辅助电极为铂,参比电极为Ag/AgCl)。所用试剂为三氯化钌(RuCl3),无水,购于阿拉丁。清洗后的碳微电极浸泡于含有0.3 mM RuCl3的10 mM HClO4溶液中,在−0.85~0.65 V之间循环扫描12.5 min,速率10 V/s,在碳微电极表面即可形成一层RuO纳米颗粒。为防止RuCl3发生氧化,电沉积需在RuCl3溶解于HClO4溶液中立即进行处理。RuO制备完成后,将碳微电极浸泡在去离子水中备用。
2.3 胰岛素检测系统
将测试用胰岛素(大于等于27 USP units/mg, sigma, I5523,来源于猪胰腺)溶解在0.01 M HCl溶液中得到1 mg/mL的母液,放置于−20 ℃冰箱中冷冻保存,测试前用含0.15 M NaCl的50 mM PBS溶液进行稀释。

图3 胰岛素测试系统示意图
如图3所示,测试过程采用流动注射分析系统(flow injection analysis, FIA[14]),在分析技术中已被广泛采用。采用FIA比手动注射得到的结果更精确,适合低浓度样品的稳定测量。测试样品与载体溶液通过电磁阀进行自动切换,形成一个测试样品的扩散带进入测试腔体。载体溶液采用含0.15 M NaCl的50 mM PBS溶液(pH为7),流速为1 mL/min,每个样品注射时间为10 s。传感器芯片与待测液在密封的测试腔体进行接触,体积为100 μL。为避免流路系统中引入气泡,溶液在进入电磁阀之前需经过除泡器去除气泡。传感器芯片封装在PCB板上,结合辅助电极铂,以及Ag/AgCl参比电极,通过电化学工作站CHI 660实现电化学测试。
3 实验结果与分析
3.1 碳电极的特性
在实际应用中正胶的使用更普遍,旋涂的胶膜相对负胶较薄,更适合用于制备碳电极,因此在制备碳膜时采用两种正胶进行比较:一种为苏州瑞红电子化学品有限公司的RZJ-304,膜厚范围0.5~3 μm,分辨率1 μm;另一种为美国Hoechst公司的AZ5214,分辨率0.5 μm。光刻胶热解之后的测试结果如表1所示。

表1 光刻胶热解碳膜的电学参数
由于采用的热解条件相同,两种正胶的膜厚和收缩率是接近的,电阻率与文献[15]报道的3~6×10−3Ω×cm在同一数量级但数值更低,说明本研究制备的碳膜导电性更好。
碳膜电极可采用Fe(CN)63/4−为测试对子进行电化学方法表征。以铂丝为对电极,Ag/AgCl为参比,两种碳膜电极的循环伏安测试结果如图4所示,并采用CHI玻碳电极的测试结果作为对照。图中,峰电流由小到大对应的扫描速率为10、20、50、100、200 mV/s,背景电解质0.1 M H2SO4。由于单个碳微电极产生的电信号较小,测试时将64电极进行并联。每条CV曲线的峰电位差值及峰电流如表2所示。
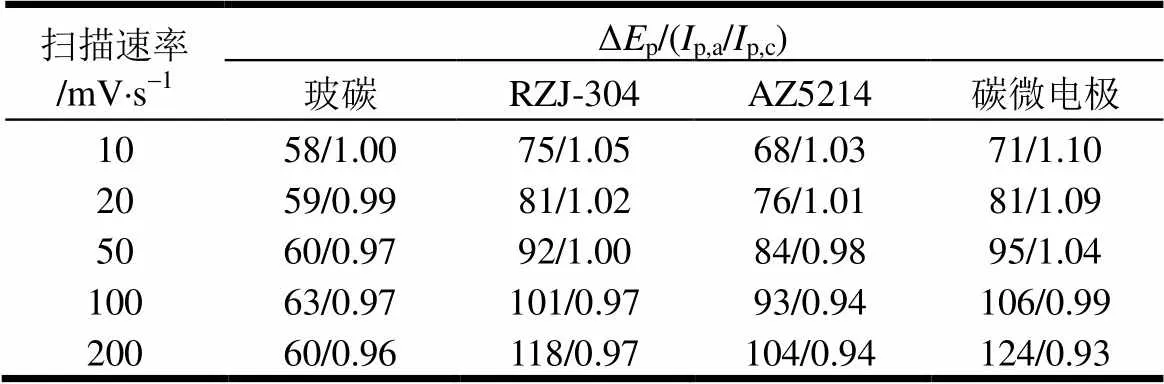
表2 碳电极CV曲线的峰电位及峰电流
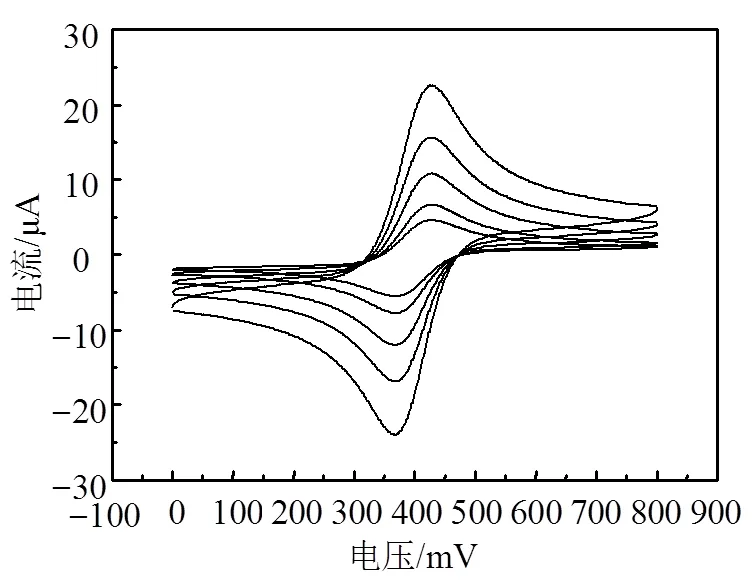
a. CHI玻碳电极
b. RZJ-304光刻胶

c. AZ5214光刻胶
d. 碳微电极
图4 碳电极在1 mM K3Fe(CN)6溶液中不同扫描速率下测试的循环伏安曲线
Fe(CN)63/4−之间为单电子反应,理论上峰电位之差Δp应为59 mV。玻碳电极与理论情况一致,扫描速率对其影响不大。但对于热解的碳电极,峰电位差Δp略高于理论值,并且随着扫描速率的增加而增大,说明碳膜表面可能由于某些基团的物质吸附作用,导致电子传递受阻,使得电极的可逆性降低。此外,氧化与还原峰电流之比p,a/p,c近似等于1,说明发生在电极表面的反应为可逆电对,这符合Fe(CN)63/4−在玻碳电极表面的电化学特性。峰电流若与扫描速率的平方根成正比说明反应受扩散控制。结果显示,玻碳电极、RZJ-304、AZ5214碳膜电极、AZ5214碳微电极测试的峰电流与扫描速率的平方根之间的相关系数分别为0.999 9、0.998 1、0.997 8、0.995 9,说明电极表面的反应受到扩散控制,即Fe(CN)63/4−在电极表面的电化学反应速率非常快。总的来说,光刻胶热解碳电极的电化学性能虽然稍逊色于玻碳电极,但在较低扫描速率下(<20 mV/s)能满足电化学测试要求。AZ5214热解碳的电化学性能稍微优于RZJ-304。
3.2 纳米RuO表征
图5a为碳微电极电沉积RuO纳米之后的扫描电镜照片,可以看出RuO纳米颗粒尺寸均一,在碳电极表面分布均匀,其粒径在几十至一百纳米之间。

a. RuOSEM照片(放大15 000倍)
b. 胰岛素和空白溶液的循环伏安曲线对比

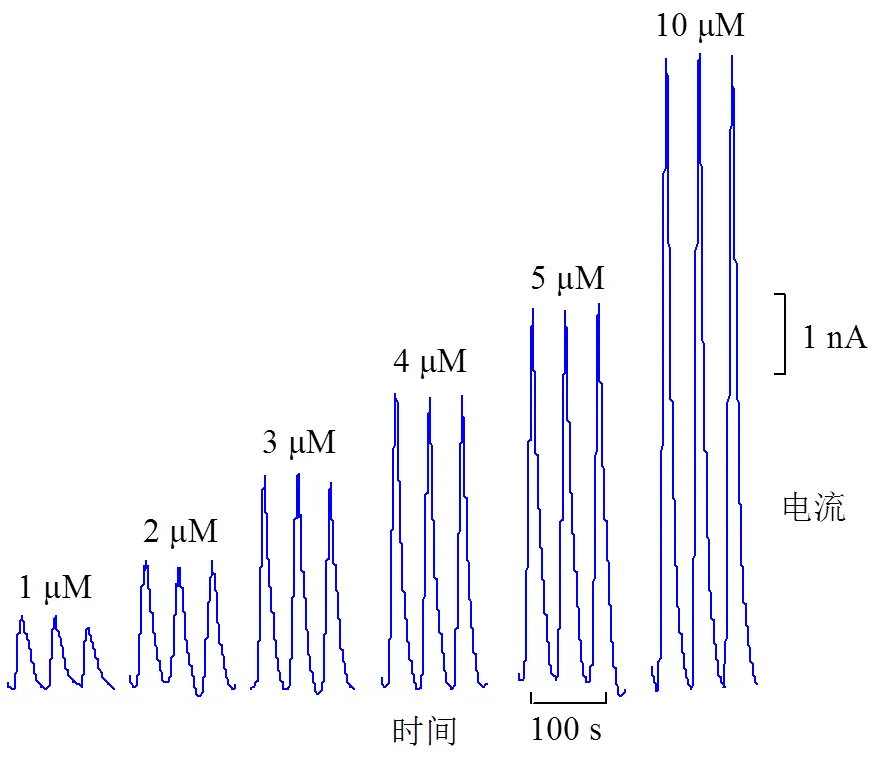
c. 3种不同胰岛素浓度的电流-时间曲线(电压0.7 V)
对其进行循环伏安曲线扫描,测试RuO颗粒的有效性,结果如图5b所示。在+0.7 V处,胰岛素出现氧化峰电流响应,而在载体溶液中,电极没有出现氧化峰电流响应,说明胰岛素在0.7 V电压下发生电催化氧化。采用FIA系统,在固定0.7 V电压下测试3种不同浓度胰岛素的电流-时间曲线,结果显示胰岛素浓度越高,得到的电流峰幅度越大。碳电极表面的RuO颗粒在一定极化电压条件下对胰岛素具有敏感响应特性,并且对不同胰岛素浓度溶液具有较好的区分效果。
3.3 胰岛素检测结果
图6所示为胰岛素和载体溶液交替注射进入测试腔体的氧化电流响应,固定电压为0.7 V,背景溶液为含0.15 M NaCL的50 mM PBSI溶液。测试信号对胰岛素有较大的依赖,峰值随胰岛素浓度成比例增加,二者之间高度线性相关(相关系数为0.997 5),其响应灵敏度约为1 nA/μM,检测下限为800 nM。
a. 不同胰岛素浓度的响应电流
b. 胰岛素响应电流与浓度的线性拟合曲线
图6 胰岛素测试结果
4 结束语
本文利用C-MEMS工艺技术制备碳微电极,构建了微型电化学检测传感器。在高真空环境下高温热解制备的碳微电极具有较好的电化学性能,在修饰RuO纳米颗粒后,可将胰岛素在电极表面进行电催化氧化,从而实现胰岛素的直接电化学检测。其检测灵敏度为1 nA/μM,检测限为800 nM。电化学检测具有响应快、灵敏度高等优点,结合流动注射分析系统,可实现低浓度胰岛素的稳定测量。
本文获得的胰岛素检测灵敏度和检测限在一定程度上逊色于文献报道的结果,说明碳微电极的制备工艺和表面修饰方法有待进一步改进。但本文为微型化胰岛素传感器的研究提供了一个有效的方法,结合微细加工技术,大大增强了传感器设计的灵活性,在少样品检测方面具有较大的发展前景。若将电极尺寸设计成与细胞相当,有望开发出新型的细胞传感器,并将其应用于单个胰腺β细胞分泌胰岛素的机理研究。
[1] SINGH V, KRISHNAN S. An electrochemical mass sensor for diagnosing diabetes in human serum[J]. Analyst, 2014, 139: 724-728.
[2] DEBERG M, HOUSSA P, FRANK B H, et al. Endocrinology and metabolism[J]. Clinical Chemistry, 1998, 44: 1504-1513.
[3] LIU J M, YAN X P. Ultrasensitive, selective and simultaneous detection of cytochrome c and insulin based on immunoassay and aptamer-based bioassay in combination with Au/Ag nanoparticle tagging and ICP-MS detection[J]. Journal of Analytical Atomic Spectrometry, 2011, 26: 1191-1197.
[4] WANG Y, GAO D, ZHANG P, et al. A near infrared fluorescence resonance energy transfer based aptamer biosensor for insulin detection in human plasma[J]. Chem Comm, 2014, 50: 811-813.
[5] FRASCONI M, TORTOLINI C, BOTRE F, et al. Multifunctional Au nanoparticle dendrimer-based surface plasmon resonance biosensor and its application for improved insulin detection[J]. Analytical Chemistry, 2010, 82(17): 7335-7342.
[6] SCULLY T. Diatetes in numbers[J]. Nature, 2012, 485(5): S2-S3.
[7] REGONDA S, TIAN R, GAO J, et al. Silicon multi- nanochannel FETs to improve device uniformity/ stability and femtomolar detection of insulin in serum[J]. Biosensors and Bioelectronics, 2013, 45(1): 245-251.
[8] XU M, LUO X, DAVIS J J. The label free picomolar detection of insulin in blood serum[J]. Biosensors and Bioelectronics, 2013, 39(1): 21-25.
[9] JAMES A C, THOMAS J G. Flow injection amperometric determination of insulin based upon its oxidation at a modified electrode[J]. Analytical Chemistry, 1989, 61(21): 2462-2464.
[10] MASTRANTONIO F, VALGIMIGLI F, GRASSI L, et al. Comparative performance of different nanostructured electrochemical sensors on insulin detection[J]. BioNanoSci, 2013, 3(3): 285-288.
[11] NICOL D, SMITH L. Amino-acid sequence of human insulin[J]. Nature, 1960, 187(8): 483-485.
[12] SALIMI A, ROUSHANI M, SOLTANIAN S, et al. Picomolar detection of insulin at renewable nickel powder-doped carbon composite electrode[J]. Analytical Chemistry, 2007, 79(19): 7431-7438.
[13] WANG C L, JIA G Y, TAHERABADI L H, et al. A novel method for the fabrication of high-aspect ratio C-MEMS structures[J]. Journal of Microelectromechanical Systems, 2005, 14(2): 348-358.
[14] FANJUL-BOLADOA P, LAMAS-ARDISANAB P J, HERNÁNDEZ-SANTOS D, et al. Electrochemical study and flow injection analysis of paracetamol in pharmaceutical formulations based on screen-printed electrodes and carbon nanotubes[J]. Analytica Chimica Acta, 2009, 638(2): 133-138.
[15] DEL CAMPO F J, GODIGNON P, ALDOUS L, et al. Fabrication of PPF electrodes by a rapid thermal process[J]. Journal of the Electrochemical Society, 2011, 158(1): H63-H68.
编 辑 黄 莘
Micro-Fabricated Electrochemical Insulin Sensor Modified with RuONano Particles
WANG Jun1, ZHOU Jie1, XU Ying-ke1, WANG Kang-kai2, WANG Jü2, LIU Yong2, LIU Qing-jun1, and WANG Ping1
(1. Biosensor National Special Lab, Zhejiang University Hangzhou 310027; 2. State Key Lab of Silicon Materials, Zhejiang University Hangzhou 310027)
Insulin detection is significant in clinical study, but the lack of effective detection methods impedes its clinical applications. In this work, the carbon microelectrode fabricated with MEMS (micro-electromechanical system) and C-MEMS (complex micro-electromechanical system) technology is applied for insulin detection. The carbon microelectrodes were fabricated through the pyrolysis of photoresist and showed good electrochemical performance. After electro-deposition of ruthinium oxide nano particles on the electrode surface, the insulin oxidation is electro-catalyzed and its electrochemical detection is realized at 0.7 V. The sensor has a sensitivity of 1 nA/μM for insulin detection, with a detection limit of 800 nM. Electrochemical measurement shows that the sensor has advantages of high sensitivity, fast response and usability for real time on-site detection.
carbon microelectrodes; electrochemical biosensor; insulin detection; nanostructured metal-oxides
TH77
A
10.3969/j.issn.1001-0548.2015.01.027
2013-12-10;
2014-09-22
国家自然科学基金(61320106002);中国博士后基金(2014M561764);浙江省博士后科研项目择优资助(BSH1402030)
王君(1985-),女,博士,主要从事电化学生物传感器方面的研究.

