没食子酸接枝吸附剂配位去除水中微量硼的机理
邵超英,胡晶晶,宫崎義信,竹原公,吉村和久
(1. 东华大学 化学化工与生物工程学院,上海 201620;2. 福冈教育大学 化学系,日本 福冈 8114192;3. 九州大学 理学院,日本 福冈 8128581)
没食子酸接枝吸附剂配位去除水中微量硼的机理
邵超英1,胡晶晶1,宫崎義信2,竹原公3,吉村和久3
(1. 东华大学 化学化工与生物工程学院,上海 201620;2. 福冈教育大学 化学系,日本 福冈 8114192;3. 九州大学 理学院,日本 福冈 8128581)
以11B NMR法研究了溶液中硼酸与没食子酸的配位反应.结果表明,硼酸可与没食子酸反应生成1∶1和1∶2化学计量比的配合物,1∶2配合物主要形成于中性溶液,而碱性环境更利于1∶1配合物的生成.两种配合物的形成常数分别为logβ1=3.79,logβ2=4.10.利用离子交换法制备了没食子酸接枝硼离子选择性吸附剂,并以bath法研究了没食子酸接枝吸附剂对水中硼的去除作用,考察了溶液pH值、硼浓度、吸附时间、温度等因素对硼去除率的影响.吸附试验结果表明,硼酸在没食子酸接枝吸附剂上的吸附行为符合Langmuir、Freundlich方程和准二级速率方程,属自发的单分子层化学吸附过程.没食子酸接枝吸附剂对硼的饱和吸附量为0.39 mmol/g.
没食子酸;吸附剂;硼酸/硼酸盐;去除;机理
微量元素硼是生物尤其是植物必需的营养元素.由于其特殊的化学性质,硼在动植物的生长发育和机体代谢中发挥着重要作用,但硼过量会使生物体产生毒理反应.试验表明,长时间接触过量的硼会导致人体的神经、免疫和生殖等系统受损;作物长期使用含硼量高的灌溉用水,会使叶片变黄,产量降低,甚至死亡[1-3].随着金属冶炼、玻璃、日化和制药等工业的发展,水环境中硼的污染日趋严重,为此,各国均对生活饮用水、农田灌溉用水等相关水中硼的容许浓度限值作了规定.考虑到地表水、废水中硼的污染以及海水的淡化利用,研究水环境中高效的除硼技术非常必要.
天然水中,硼主要以硼酸/硼酸盐[4]的形式存在,在水溶液中存在如下平衡:
(1)

除使用市售的硼特效树脂去除硼的研究外,关于新型高效硼选择性吸附剂制备的报道也很多.文献[16-19]合成了磺酰葡甲胺树脂和缩水甘油功能基团树脂,使树脂利用率和对硼的吸附率均取得满意的结果.基于酸性多羟基化合物与硼酸的配位反应,文献[20]制备了变色酸和钛铁试剂接枝的硼选择性吸附剂,并分别研究了两种吸附剂对硼酸的吸附平衡和吸附性能.文献 [21]制备了水杨酸衍生物接枝的硼特效树脂,研究了其对硼的吸附机理及其影响因素.文献[22]用浸有水杨酸的活性炭研究了初始硼浓度和温度对水中硼吸附效率的影响,并考察了吸附热力学和动力学模型.文献[23]将N-甲基-D-葡糖胺接枝到亲水的二氧化硅-聚烯丙基胺复合物上,制备成一种新型的硼选择性吸附剂.文献[24]合成了聚(N-(4-乙烯基苄基)-N-甲基-D-葡糖胺)新型树脂,并比较了该树脂与商业化硼选择性吸附树脂Diaion CRB02对地热水中硼的吸附能力,结果显示其具有更好的吸附效率.
没食子酸(H4L)是典型的酸性多羟基化合物,关于其与硼酸的相互作用目前尚未见报道.本文采用没食子酸接枝吸附剂对水中的硼进行去除研究,通过11B NMR分析探讨反应机理,研究溶液pH值及硼酸初始浓度等对硼吸附效率的影响,并对吸附过程进行热力学和动力学分析.
1 实验部分
1.1 仪器与试剂
仪器:JEOL JNM-GSX 500型核磁共振光谱仪(日本电子株式会社);UV 1102型紫外可见分光光度计(上海天美科学仪器有限公司);Orion 4Star 型pH测定仪(美国热电公司);EL 204型电子天平(梅特勒-托利多仪器(上海)有限公司);SHZ-B 型水浴恒温振荡器(上海跃进医疗器械厂).
试剂:DOWEX 1-X8型强碱性阴离子交换树脂(以下简称X8树脂),和光纯药工业株式会社;硼酸,上海凌峰化学试剂有限公司;没食子酸,东京化成工业株式会社.所用试剂均为市售分析纯试剂,实验用水为二次去离子水.
1.211B NMR测定
制备了含已知量硼酸(0.0185mol/L)-没食子酸(0.0343mol/L)的混合溶液(离子强度I=0.2 mol/L,NaCl),溶液的pH值用CH3CO2H-CH3CO2Na、NaH2PO4-Na2HPO4、HEPES、NH3-NH4Cl缓冲溶液或少量HCl和NaOH调节.待溶液达到平衡后,用于11B NMR的测定.11B NMR 测试在共振频率为160.0MHz、10mm多核探头、(24±1)℃的条件下进行.标准核磁共振(NMR)参数如下:翻转角度约为90°(36 μs),脉冲重复时间为1s,谱宽为31kHz.化学位移以0.1mol /L的硼酸溶液作为外部参比.重叠的NMR信号用Lorentzian曲线拟合法进行解析.
1.3 硼选择性吸附剂的制备
1.3.1 树脂的再生
实验选择X8树脂(交联度为8%、总交换容量为1.2 meq/mL)作为接枝树脂.取一定量的树脂,加入0.1mol/L的NaCl溶液,在恒温水浴振荡器上振荡24h.振荡完毕用硝酸纤维素滤膜过滤,水洗至滤液经AgNO3检测无Cl-流出.滤纸压干,保存.
1.3.2 没食子酸接枝吸附剂制备条件实验
称取0.2 g经再生处理的树脂于聚乙烯瓶中,分别加入20mL pH值为4~10、浓度为0.001mol/L 的没食子酸溶液,溶液的离子强度用NaCl调节至0.01~0.50mol/L,恒温(25℃)振荡3 h.然后用硝酸纤维素滤膜过滤,滤液中的没食子酸浓度根据其在258nm处的紫外吸收测出.没食子酸在树脂上的分配比kd依式(2)计算.
kd=(Cg0-Cge)V/(CemD)
(2)
式中:Cg0和Cge分别为水相中没食子酸的初始和平衡浓度,mol/L;V为溶液体积,mL;Ce为水相中硼酸的平衡浓度,mol/L;mD为树脂质量,g.
1.3.3 没食子酸接枝吸附剂的制备
按照1.3.2节的没食子酸接枝吸附剂制备条件,称取没食子酸3.0g,溶解于200mL去离子水中,用0.5mol/L KH2PO4-NaOH调节pH值为6.2 (I=0.1mol/L),加入树脂12 g,恒温(25℃)振荡24h.达到平衡后,经硝酸纤维素滤膜过滤,滤纸压干,称量得没食子酸接枝吸附剂14.3 g,即吸附剂中没食子酸的担载量为0.81mmol/g.
1.4 没食子酸接枝吸附剂对硼的吸附条件实验
称取0.5g没食子酸接枝吸附剂于聚乙烯瓶中,分别加入20mL pH值为4~10、浓度为0.025mol/L 的硼酸溶液(I=0.1mol/L,NaCl),恒温(25℃) 振荡48h,达平衡后,过滤.取适量滤液稀释后,用甲亚胺-H分光光度法测定平衡溶液的硼浓度.按式(3)计算没食子酸接枝吸附剂对硼的吸附量.
qe=(C0-Ce)Vx/m
(3)
式中:qe为硼在没食子酸接枝吸附剂上的平衡吸附量,mmol/g;C0为水相中硼酸的初始浓度,mol/L;m为没食子酸接枝吸附剂质量,g;Vx为吸附溶液体积,mL.
在pH值为6.5的溶液中,分别改变硼浓度(0.005~0.030mol/L)、吸附时间(10min~48h)、反应温度(298~313 K),测定没食子酸接枝吸附剂对硼的吸附量.
2 结果与讨论
2.1 硼酸与没食子酸的配位化学反应

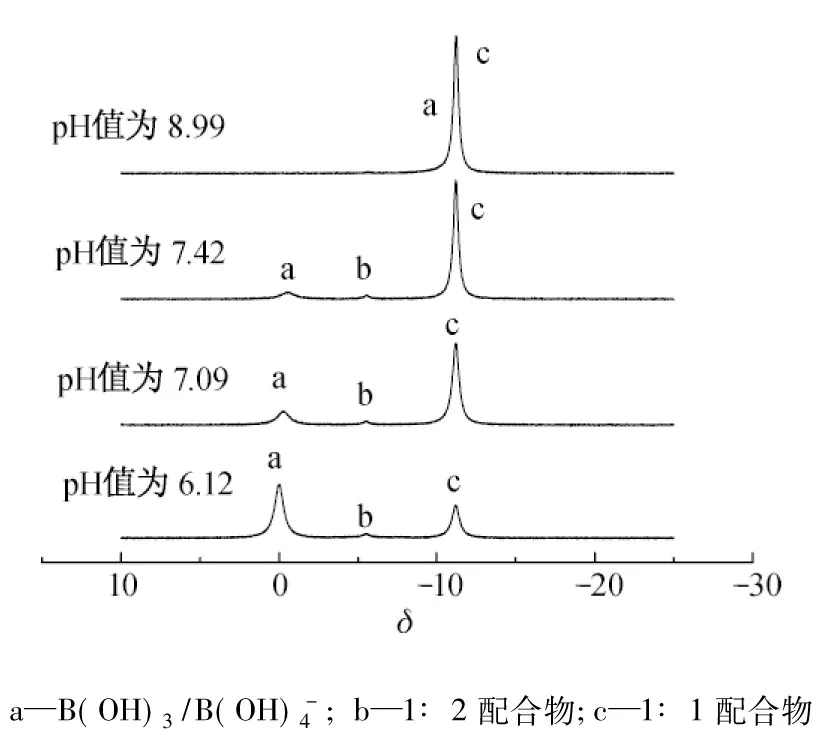
图1 不同pH值条件下硼酸-没食子酸混合溶液的11B NMR图谱Fig.1 11B NMR spectra for the mixture of boric acid and gallic acid solution at different pH values
硼酸-没食子酸混合溶液中存在式(1)和(4)~(8)平衡.
(4)
(5)
(6)
(7)
(8)

根据硼酸的Ka,β1和β2,进一步计算了一定浓度硼酸-没食子酸混合溶液中各形态硼浓度随溶液pH值的变化曲线,如图2所示.由图2可知,1∶1配合物的浓度随溶液pH值的上升逐渐升高,在pH值为9左右达最大值;而1∶2配合物在整个pH值范围内浓度均很低.这与图1的11B NMR测定结果基本一致.由此可知,1∶1配合物主要存在于碱性溶液中,而中性环境更适合1∶2配合物的形成.以上结果为后续没食子酸接枝硼选择性吸附剂去除硼实验条件的优化提供了有效信息.
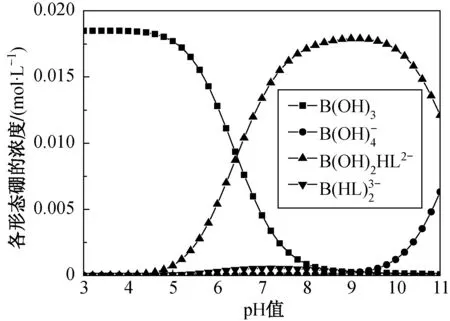
图2 不同pH值条件下硼酸没食子酸混合溶液中各形态硼的浓度Fig.2 pH value dependent equilibrium concentrations of boron species for the mixture of boric acid and gallic acid solution
2.2 硼选择性吸附剂制备条件的优化
在离子强度I一定的条件下,考察了溶液pH值对没食子酸在X8树脂上担载量的影响,结果如图3所示.由图3可知,当pH值≤6.5时,树脂上没食子酸的分配比kd很小,且几乎不随pH值变化;pH值>6.5,kd明显上升,在pH值为8.5处达到最大;此后,呈下降趋势.这可能是由于在溶液中性条件下,没食子酸除羧基完全解离外,酚羟基也随pH值的升高开始解离,而使其在树脂上的接枝率大幅提高.

图3 溶液pH值对X8树脂上没食子酸担载量的影响Fig.3 Effect of solution pH value on the amount of gallic acid adsorbed on X8resin
此外,在溶液pH值一定的条件下,考察了离子强度I对没食子酸在X8树脂上担载量的影响.试验表明,在pH值不变的条件下,logkd随logI的增大而减小,且二者呈良好的线性关系,说明高离子强度环境不利于没食子酸接枝吸附剂的制备.因此,试验选择了在pH值为6.2、I=0.1mol/L的条件下制备没食子酸接枝硼选择性吸附剂.
2.3 没食子酸接枝吸附剂上硼的吸附行为研究
2.3.1 pH值对硼去除率的影响
不同pH条件下没食子酸接枝吸附剂对硼吸附量的测试结果如图4所示.由图4可知,在pH 值为4~10,没食子酸接枝吸附剂上硼的吸附量先升后降,在pH值为6.5处呈现峰值,这与图2显示的1∶1配合物的理论分布不符.没食子酸的酚羟基在碱性条件下不稳定[28],经测试发现,没食子酸溶液在pH值为 8.5时降解趋势显著.这可能是碱性环境中该吸附剂除硼效果不佳的原因.
为了比较,测试了相同条件下硼在X8树脂上的吸附量(图4).可见,尽管X8树脂对硼酸(硼酸根离子)有一定的吸附能力,但对于饱和吸附没食子酸的接枝树脂而言,对硼吸附量的贡献主要源于没食子酸的作用.因此,重点讨论了没食子酸接枝吸附剂上硼的吸附行为.

图4 溶液pH值对没食子酸接枝吸附剂和X8树脂上硼吸附量的影响Fig.4 Effect of pH value on boron adsorption capacities on the adsorbent grafted gallic acid and X8resin
2.3.2 吸附等温实验
溶液中硼酸初始浓度对没食子酸接枝吸附剂上硼吸附量的影响实验结果如图5所示.图5表明,吸附剂上硼的吸附量随硼酸初始浓度的增大而上升,在C0≥0.025mol/L后趋于平衡.
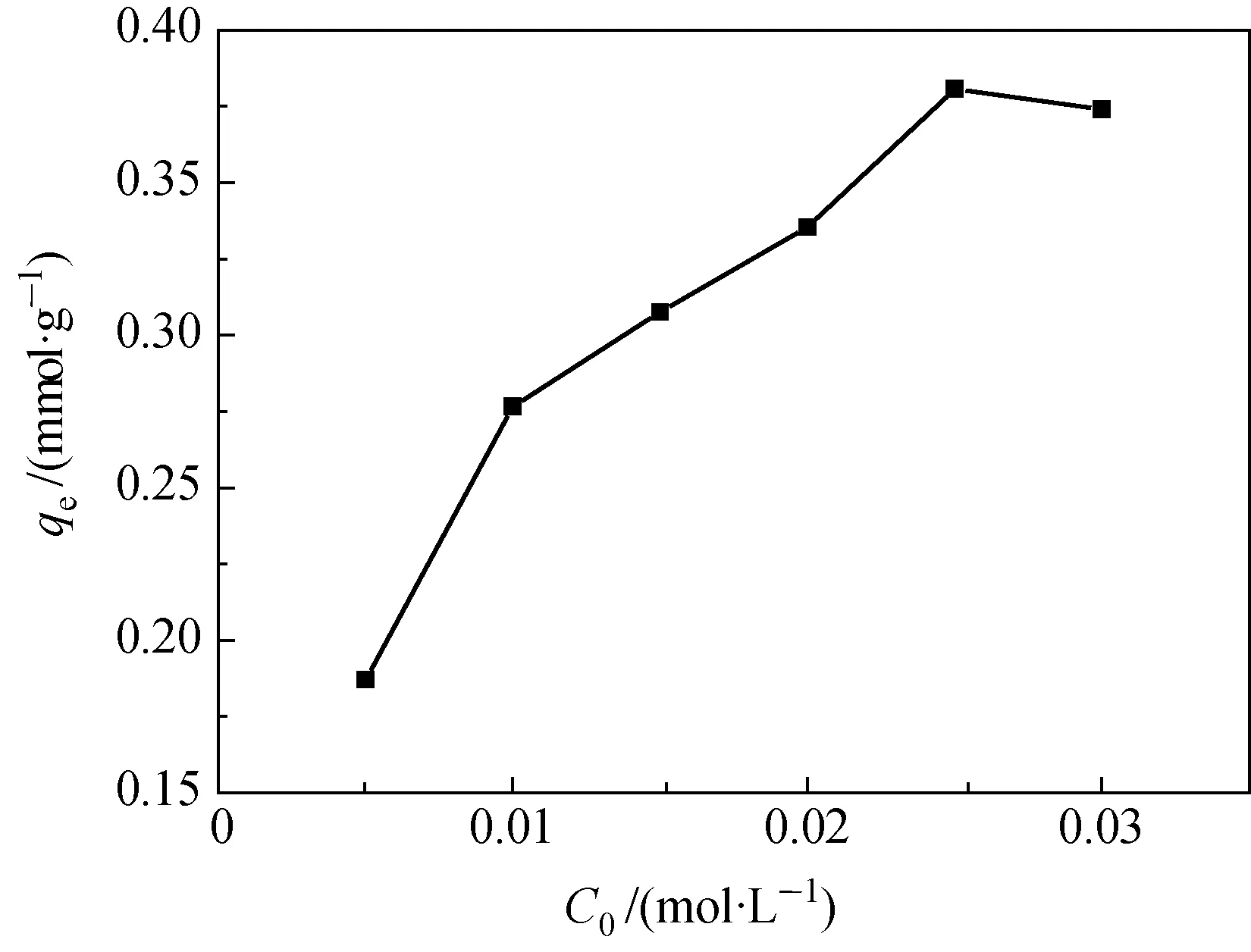
图5 硼酸初始浓度对没食子酸接枝吸附剂上硼吸附量的影响Fig.5 Effect of concentration of boric acid on boron adsorption capacity on the adsorbent grafted gallic acid
这里分别用Langmuir吸附等温式(式(9))和Freundlich吸附等温式(式(10))对图5的试验结果拟合,结果见图6.
Ce/qe=Ce/qmax+1/(KLqmax)
(9)
lnqe=lnCe/n+lnKF
(10)
式中:qmax为饱和吸附量;KL为与温度及吸附热有关的吸附系数[29];KF为Freundlich吸附系数;n为Freundlich常数.
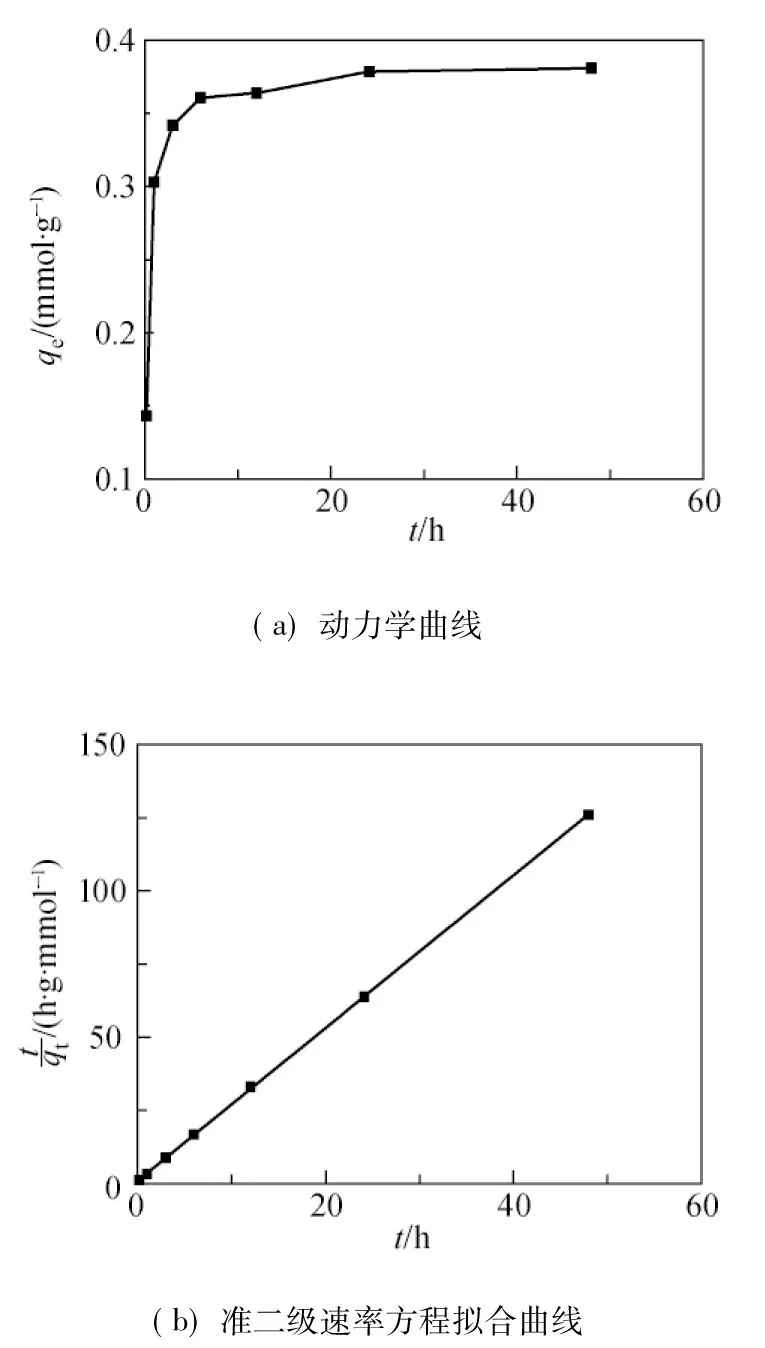
图6 硼酸在没食子酸接枝吸附剂上的吸附等温线Fig.6 The adsorption isothems of boric acid on the adsorbent grafted gallic acid
由Langmuir吸附等温线(图6(a))可见,Ce/qe对Ce作图呈直线(R2=0.989),根据其斜率和截距得qmax和KL分别为0.39 mmol/g和860.1L/mol.所得饱和吸附量qmax与实验测得的最大吸附量0.38mmol/g (图4和5)非常接近,说明硼酸在没食子酸接枝吸附剂上以单分子层化学吸附.
图6(b)显示了lnqe与lnCe的良好线性关系(R2=0.983),由此得出1/n=0.169,表明该吸附属易吸附过程(0.1< 1/n<0.5属易吸附[29]).
根据图5所得的硼最佳初始浓度(0.025mol/L) 和制备树脂中接枝没食子酸的浓度(约0.020mol/L),可估算出pH值为6.5的条件下约生成1∶1配合物0.009 mol/L,即吸附剂上的硼吸附量约为0.36 mmol/g,这与实测的硼最大吸附量基本一致(0.38mmol/g).由此可以得出结论:硼酸主要以1∶1配合物的形式结合在没食子酸接枝吸附剂上,而来自1∶2配合物或通过离子交换作用直接被X8树脂吸附的硼酸根的贡献[30]均较小.
2.3.3 吸附热力学研究
根据式(11)[31],温度对没食子酸接枝吸附剂上硼酸的吸附量产生影响.
lnKd=ΔS0/R-ΔH0/RT
(11)
式中:Kd为硼酸在没食子酸接枝吸附剂上的分配比;ΔS0为标准熵变;ΔH0为标准焓变;R(8.314J/(mol·K))为气体常数;T为温度.
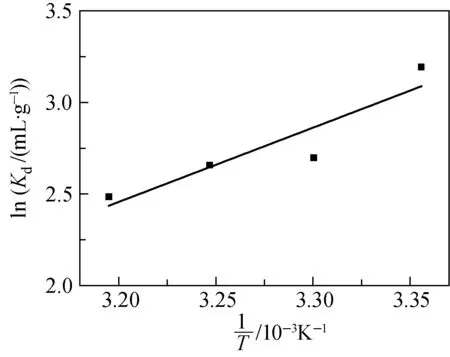
图7 温度对没食子酸接枝吸附剂上硼吸附量的影响Fig.7 Effect of the temperature on boron adsorption capacity on adsorbent grafted gallic acid
以lnKd对1/T作图(图7所示)由直线的斜率和截距可得ΔH0和ΔS0.将所得的ΔH0和ΔS0及根据ΔG0=ΔH0-TΔS0计算的标准吉布斯自由能ΔG0列于表2.由表2可见,在所研究的温度范围内,ΔG0均为负值,说明硼酸在没食子酸接枝吸附剂上的吸附配位反应是热力学可行的自发过程.同时,随着温度的升高,ΔG0的绝对值逐渐变小,表明升温不利于硼酸的去除.但温度对硼酸吸附量的影响很小,这种自发过程基本与温度无关.

表2 硼酸在没食子酸接枝吸附剂上的吸附热力学参数Table 2 Thermodynamic parameters for adsorption of boric acid on the adsorbent grafted gallic acid
2.3.4 吸附动力学研究
硼酸在没食子酸接枝吸附剂上的动力学曲线和准二级速率方程拟合曲线如图8所示.

图8 硼酸在没食子酸接枝吸附剂上的动力学曲线和准二级速率方程拟合曲线Fig.8 Adsorption kinetics of boric acid on the adsorbent grafted gallic acid and the pseudo-second-order adsorption kinetics
由图8(a)可知,在硼的去除初期,吸附剂上硼的吸附量迅速升高,前6 h的硼累计吸附量已达饱和吸附量的90%以上;之后吸附速率逐渐减小,至24h左右趋于平衡.
将图8(a)的试验结果用准二级速率方程(式(12))[32]拟合发现,硼酸在该吸附剂上的吸附过程符合准二级速率方程(图8(b),R2=0.999).
t/qt=1/(k2qe2)+t/qe
(12)
式中:qt为时间t时硼在没食子酸接枝吸附剂上的吸附量;qe为平衡吸附量;k2为准二级速率常数.
根据t/qt-t直线的截距,得k2=7.153 g/(mmol·h).从而进一步证明吸附速率被化学吸附机理所控制,该化学吸附涉及吸附剂与吸附质间的电子共用或电子转移[29].
3 结 论
(1)11B NMR研究表明,硼酸和没食子酸反应可生成1∶1和1∶2化学计量比的配合物,其形成常数分别为logβ1=3.79,logβ2=4.10.
(2) 通过离子交换法制备了没食子酸担载量为0.81mmol/g的没食子酸接枝硼离子选择性吸附剂.优化的硼去除最佳条件:pH 值为6.5,硼初始浓度为0.025mol/L,24h达平衡.该树脂上硼的饱和吸附量为0.39 mmol/g.
(3) 在没食子酸接枝吸附剂上硼的吸附符合Langmuir、Freundlich方程和准二级速率方程.硼酸在没食子酸接枝吸附剂上的吸附属自发的单分子层化学吸附,其主要以1∶1配合物的形式结合在没食子酸接枝树脂上.在去除硼过程中络合机理起了重要作用.
(4) 由于酸性环境中不能生成配合物,因此吸附剂上硼的解吸可通过简单的酸(H2SO4或HCl)淋洗,树脂经NaOH溶液活化再生后其吸附能力无明显下降.
[1] MURRAY F J.A human health risk assessment of boron (boric acid and borax) in drinking water[J].Regul Toxicol Pharm,1995,22(3):221-230.
[2] 宋萍.硼素营养和硼肥施用技术[J].新疆农业科技,2006,28(2):43.
[3] NADAV N.Boron removal from seawater reverse osmosis permeate utilizing selective ion exchange resin[J].Desalination,1999,124(1/2/3):131-135.
[4] YOSHIMURA K,MIYAZAKI Y,OTA F,et al.Complexation of boric acid with the N-methyl-D-glucamine group in solution and in crosslinked polymer[J].J Chem Soc,Faraday Trans,1998,94(5):683-689.
[5] WOLSKA J,BRYJAK M.Methods for boron removal from aqueous solutions:A review[J].Desalination,2013,310:18-24.
[6] SIMONNOT M O,CASTEL C,NICOLAÏ M,et al.Boron removal from drinking water with a boron selective resin:Is the treatment really selective [J].Wat Res,2000,34(1):109-116.
[7] XU Y,JIANG J Q.Technologies for boron removal[J].Ind Eng Chem Res,2008,47(1):16-24.
[8] 刘晓宁,刘涛,魏荣卿,等.硼吸附树脂的研究进展[J].现代化工,2011,31(6):19-22.
[9] SHAO C Y,MATSUOKA S,MIYAZAKI Y,et al.Equilibrium and kinetic studies on the complexation of boric acid with chromotropic acid[J].J Chem Soc,Dalton Trans,2000(18):3136-3142.
[10] YOSHIMURA K,MIYAZAKI Y,SAWADA S,et al.11B NMR studies on complexation of borate with linear and crosslinked polysaccharides[J].J Chem Soc,Faraday Trans,1996,92(4):651-656.
[11] KABAY N,YILMAZ I,YAMAC S,et al.Removal and recovery of boron from geothermal wastewater by selective ion-exchange resins II:Field tests[J].Desalination,2004,167:427-438.
[12] JACOB C.Seawater desalination:Boron removal by ion exchange technology[J].Desalination,2007,205(1/2/3):47-52.
[14] HILAL N,KIM G J,SOMERFIELD C.Boron removal from saline water:A comprehensive review[J].Desalination,2011,273(1):23-25.
[15] ARIAS M F C,BRU L V I,RICO D P,et al.Comparison of ion exchange resins used in reduction of boron in desalinated water for human consumption[J].Desalination,2011,278(1/2/3):244-249.
[17] GAZI M,SENKAL B F,BICAK N.Modification of crosslinked poly(styrene) based polymers for boron-specific extraction[J].Macromol Symp,2004,217(1):215-221.
[18] BICAK N,GAZI M,ENKAL B F.Polymer supported amino bis-(cis-propan 2,3 diol) functions for removal of trace boron from water[J].React Funct Polym,2005,65(1):143-148.
[19] GAZI M,GALLI G,BICAK N.The rapid boron uptake by multi-hydroxyl functional hairy polymers[J].Sep Purif Technol,2008,62:484-488.
[20] SUZUK T M,TANAKA D A P,YOKOYAMA T,et al.Complexation and removal of trace boron from aqueous solution by an anion exchange resin loaded with chromotropic acid (disodium 2,7-dihydroxynaphthalene-4,5-disulfonate)[J].J Chem Soc,Dalton Trans,1999(10):1639-1644.
[21] MIYAZAKA Y,MATSUO H,FUJIMORI T,et al.Interaction of boric acid with salicyl derivatives as an anchor group of boron-selective adsorbents[J].Polyhedron,2008,27:2785-2790.
[22] CAN B Z,CEYLAN Z,KOCAKERIM M M.Adsorption of boron from aqueous solutions by activated carbon impregnated with salicylic acid:Equilibrium,kinetic and thermodynamic studies[J].Desalination and Water Treatment,2012,40(1/2/3):69-76.
[23] LI X,LIU R,WU S,et al.Efficient removal of boron acid by N-methyl-D-glucamine functionalized silica-polyallylamine composites and its adsorption mechanism[J].J Colloid Interface Sci,2011,361(1):232-237.
[24] SANTANDER P,RIVAS B L,URBANO B F,et al.Removal of boron from geothermal water by a novel boron selective resin[J].Desalination,2013,310:102-108.
[25] DAWBER J G,GREEN S I E.An11B nuclear magnetic resonance study of the reaction of the tetrahydroxyborate ion with polyhydroxy compounds[J].J Chem Soc,Faraday Trans 1,1986,82:3407-3413.
[26] DAWBER J G,GREEN S I E,DAWBER J C,et al.A polarimetric and11B and13C nuclear magnetic resonance study of the reaction of the tetrahydroxyborate ion with polyols and carbohydrates[J].J Chem Soc,Faraday Trans,1988,84(1):41-56.
[27] SHAO C Y,MATSUOKA S,MIYAZAKI Y,et al.Studies on the complexation of boric acid with polyhydroxyl compounds[J].Anal Sci,2001,17(S):1475-1478.
[28] 吴雪钗,于波涛,侯艾林,等.没食子酸稳定性研究[J].西南国防医药,2006,16(5):484-485.
[29] 张宏,张敬华.生物吸附的热力学平衡模型和动力学模型综述[J].中天学刊,2009,24(5):19-22.
[30] KÖSE T E,ÖZTÜRK N.Boron removal from aqueous solutions by ion-exchange resin:Column sorption-elution studies[J].J Hazard Mater,2008,152(2):744-749.
[31] YURDAKOÇ M,SEKI Y,KARAHAN S,et al.Kinetic and thermodynamic studies of boron removal by Siral 5,Siral 40,and Siral 80[J].J Colloid Interface Sci,2005,286(2):440-446.
[32] HO Y S,MCKAY G.Sorption of dye from aqueous solution by peat [J].Chem Eng J,1998,70(2):115-124.
Mechanism for the Removal of Trace Amount of Boron from Water by Adsorbent Grafted Gallic Acid
SHAOChao-ying1,HUJing-jing1,MIYAZAKIYoshinobu2,TAKEHARAKo3,YOSHIMURAKazuhisa3
(1.College of Chemistry,Chemical Engineering and Biotechnology,Donghua University,Shanghai 201620,China;2.Department of Chemistry,Fukuoka University of Education,Fukuoka 8114192,Japan;3.Faculty of Sciences,Kyushu University,Fukuoka 8128581,Japan)
The complexation of boric acid with gallic acid in aqueous solution was examined thoroughly by11B NMR measurements.It was confirmed that boric acid reacted with gallic acid to form two complexes with 1∶1and 1∶2 stoichiometries.The 1∶2 complex was mainly distributed in neutral solution,while the 1∶1complex prevailed in a higher pH range.The formation constants for these complexes were evaluated to be logβ1=3.79 and logβ2=4.10.A novel boron selective adsorbent grafted gallic acid was prepared by using ion exchange method.Bath experiments were conducted to evaluate the performance of the adsorbent for removal of boron from water,and the effects of pH value and concentration of the boron solution,contact time and bath temperature on the removal efficiency were investigated.The results for the adsorption studies showed that the adsorption process could be well described with Langmuir equation,Freundlich equation and pseudo-second-order rate equation.Boron adsorption on the adsorbent presorbed gallic acid was a spontaneous chemical process with monomolecular layer,and its adsorption capacity was estimated to be about 0.39 mmol/g.
gallic acid; adsorbent; boric acid/borate; removal; mechanism
1671-0444(2015)01-0065-07
2013-11-05
邵超英(1959—),女,辽宁本溪人,副教授,博士,研究方向为环境修复及环境分析.E-mail:shaocy@dhu.edu.cn
O642
A

