大腹园蛛主壶腹腺丝基因的筛选及序列分析
张 雪,陈格飞,孟 清
(东华大学 生物科学与技术研究所,上海 201620)
大腹园蛛主壶腹腺丝基因的筛选及序列分析
张 雪,陈格飞,孟 清
(东华大学 生物科学与技术研究所,上海 201620)
为研究蛛丝蛋白编码基因和蛋白的组成结构模式、进化,并为蛛丝仿生提供更多的基因资源,运用3D/PCR(three -dimensional polymerase chain reaction)技术对大腹园蛛(A.ventricosus)Fosmid基因组文库进行主壶腹腺丝(MaSp1)编码基因的筛选,并对部分序列进行分析.通过筛选实验室前期构建的Fosmid文库获得含有MaSp1基因的阳性克隆Av11-19-5,通过shotgun测序得到MaSp1部分基因序列MaSp1RC.MaSp1RC长786 bp,编码的262个氨基酸(AvMaSp1RC)可划分为保守的 C端非重复区(CT)和重复区(Rep).Rep主要由poly-Ala,Glyx和GlyGlyx等模块组成,Ala和Gly含量占总氨基酸的78%;CT中参与形成离子键的氨基酸及helix 4上的疏水模块高度保守.研究结果为蛛丝蛋白二聚化及仿生学研究提供了更多的基因资源.
大腹园蛛;主壶腹腺丝蛋白;3D/PCR技术;序列分析
蜘蛛丝(spider silk)是一种生物可降解的高分子蛋白纤维,其理化性质及力学性能均优于现有的人造合成材料,因而,其在国防、军事、建筑、医疗和纺织等领域具有广阔的应用前景,成为仿生学研究的重要目标[1-5].圆网蛛可分泌6种丝纤维和一种黏液蛋白,分别扮演不同的生物学角色,如捕捉和黏合猎物、编织卵袋、固定连接等[6].主壶腹腺分泌的主壶腹腺丝(MaSp)构成整个蛛网的主干,以其高强度和高弹性而备受关注.20世纪90年代,国内外学者开始蛛丝蛋白基因的克隆研究,但至今蛛丝基因及蛋白序列的结构模式还没有解析完全[7-8].文献[9]证实Nephilaclavipes和Nephilamadagascariensis鞭毛状丝蛋白(Flagelliform,Flag)编码基因中含有13个大小均匀的内含子,转录子大小约为15.5kb;文献[10]报道了Argiopetrifasciata(A.trifasciata)主壶腹腺丝(major ampullate spidroin,MaSp)蛋白2亚基部分基因序列,与Flag编码基因结构相似,A.trifasciataMaSp2也含有多个大小一致的内含子.文献[11]报道了Latrodectushesperus(L.hesperus)MaSp1/2全长编码基因序列,证实L.hesperusMaSp1/2编码基因均由一个较为罕见的开放阅读框架组成,MaSp1/2基因大小分别约为11和10kb.文献[12]报道了大腹园蛛(Araneusventricosus,A.ventricosus)次壶腹腺丝(minor ampullate spidroin,MiSp)蛋白全长编码基因,该基因与文献[9-11]的基因模式均不相同,含有一个5.6 kb的基因内含子.文献[13]证实L.hesperus葡萄状丝(Aciniform spidroin,AcSp)全长编码基因序列只含有一个19 kb的开放阅读框架.另外,文献[14]通过PCR( polymerase chain reaction)的方法初步确定Argiopeargentata(A.argentata)和L.hesperus管状丝蛋白(Tubuliform spidroin,TuSp)编码基因不含有基因内含子.上述基因结构模式表明蛛丝蛋白编码基因具有进化多样性,但迄今为止,仅有3条全长基因序列:L.hesperusMaSp1/2、A.ventricosusMiSp和L.hesperusAcSp[11-13],还不足以对蛛丝蛋白编码基因及蛋白的结构模式进行系统性分析.另外,蛛丝基因的克隆进展缓慢,严重阻碍了蛛丝仿生的研究,现阶段,蛛丝蛋白的表达主要为蛛丝模块的串联体,仿生的拟蛛丝纤维性能远不及天然蛛丝.
大腹园蛛为蛛形纲蜘蛛目园蛛属节肢动物,网较大且丝性能突出,在我国分布广泛.为进一步研究蛛丝蛋白编码基因和蛋白的组成结构模式,并为仿生学提供更多的基因资源,本文以前期构建的无偏向性、覆盖倍数高的A.ventricosusFosmid 基因组文库为基础[15],利用3D/PCR(three-dimensional polymerase chain reaction)筛选方法对文库进行MaSp1编码基因的筛选,得到含有MaSp1编码基因的阳性克隆,并进行shotgun测序,从而对获取的部分MaSp1序列进行分析和讨论.
1 材料和方法
1.1 材料与试剂
A.ventricosus采集于上海松江周边地区,液氮速冻后-80℃保存;大腹园蛛基因组文库由实验室保存;Taq DNA 聚合酶(Vazyme公司,美国);QIprepTMSpin Miniprep Kit(Qiagen,德国);AxyprepTMDNA Gel Extraction Kit(Axygen,美国);CopyControlTMHTP Fosmid Library Production Kit(Epicentre,美国).
1.2 方法
(1) 引物的设计.根据NCBI(national center for biotechnology information)Genbank收录的有关蜘蛛MaSp的C端氨基酸序列Blast分析,确定MaSp的C端非重复区(CT)保守氨基酸序列,设计引物(如表1所示),并由上海生工生物工程技术服务有限公司(简称上海生工)测序合成.

表1 引物序列Table 1 Primers
(2)A.ventricosus基因组的提取及标签序列的获取.以A.ventricosus胸部肌肉组织为原料,采用改良CTAB (cetyltrimethyl ammonium bromide)法提取高相对分子质量基因组DNA(high molecular weight genome DNA,HMW-gDNA)[16],以引物MaSp-up和MaSp-down对基因组DNA进行扩增,循环条件为95℃预变性5min,94℃变性30s,65℃ 退火30s,72℃延伸1min,循环数为30,终始延伸10min.对目的条带进行切胶回收,送上海生工测序.经过条件优化得到257 bp的DNA片段,测序后进行NCBI BlastN 同源序列比对确定此序列为A.ventricosusMaSp C端非重复区部分序列,并确定该序列为标签序列进行文库筛选.
(3) 文库的筛选.采用3D/PCR法筛选A.ventricosusFosmid基因组文库:①超级混合池(混合池的构建详见文献[15])的菌种接种于5mL含12.5μg/mL氯霉素的LB( Luria-Bertani)培养基中,37℃,180r/min过夜培养,提取混合质粒进行PCR筛选,对目的条带切胶回收测序,以确定其中是否存在一个或多个阳性克隆;②确定超级混合池的混合质粒中存在的阳性克隆后,抽提一级混合池和二级混合池质粒,分别进行PCR筛选;③阳性克隆存在的批次通过超级混合池的筛选来确定,阳性克隆存在的384-well plates的编号由一级混合池可以确定,阳性克隆存在的行列交叉位置根据二级混合池筛选确定,由此确定阳性克隆的具体位置.用引物MaSp-repeat和MaSp-down进一步验证阳性克隆.
(4) Fosmid阳性单克隆高拷贝诱导及末端测序鉴定.在15mL试管中加入4.5mL新鲜LB培养基(含12.5μg/mL氯霉素)、500μL过夜活化菌液和5μL Copycontrol Induction Solution,配成理想的诱导体系,37 ℃,180r/min振荡培养5h,诱导Fosmid阳性单克隆质粒的高拷贝,整个过程需保证通气性良好,抽提重组pCC2FOSTM载体.将提取高拷贝单克隆pCC2FOSTM重组载体,以End-F和End-R为引物,送上海生工对阳性克隆进行Fosmid末端测序.
(5) 序列分析.通过末端测序鉴定插入目的片段的完整性,对包含目的基因的阳性克隆送上海生工进行shotgun测序.利用DNAman、SerialCloner 2-6-1、Clustal Omega、PSIPRED v3.3(http://bioinf.cs.ucl.ac.uk/psipred/)以及MEGA 4.0对当前已获取的部分序列进行分析.
2 结果与分析
2.1 基因组提取、PCR扩增及阳性克隆的筛选鉴定
利用改良CTAB法提取A.ventricosus基因组DNA(如图1(a)所示),经琼脂糖凝胶电泳检测,基因组DNA弥散性小,大片段较为集中.以基因组DNA为模板,MaSp-up和MaSp-down为引物进行MaSp C端蛋白基因PCR扩增,经过优化PCR条件和体系,得到特异性高的PCR产物(如图1(b)所示),位于200~300bp.回收该片段进行测序分析,测序结果经比对证实为A.ventricosusMaSp1C端基因序列.以该片段作为MaSp1编码基因的标签序列对文库进行筛选,如图1(c)所示,在11号超级混合池中筛选得到阳性条带,并通过进一步筛选相应的一级/二级混合池得到阳性克隆Av11-19-5,约为40kb.Av11-19-5经Fosmid末端引物测序分析确定该克隆含有A.ventricosusMaSp1编码基因.
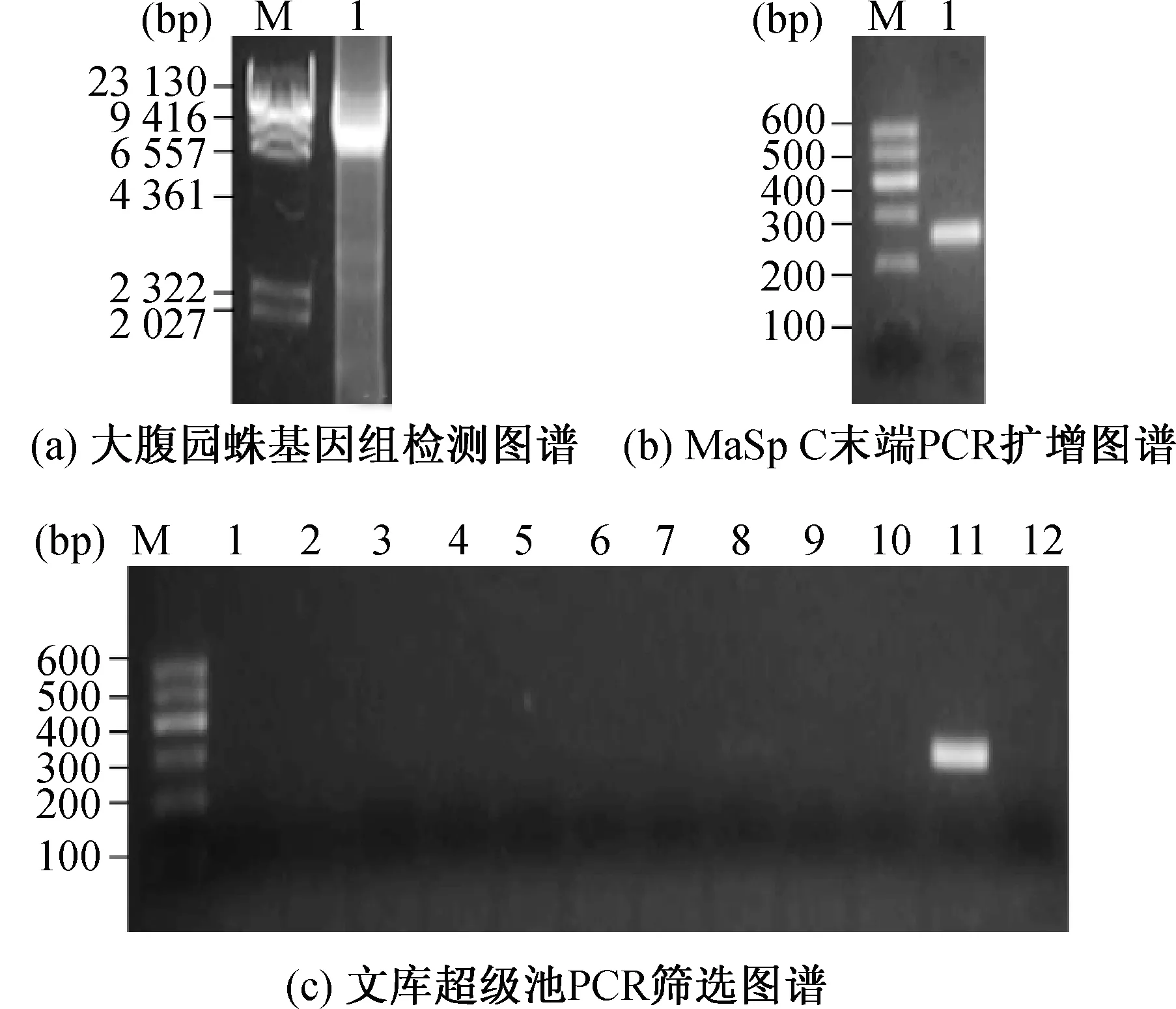
图1 大腹园蛛基因组、PCR以及文库筛选凝胶图谱Fig.1 Agarose gel figures of A.ventricosus genome,PCR and library screening
2.2 AvMaSp1RC氨基酸序列分析
对阳性克隆Av11-19-5进行shotgun测序得到多个MaSp1片段,将包含部分重复区和C端非重复区的片段命名为MaSp1RC.MaSp1RC长786 bp,预编码262个氨基酸(AvMaSp1RC).AvMaSp1RC可划分为重复区(Rep)和C端非重复区(CT,110个氨基酸残基)(图2).AvMaSp1RC重复区主要由甘氨酸(Glycine,Gly)和丙氨酸(Alanine,Ala)组成,约占总氨基酸含量的78%(如图3(a)所示),主要以GlyGlyx,Glyx(x为其他氨基酸)和poly-Ala典型的蛛丝蛋白模块形式存在.AvMaSp1RC非重复区丝氨酸(Serine,Ser)、Ala和缬氨酸(Valine,Val)、亮氨酸(Leucine,Leu)(大约占67%,如图3(b)所示)含量较高.对AvMaSp1RC中含量相对较高的4种氨基酸(Ala,Ser,Gly,Gln)进行密码子偏爱性分析,结果如图4所示.由图4可以看出,密码子第三位腺嘌呤(Adenine,A)和胸腺嘧啶(Thymine,T)占主要优势,鸟嘌呤(Guanine,G)和胞嘧啶(Cytosine,C)使用频率较低.
利用PSIPRED对AvMaSp1RC CT二级结构进行预测,AvMaSp1RC CT主要由5个α-helix组成(图2),其中最长的helix 4呈现高疏水性(图5,氨基酸位置为213~233).AvMaSp1RC重复区由于重复性高,亲疏水性呈周期性变化,分布均匀.

图2 MaSp1RC序列及编码氨基酸Fig.2 MaSp1RC gene sequence and amino acids
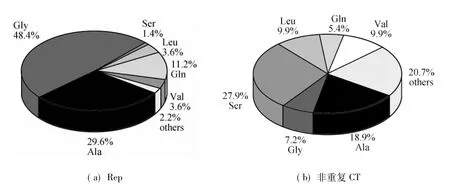
图3 AvMaSp1RC重复区和非重复CT氨基酸组成分析Fig.3 Amino acid composition of AvMaSp1RC Rep and CT domains
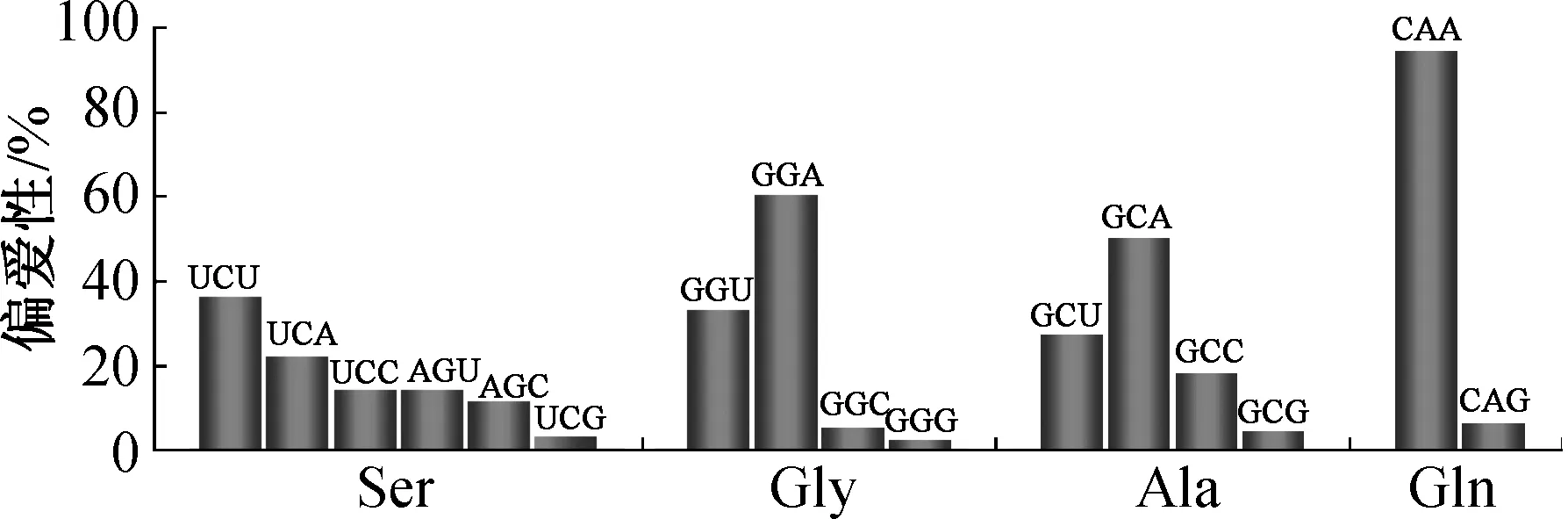
图4 AvMaSp1RC高频氨基酸密码子偏爱性分析Fig.4 Codon preference of high-frequency amino acids predicted from AvMaSp1RC
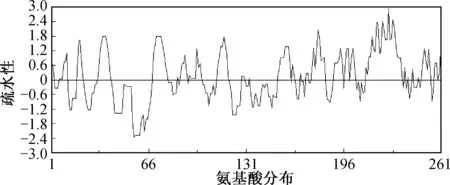
图5 AvMaSp1RC亲疏水性分析Fig.5 Kyte -Doolittle hydrophobicity plot for AvMaSp1RC
2.3 AvMaSp1同源性分析
利用Clustal Omega对AvMaSp1RC与NCBI收录的其他多种蛛丝蛋白C端序列进行序列比对分析,结果如图6所示.由图6可以看出,AvMaSp1RC与其他的蛛丝蛋白C端氨基酸序列保守性较高,其中精氨酸(Arginine,Arg)、天冬氨酸(Aspartic acid,Asp)、谷氨酸(Glutamic acid,Glu)以及赖氨酸(Lysine,Lys)呈高保守(图6中矩形框).另外,MiSp和MaSp的CT结构域中QALL模块以及MaSp的CT中的半胱氨酸(Cysteine,Cys)也高度保守.

图6 AvMaSp1RC CT与NCBI收录的多条蛛丝蛋白C端序列比对Fig.6 Amino acid alignment of AvMaSp1RC CT with different spidroin CT domains deposited in NCBI

图7 AvMaSp1RC系统进化分析Fig.7 Phylogenetic analysis of AvMaSp1RC
利用NCBI中的Protein Blast对C端序列进行同源性分析,结果显示AvMaSp1RC CT与多条MaSp CT序列具有较高的一致性,其中与Argiopeamoena(A.amoena)MaSp1CT一致性高达92%,与A.trifasciataMaSp1CT一致性达85%,与Argiopebruennichi(A.bruennichi)的一致性也高达83%,除此之外,还与其他数种蜘蛛丝的相似性达70%以上.利用MEGA V4.0对NCBI上选取的多种蛛丝蛋白C端氨基酸序列(A.trifasciataMaSp2,A.bruennichiMaSp1,N.clavipesFlag,L.hesperusMiSp,U.diversusMiSp,L.hesperusAcSp1,A.ventricosusAcSp,A.argentataTuSp1,A.apertaTuSp1,A.gulosusfibroin1,P.tristisfibroin1,A.trifasciataPySp,L.hesperusPySp.)绘制同源蛋白进化树,结果如图7所示.由图7可以看出,AvMaSp1RC与A.trifasciataMaSp2,A.bruennichiMaSp1位于同一节点,属于同一个基因家族,与Flag,AcSp,TuSp和PySp属于不同的基因家族.
3 讨 论
蛛丝纤维由高相对分子质量的蛛丝蛋白组成,如主壶腹腺丝主要由MaSp1和MaSp2两个亚基组成,鞭毛状丝则由Flag单个亚基组成,次壶腹腺丝由MiSp1和MiSp2组成等[7-9,11,17].虽然蛛丝蛋白组成成分各不相同,但初级结构较为相似,均由N端和C端非重复区以及重复区组成,其中NT和CT可调节蛛丝蛋白的纤维化,而Rep则与丝纤维的性能相关[11-13,18-20].组成MaSp,MiSp以及Flag Rep的主要模块为polyA/GA,GGx,GPGGx/GPGQQ以及Spacer.polyA/GA可形成紧密的β-sheet晶体结构,与纤维轴向平行,赋予纤维强度;GPGGx/GPGQQ形成β-spiral结构,与纤维良好的延展性相关;GGx模块则主要形成31-helix,连接晶态区域;Spacer功能尚不明确[12,13,21-24].主壶腹腺丝蛋白主要由polyA,GGx和GPGQQ组成,次壶腹腺则主要由polyA/GA,GGx及Spacer组成,由于GA形成的β-sheet晶体结构不如polyA形成的β-sheet晶体结构稳定,因此次壶腹腺丝较主壶腹腺丝强度弱[22].鞭毛状丝蛋白不含polyA,力学强度远小于主/ 次壶腹腺丝,但由于连续出现的GPGGx模块含量高,因此鞭毛状丝具有最好的弹性(> 200%)[9,25].由于主壶腹腺丝拥有强度和弹性的完美结合且分泌腺易于分离,长期以来一直为蛛丝蛋白研究及仿生领域的焦点.但是由于主壶腹腺丝蛋白编码基因长、重复性高等,阻碍了全长MaSp编码基因的克隆.由于全长基因序列报道有限,蛛丝蛋白的基因以及蛋白结构的研究尚不明确,也无完整蛛丝蛋白的表达研究,现阶段的表达和仿生均是尝试对蛛丝蛋白模块串联体的表达,获取的拟蛛丝纤维性能远不及天然蛛丝.为明确蛛丝基因和编码蛋白的结构模式,并为表达仿生研究提供更多的基因资源,本文以实验室前期构建的A.ventrisosus基因组文库为基础[15,26],结合3D/PCR方法筛选MaSp1编码基因,并对通过shotgun测序获取的部分序列进行分析.
AvMaSp1RC Rep主要由典型的蛛丝蛋白模块GlyGlyx和poly-Ala组成,由于AvMaSp1RC Rep缺少MaSp2的特征序列GlyProGlyxx,将其划分为MaSp1家族.AvMaSp1RC Rep与L.hesperusMaSp1Rep较为相似,poly-Ala较长,由6~9个丙氨酸构成.Ala和Gly是组成AvMaSp1RC Rep的主要氨基酸,占78%左右(图3),而在L.hesperusMaSp1和A.ventricosusMiSp重复区中,这两种氨基酸也分别约占68%[11-12].由于蛛丝蛋白的重复区占整个蛋白的95%以上,因此Gly和Ala是构成蛛丝蛋白的主要氨基酸.编码Gly和Ala的密码子前两位主要为G或者C,为了减少GC的使用率,防止mRNA形成特殊的二级结构,与L.hesperusMaSp1和A.ventricosusMiSp相似,Gly和Ala密码子的第三位碱基主要为A或者T,减少了G和C的使用率(图4)[11-12].但在关于悦目金蛛管状腺丝蛋白基因报道中,含量较高的Ser和Gly并未出现明显的密码子偏爱性,说明不同种蜘蛛的不同种蛛丝蛋白在密码子的使用上存在差异[27].
蛛丝蛋白由NT、CT和重复区组成,丝性能主要由重复区氨基酸决定,非重复末端NT和CT则主要参与丝素蛋白纤维化的调节及成丝过程,保守性高[20,28].通过对AvMaSp1RC CT与部分已知蛛丝蛋白CT的比对分析,发现Arg,Asp,Glu以及Lys在参与比对的蛛丝蛋白CT中高度保守,保守的Arg,Asp以及Glu可参与盐键的形成,通过感应pH值的变化控制CT蛋白的稳定性[19,29].研究发现QALL模块在MiSp和MaSp CT中高度保守,该区域疏水性高,位于α-helix 4中,推测这种疏水作用与CT的二聚化有关.另外,MaSp中还拥有保守的Cys,研究表明Cys可以形成链间二硫键,促进稳定CT二聚体的形成[19].MiSp CT主要通过输水作用和离子键形成二聚体,而MaSp CT通过二硫键、疏水作用以及离子键形成更加稳定的二聚体,可能与主壶腹腺丝的高强度相关.研究表明,MiSp的CT模块可溶性较MaSp CT好,可在常温下保存和操作,MaSp CT则容易发生聚集现象,此现象的具体机制尚不明确[29].AraneusdiadematusMaSp 和NephilaantipodianaMiSp CT主要由5个α-helix组成[19,29],因此,利用PSIPRED对AvMaSp1RC CT进行了二级结构预测,AvMaSp1RC CT与上述的CT末端二级结构相似,二级结构主要也为5个α-helix.
系统进化树表明,AvMaSp1RC与A.trifasciataMaSp2和A.bruennichiMaSp1位于同一节点之内,为MaSp蛋白家族新成员.本文研究为蛛丝蛋白编码基因的结构模式以及蛛丝蛋白二聚化研究提供基础,为仿生学的研究提供了更多的基因资源;同时,也为本课题组目前正在开展的利用Intein(蛋白质内含子)剪接合成长片段蛛丝蛋白以及后续的人工纺丝提供了资源,为蜘蛛丝的深入研究和开发打下了良好基础,期望利用此基因序列表达出性能更为优良的蛛丝蛋白,并进行细胞培养等方面的实验,进而应用于医学、军事等多领域的研究.
[1] KLUGE J A,RABOTYAGOVA O,LEISK G G,et al.Spider silks and their applications[J].Trends Biotechnol,2008,26(5):244-251.
[2] HEIM M,KEERL D,SCHEIBEL T.Spider silk:From soluble protein to extraordinary fiber[J].Angew Chem Int Ed Engl,2009,48(20):3584-3596.
[3] RISING A,WIDHE M,JOHANSSON J,et al.Spider silk proteins:Recent advances in recombinant production,structure-function relationships and biomedical applications[J].Cell Mol Life Sci,2011,68(2):169-184.
[4] WIDHE M,JOHANSSON J,HEDHAMMAR M,et al.Invited review current progress and limitations of spider silk for biomedical applications[J].Biopolymers,2012,97(6):468-478.
[5] GOSLINE J M,GUERETTE P A,ORTLEPP C S,et al.The mechanical design of spider silks:From fibroin sequence to mechanical function[J].J Exp Biol,1999,202(23):3295-3303.
[6] LEWIS R V.Spider silk:Ancient ideas for new biomaterials[J].Chem Rev,2006,106(9):3762-3774.
[7] XU M,LEWIS R V.Structure of a protein superfiber:Spider dragline silk[J].Proceedings of the National Academy of Sciences of the United States of America,1990,87(18):7120-7124.
[8] HINMAN M B,LEWIS R V.Isolation of a clone encoding a second dragline silk fibroin:Nephila clavipes dragline silk is a two-protein fiber[J].J Biol Chem,1992,267(27):19320-19324.
[9] HAYASHI C Y,LEWIS R V.Molecular architecture and evolution of a modular spider silk protein gene[J].Science,2000,287(5457):1477-1479.
[10] MOTRIUK S D,SMITH A,HAYASHI C Y,et al.Analysis of the conserved N-terminal domains in major ampullate spider silk proteins[J].Biomacromolecules,2005,6(6):3152-3159.
[11] AYOUB N A,GARB J E,TINGHITELLA R M,et al.Blueprint for a high-performance biomaterial:Full-length spider dragline silk genes[J].PLoS One,2007,2(6):514.
[12] CHEN G F,LIU X Q,ZHANG Y L,et al.Full-length minor ampullate spidroin gene sequence[J].PLoS One,2012,7(12):52293.
[13] AYOUB N A,GARB J E,KUELBS A,et al.Ancient properties of spider silks revealed by the complete gene sequence of the prey-wrapping silk protein (AcSp1)[J].Mol Biol Evol,2013,30(3):589-601.
[14] GARB J E,HAYASHI C Y.Modular evolution of egg case silk genes across orb-weaving spider superfamilies[J].Proceedings of the National Academy of Sciences of the United States of America,2005,102(32):11379-11384.
[15] 陈格飞.基于Fosmid文库与STS/3D-PCR技术的大腹园蛛MaSp基因克隆与鉴定[D].上海:东华大学化学化工与生物工程学院,2010.
[16] 陈格飞,张云龙,林森珠,等.蜘蛛HMW-gDNA的电洗脱纯化提取[J].动物学研究,2009,30(6):627-632.
[17] COLGIN M A,LEWIS R V.Spider minor ampullate silk proteins contain new repetitive sequences and highly conserved non-silk-like “spacer regions”[J].Protein Sci,1998,7(3):667-672.
[18] ASKARIEH G,HEDHAMMAR M,NORDLING K,et al.Self-assembly of spider silk proteins is controlled by a pH-sensitive relay[J].Nature,2010,465(7295):236-238.
[19] HAGN F,EISOLDT L,HARDY J G,et al.A conserved spider silk domain acts as a molecular switch that controls fibre assembly[J].Nature,2010,465(7295):239-242.
[20] EISOLDT L,THAMM C,SCHEIBEL T.Review the role of terminal domains during storage and assembly of spider silk proteins[J].Biopolymers,2012,97(6):355-361.
[21] SIMMONS A H,MICHAL C A,JELINSKI L W.Molecular orientation and two-component nature of the crystalline fraction of spider dragline silk[J].Science,1996,271(5245):84-87.
[22] HAYASHI C Y,SHIPLEY N H,LEWIS R V.Hypotheses that correlate the sequence,structure,and mechanical properties of spider silk proteins[J].Int J Biol Macromol,1999,24(2/3):271-275.
[23] JELINSKI L W,BLYE A,LIIVAK O,et al.Orientation,structure,wet-spinning,and molecular basis for supercontraction of spider dragline silk[J].Int J Biol Macromol,1999,24(2/3):197-201.
[24] JENKINS J E,SAMPATH S,BUTLER E,et al.Characterizing the secondary protein structure of black widow dragline silk using solid-state NMR & X-ray diffraction[J].Biomacromolecules,2013,14(10):3472-3483.
[25] HAYASHI C Y,LEWIS R V.Evidence from flagelliform silk cDNA for the structural basis of elasticity and modular nature of spider silks[J].J Mol Biol,1998,275(5):773-784.
[26] 张云龙,陈格飞,陈国亮,等.大腹园蛛Fosmid文库的构建及MaSp基因筛选方法的探讨[J].生命科学研究,2010,14(1):21-26.
[27] BITTENCOURT D,SOUTO B M,VERZA N C,et al.Spidroins from the Brazilian spider Nephilengys cruentata (Araneae:Nephilidae)[J].Comp Biochem Physiol B Biochem Mol Biol,2007,147(4):597-606.
[28] RISING A.Controlled assembly:A prerequisite for the use of recombinant spider silk in regenerative medicine?[J].Acta Biomater,2014,10(4):1627-1631.
[29] GAO Z,LIN Z,HUANG W,et al.Structural characterization of minor ampullate spidroin domains and their distinct roles in fibroin solubility and fiber formation[J].PLoS One,2013,8(2):56142.
Screen and Sequence Analysis of Major Ampullate Spidroin Gene-1fromAraneusVentricosus
ZHANGXue,CHENGe-fei,MENGQing
(Institute of Biological Science and Biotechnology,Donghua University,Shanghai 201620,China)
To research the spider silk protein coding gene architecture,protein modules and supply different kinds of gene resources for bio-mimicing spider silk,major ampullate spidroin gene-1(MaSp 1)gene is screened from anAraneusventricosus(A.ventricosus)Fosmid gene library by 3D/PCR (three-dimensional polymerase chain reaction)technology and partial MaSp1sequence is analyzed.By screening the Fosmid gene library,a positive clone containing the MaSp1gene is obtained,termed Av11-19-5,which is now being sequenced,and partial MaSp1coding gene,MaSp1RC,has already been found out.MaSp1RC is 786 bp in size and encodes 262 amino acids which can be divided into non-repetitive C terminal domain(CT) and repetitive domain(Rep).The Rep is mainly composed of poly-Ala,Glyxand GlyGlyxmodules,in which Ala and Gly content is about 78%.In CT domain,amino acids involved in forming salt bridge and hydrophobic domain in elix 4are highly conserved.The study result supplies a new biomimetic gene resource,and gives a basis for working with spider silk protein coding gene architecture and dimerization.
Araneusventricosus; major ampullate spidroin; 3D/PCR technology; sequence analysis
1671-0444(2015)01-0053-07
2013-11-04
国家“八六三”高技术研究发展计划资助项目(2006AA03Z451);国家自然科学基金资助项目(31070698);上海市基础研究重点资助项目(10JCl400300);教育部高等学校博士学科点专项科研基金资助项目(20120075110007)
张 雪(1988—),女,上海人,硕士研究生,研究方向为蛛丝蛋白基因的筛选及分析.E-mail:zhangjessi@126.com
孟 清(联系人),男,教授,E-mail:mengqing@dhu.edu.cn
Q 78
A

