武汉市市售淡水小龙虾中副溶血性弧菌的分离鉴定及多位点序列分型
周颖等


摘要:采集武汉市各大农贸市场52份小龙虾(即克氏原螯虾,Procambarus clarkii)样品,利用1%氯化钠碱性蛋白胨水(APW)和TCBS对小龙虾样品中副溶血性弧菌(Vibrio parahaemolyticus)进行分离和初步鉴定,用PCR扩增副溶血性弧菌具有种特异性的tl基因来验证疑似菌株。PCR检测方法共检出14株副溶血性弧菌,检出率为26.92%。在小龙虾中分离得到的14株副溶血性弧菌,对其进行基于dnaE-gyrB-recA-dtdS-pntA-pyrC-tnaA的多位点序列分型。其中dtdS的多态性位点比例均高于其他6个基因,为5.2%。7个基因串联后将14株副溶血性弧菌分为12个序列型,其中7株序列型未知,分辨力达0.967。可知武汉市市售淡水小龙虾中副溶血性弧菌呈现出较大的多样性。Neighbor-joining系统进化树将分离得到的14株副溶血性弧菌分为2个群,VP2、VP13、VP7和VP14同属一个群,其他10株则属于另外一个群。其中VP13和已知的临床分离株ST3在进化树上表现出较高的亲缘性(69%)。
关键词:副溶血性弧菌(Vibrio parahaemolyticus);小龙虾(Procambarus clarkii);多位点序列分型;系统进化树
中图分类号:S852.61;S966.12 文献标识码:A 文章编号:0439-8114(2015)18-4548-04
DOI:10.14088/j.cnki.issn0439-8114.2015.18.039
湖北省水产品产值约占到农业的20%,淡水产品总产量连续16年在中国排名第一。其中,淡水小龙虾出口一直是中国出口最多的省份,约占中国出口总量的50.6%[1]。小龙虾学名克氏原螯虾(Procambarus clarkii)[2],也叫淡水小龙虾。小龙虾的养殖主要分布于池塘、沟渠等地区,受生长环境的影响,虾体内可能寄生多种病原微生物,易通过交叉污染其他农产品,对消费者健康造成威胁。而且在出口方面,淡水产品常因微生物超标导致淡水产品不合格而影响了产品的对外信誉,严重阻碍了湖北省整个水产产业链的健康发展。
副溶血性弧菌(Vibrio parahaemolyticus,VP)是革兰氏阴性嗜盐菌,隶属弧菌科弧菌属,它是一种典型的人兽共患病菌,也是一种常见的引起食物中毒的病原菌[3]。据世界卫生组织报道,自1997年以来,副溶血弧菌病的发生呈持续上升趋势。1992~2001年国家食源性疾病监测网数据显示,发生的微生物食源性疾病中由副溶血弧菌引起的病例数占首位(31.1%)[4,5],可知副溶血性弧菌对公共卫生已经构成严重威胁。虽然副溶血性弧菌为嗜盐菌,但近期在淡水小龙虾产品中分离率很高。人若食用这些未煮熟的产品可发生食物中毒、胃肠炎、反应性关节炎及败血症等[6]。对病原微生物进行准确种群分布与分型研究是探讨其致病性、流行性、变异性、耐药性等特征和建立快速检测、鉴定与控制技术的关键[7]。因此,开展副溶血性弧菌流行特征和溯源性的分型研究对预防食源性副溶血弧菌病的流行具有十分重要的意义。多位点序列分型(Multilocus sequence typing,MLST)是一种用于种群的遗传分析的分型技术,不同于常规的微生物种群生物学分型技术,是近年来发展很快的分子生物学分析方法[8]。MLST分辨力很高,结果易于被验证、电子保存、可在全球范围内实现数据交流与共享,且材料易于获得,只需制备细菌DNA或是死细胞悬液,无需培养病原菌[9]。MLST系统因结合了序列测定的高通量特性和已建立的群体遗传学技术,具有方便、可重复性、可测性等特点而越来越多的被作为国际间菌株比较的常用工具[10]。
本试验利用碱性蛋白胨水(APW)增菌液、TCBS选择培养基及PCR检测方法对武汉市市售淡水小龙虾中副溶血弧菌进行分离鉴定,并基于dnaE-gyrB-recA-dtdS-pntA-pyrC-tnaA 7个管家基因串联对分离到的菌株进行多位点序列分型,通过分析分离株间的亲缘关系,以推断其变异性,确定食品污染的病原菌及各种信息,对控制副溶血性弧菌的食源性污染有重要参考价值。
1 材料与方法
1.1 材料
副溶血弧菌标准菌株(ATCC33846)由上海交通大学史贤明教授馈赠。小龙虾样品于武汉市各大农贸市场采集,样品共52份。
1.2 试剂与仪器
蛋白胨购自北京双旋微生物培养基制品厂,TSB与TCBS琼脂购自青岛高科园海博生物技术有限公司,琼脂粉购自北京奥博星生物技术有限公司,Taq DNA polymerase、DNA Ladder Marker、dNTP、10×PCR Buffer购自北京全氏金生物技术有限公司,NaCl等其他试剂产自国药集团化学试剂有限公司。
5414型高速冷冻离心机(德国艾本德股份公司);Model MG96+PCR仪(郑州比朗仪器有限公司);DYY-8C型电泳仪(北京市六一仪器厂);凝胶成像系统(美国伯乐公司)。
1.3 方法
1.3.1 小龙虾样品中副溶血性弧菌的培养 样品中副溶血性弧菌的分离鉴定参照GB/T 4789.7-2008,将小龙虾样品剪碎后放入1%氯化钠碱性蛋白胨水中增菌培养后,接种到TCBS培养基上划线分离,挑取TCBS培养基上蓝绿色、圆形、直径为2~3 mm、触摸有口香糖质感的疑似菌落,接种到含1%氯化钠的胰蛋白胨大豆琼脂培养基(TSA)平板上纯化培养。
1.3.2 基因组的提取 DNA提取采用水煮法。取细菌纯培养物1 mL 10 000 r/min离心5 min,加入100 μL无菌水,使菌液悬浮后于100 ℃水浴10 min,冰浴5 min,10 000 r/min离心4 min,上清液储存在-20 ℃备用。
1.3.3 引物的设计与合成 根据GenBank上已发表tl、dnaE、gyrB、recA、dtdS、pntA、pyrC和tnaA序列用DNA Star软件设计8对引物,由上海英骏生物技术有限公司合成。引物序列与目的片段长度见表1。
1.3.4 PCR验证试验 对疑似菌株用PCR扩增VP具有种特异性的tl基因,来验证所分离菌株。PCR体系共25 μL,模板1 μL,上下游引物各1 μL,2.5 mmol/L dNTP 1 μL,10×PCR Buffer 2.5 μL,5 U/μL Taq酶0.25 μL;扩增条件:94 ℃预变性10 min,94 ℃变性40 s,56 ℃退火30 s,72 ℃延伸50 s,共25个循环,72 ℃延伸7 min。PCR产物用110 V电压,0.8%琼脂糖凝胶电泳35 min后检测。
1.3.5 管家基因的扩增及其产物测序 PCR体系共25 μL,模板1 μL,上下游引物各1 μL,2.5 mmol/L dNTP 1 μL,10×PCR Buffer 2.5 μL,5 U/μL Taq酶0.25 μL;扩增条件:94 ℃预变性10 min,94 ℃变性40 s,56 ℃退火30 s,72 ℃延伸60 s,共35个循环,72 ℃延伸7 min。PCR产物用110 V电压,0.8%琼脂糖凝胶电泳35 min后检测。检测正确后将PCR产物送至生工生物工程(上海)股份有限公司武汉测序部测序。
1.3.6 多位点序列分型 登录国际多位点序列分型数据库(http://pubmlst. org/vparahaemolyticus/),将本试验获得的14株副溶血弧菌的7个管家基因测序结果与数据库已知信息进行比对,以获取菌株的等位基因编号。将已得菌株的7个基因的编号与数据库已知信息进行比对,获取菌株的序列型。
1.3.7 多态性分析及系统进化树的制作 使用MEGA5.03软件进行多态性分析,分析包括等位基因数、多态性位点数、GC含量以及同义突变(dS)与非同义突变(dN)。各基因的分辨力(Discrimination Index,DI)按以下公式计算[11](N代表分析的菌株数,j代表等位基因型数目,nj代表某一等位基因型的菌株数):
DI=1-■■nj(nj-1)
使用MEGA5.03中的Neighbor-joining法将14株分离株与已知的临床分离株ST3、ST8和ST120[12]一同构建系统进化树,比较其亲缘关系。
2 结果与分析
2.1 副溶血性弧菌分离鉴定结果
将52份淡水小龙虾增菌液划线于TCBS选择培养基上,共得到蓝绿色疑似菌落41份。
2.2 PCR验证试验及检出率
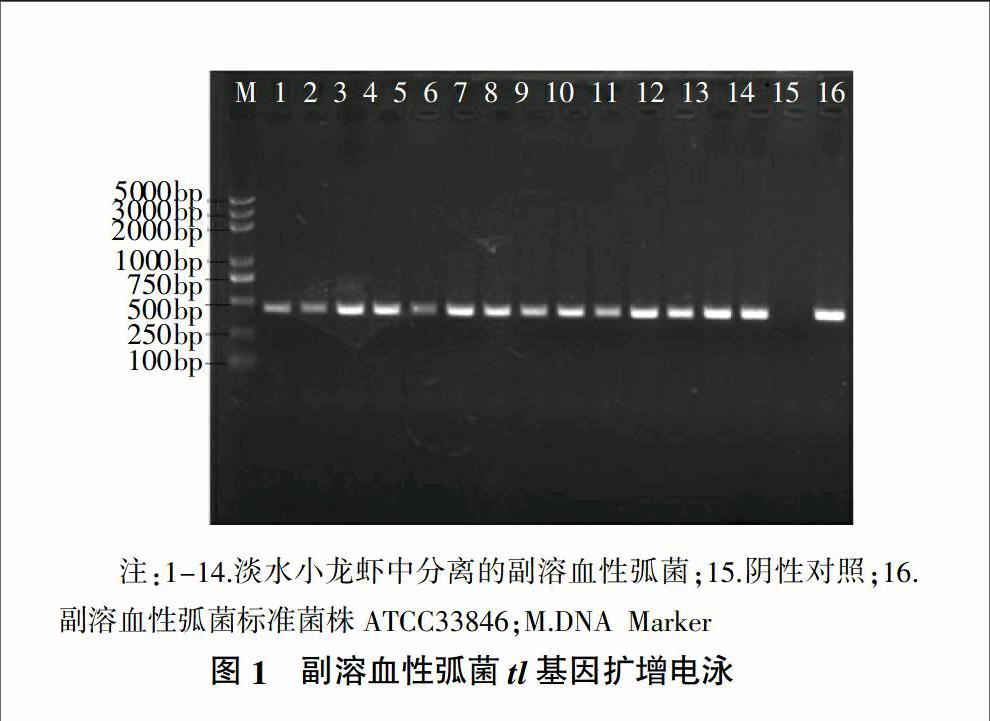
疑似分离菌株的tl基因扩增结果表明,有14株为阳性,出现特异性目标条带,其余均为阴性。得淡水小龙虾中副溶血性弧菌的检出率为26.92%。扩增结果见图1。
2.3 副溶血性弧菌的多位点序列分型
dnaE基因可将14株副溶血性弧菌海产品分离株分为11个等位基因型,其中菌株VP1、VP3、VP4与VP6属于dnaE-111型,其他菌株各成一个等位基因型;gyrB基因可将14株副溶血性弧菌海产品分离株分为10个等位基因型,其中菌株VP1、VP3、VP4与VP6属于gyrB-239型,菌株VP7和VP8属于gyrB-92型,其他菌株各成一个等位基因型;recA基因可将14株副溶血性弧菌海产品分离株分为10个等位基因型,其中菌株VP1、VP3、VP4、VP8与VP10属于recA-31型,其他菌株各成一个等位基因型;dtdS基因可将14株副溶血性弧菌海产品分离株分为11个等位基因型,其中菌株VP1、VP3、VP4与VP6属于dtdS-195型,其他菌株各成一个等位基因型;pntA基因可将14株副溶血性弧菌海产品分离株分为10个等位基因型,其中菌株VP1、VP3、VP4与VP6属于pntA-24型,菌株VP2和VP7属于pntA-54型,其他菌株各成一个等位基因型;pyrC基因可将14株副溶血性弧菌海产品分离株分为10个等位基因型,其中菌株VP1、VP3、VP4与VP6属于pyrC-173型,菌株VP2和VP13属于pyrC-11型,其他菌株各成一个等位基因型;tnaA基因可将14株副溶血性弧菌海产品分离株分为9个等位基因型,其中菌株VP1、VP3、VP4与VP6属于tnaA-14型,菌株VP7、VP8和VP11属于tnaA-24型,其他菌株各成一个等位基因型。综合上述7个管家基因的多位点序列分型结果,可将14株副溶血性弧菌分为12个序列型,其中VP1、VP3和VP4属于同一序列型(ST446),其他菌株均各成一个序列型(表2)。且在分离得到的14株副溶血弧菌中有7株数据库中未收录,为未知序列型。
2.4 dnaE、gyrB、recA、dtdS、pntA、pyrC、tnaA的多态性分析
在分离得到的14株副溶血弧菌中recA基因和dtdS基因的多态位点数最多(表3),达24个,其中dtdS基因的多态位点比例最高,为5.2%。pntA基因和tnaA基因发生同义突变的概率大于发生非同义突变的概率,而其他基因则反之。其中pntA基因发生非同义突变的概率为0,dnaE基因发生同义突变的概率为0。将7个管家基因串联后,多态位点比例为2.7%,可分辨出12个序列型,分辨率可达0.967。
2.5 系统进化树
利用MEGA5.03软件中的Neighbor-joining法绘制系统进化树见图2,分离到的14株副溶血性弧菌被分为2个群,VP2、VP7、VP13、VP14和ST3、ST8同属一个群,其他10株和ST120则属于另外一个群。其中VP1、VP3和VP4属于同一序列型,VP6虽然与其不属于同一序列型,但是它们在进化树上表现出高度的亲缘性(100%)。VP13和已知的临床分离株ST3在进化树上也表现出较高的亲缘性(69%)。
3 结论
本试验对52份武汉市市售淡水小龙虾中的副溶血性弧菌进行分离鉴定,共得到了14株副溶血性弧菌,VP检出率为26.92%。虽然副溶血性弧菌为嗜盐菌,但其在淡水小龙虾中的检出率也很高。可能是养殖及销售条件粗放,市场销售过程中交叉污染导致。在使用淡水产品时也要保持高度警惕,不生食,熟制彻底后方可食用。利用多位点序列分型对分离株进行分型,可得到12个序列型,其中7个序列型在数据库中未收录,为未知序列型。可见,淡水小龙虾中的副溶血性弧菌呈现出较大的多样性。这表明淡水小龙虾在养殖过程中的污染途径不单一,存在交叉污染的风险。通过Neighbor-joining法绘制系统进化树,可知虽然VP6虽然与VP1、VP3和VP4不属于同一序列型,但是它们在进化树上表现出高度的亲缘性(100%),故推测VP6与VP1、VP3和VP4来自于单一克隆,经历低水平的分子变异而来。且进化树中各菌株之间的亲缘关系不是很高,故推测都存在不同程度的分子变异,而这也有可能是造成淡水小龙虾中副溶血性弧菌检出率高的另一原因。值得注意的是,其中VP13和已知的临床分离株ST3在进化树上表现出较高的亲缘性(69%),故此类菌株对公共卫生造成的威胁较大,易引起食物中毒。因此,副溶血性弧菌对淡水小龙虾养殖业以及广大消费者所引起的公共卫生的潜在威胁和风险都不容小视[13-16]。故应在养殖环节建立病原菌检测体系,以预防食源性疾病的发生。
参考文献:
[1] 湖北省水产局产业处.三艘航母给力湖北水产,四大效应初显品牌活力[J].养殖与饲料,2011(9):90.
[2] 张 毅,胡定金,魏 辉.PMA-LAMP法对克氏螯虾样品中沙门氏菌的快速检测[J].湖北农业科学,2013,52(23):5854-5857.
[3] 安秀华,宁喜斌.上海市市售水产品中副溶血性弧菌的分离、鉴定及耐药性研究[J].中国人兽共患病学报,2009,25(7):657-659.
[4] 温群文,鞠长燕,曾小思.副溶血性弧菌食物中毒的分子分型及耐药性研究[J].预防医学情报杂志,2009,25(3):190-193.
[5] 杨丽华,陈红有,王晓光.副溶血性弧菌食物中毒分离株的血清型、耐药性及独立基因检测[J].中国卫生检验杂志,2009, 19(12):2762-2769.
[6] 巢国祥.副溶血性弧菌传播特征、O3:K6流行克隆分子生物学特性及多位点序列种群遗传研究[D].江苏扬州:扬州大学,2010.
[7] 董 雪,王秋雨,金莉莉.副溶血性弧菌分子分型和检测研究进展[J].中国卫生检验杂志,2008,18(2):379-381.
[8] 刘 李,段永翔,许 欣.副溶血性弧菌分子分型技术研究进展[J].现代预防医学,2010,37(4):750-752.
[9] 史秀杰,郑晓聪,阮周曦.水生动物中分离的副溶血性弧菌菌株分子分型研究[J].中国动物检疫,2012,29(6):47-63.
[10] 梅玲玲,龚 璞,占 利.浙江省副溶血性弧菌O3:K6血清型菌株多位点序列分型研究[J].中国人兽共患病学报,2014, 30(3):278-281.
[11] 赵 青,章红兵,应延凤.副溶血弧菌海产品分离株及临床分离株的多位点序列分型[J].中国兽医学报,2010,30(1):55-59.
[12] 樊爱军.急性腹泻患者副溶血性弧菌流行特征研究及分子分型分析[D].杭州:浙江大学,2010.
[13] 陈茂义,胡 婕,陈 婷,等.荆州市不同来源副溶血性弧菌毒力基因分布及分子分型研究[J].中国卫生检验杂志,2014, 24(2):231-235.
[14] 胡伟昭.副溶血弧菌:分子分型与主要耐药基因双重PCR检测[D].杭州:浙江大学,2010.
[15] SU Y C,LIU C.Vibrio parahaemolyticus:A concern of seafood safety[J].Food Microbiol,2007,24:549-558.
[16] NAIR G B,RAMAMURTHY T,BHATTACHARYA S K,et al.Global dissemination of Vibrio parahaemolyticus serotype O3:K6 and its serovariants[J]. Clin Microbiol Rev,2007,20:39-48.

