反应时间对钽掺杂球形氧化钨性能的影响*
余钱红,牟婉君,谢 翔,李兴亮,张 锐,魏洪源
(中国工程物理研究院核物理与化学研究所,四川绵阳621900)
氧化钨是一个被广泛研究的过渡金属氧化物,因为它具有独特的性质,可望在电变色器件、传感器、分离材料等方面得到应用,因而被人们广泛关注。近年来,纳米粒子的合成方面已取得重大的进步,目前,研究的重点已转移到各向异性纳米粒子的研究上,因为各向异性纳米粒子可以根据需要而进行排列和功能化,特别是一维过渡金属氧化物纳米材料具有特殊的光学、磁学和电子学特性,越来越受到人们的关注[1-13]。而将过渡金属离子引入材料骨架结构中,对材料进行改性,使其性能更优是目前对材料进行改性研究的热点,如果将一维氧化钨纳米材料进行掺杂,我们期望其特有的缺陷结构和掺杂的杂原子的相互作用,将表现出特异的物理化学性质,必将有重要的用途。钽属于过渡金属,且Ta5+离子的半径较小,活性较大,可以判定钽掺杂应对氧化钨的光吸收性能有较大的影响[14-17]。本工作正是出于以上考虑,选择了金属钽作为掺杂物,以TaCl5和 Na2WO4为原料一步水热法合成钽掺杂球形氧化钨,并采用XRD、SEM、IR和UV-VIS对试样分别进行了物相、形貌、晶型和光吸收特性分析。
1 试验
1.1 试剂和仪器
试剂:TaCl5(分析纯,阿拉丁试剂);C2H6O12(分析纯,天津市科密欧化学试剂有限公司);Na2WO4(分析纯,成都科龙化学试剂有限公司);异丙醇(分析纯,成都联合化学试剂有限公司);硫酸铵(分析纯,成都联合化学试剂有限公司);浓盐酸(分析纯、上海化学试剂有限公司);实验用水为二次蒸馏水(自制)。
仪器:自动程序控温烘箱(杭州卓驰仪器有限公司);85-2型电磁搅拌器(上海司乐仪器有限公司);BS22242S型电子天平(德国赛多利斯公司,精度为0.1mg);LGJ-1D-50型冷冻干燥机(北京瑞帮兴业科技公司)。
1.2 样品的制备
在聚四氟乙烯反应釜中加入1g Na2WO4和2g C2H6O12,加入18mL蒸馏水,磁力搅拌器搅拌至完全溶解,再加入一定量3mol/L盐酸溶液、再加入TaCl5的异丙醇溶液和0.5mol/L硫酸铵溶液,保证反应釜总的填充度为80%,磁力搅拌2h,将反应釜旋紧密闭后至于程序烘箱中,升温和降温速率分别控制为1℃/min,在170℃下水热处理6h~48h。反应完成后,取出反应釜,冷却至室温。将反应产物分别用蒸馏水洗涤至中性,再置于-40℃冷冻干燥机中冷冻干燥,获得钽掺杂球形氧化钨。
1.3 样品表征
利用Thermo ARL SCINTAG X-TRA型X射线衍射(XRD)仪上对样品的物相进行表征,辐射源Cu Kα,管电流 40mA,管电压45kV,步长0.04°,扫描速率5°/min,扫描范围2θ 角度15°~80°;利用X -650型J型热场发射扫描电子显微镜(SEM)对样品进行形貌分析;利用670FT-IR傅立叶红外光谱仪测定样品的红外光谱图。利用UV-2450型的紫外可见分光光度计测量样品的光吸收特性。
2 结果与讨论
2.1 晶体结构表征
图1当为葡萄糖浓度为1.15mmol/L时,在不同反应时间所得产品的XRD谱。所获的样品的XRD衍射峰与氧化钨(JCPDS card No.02-0310)标准谱图的衍射峰的位置基本一致,属于三斜晶相的氧化钨,从图1可看出,在不同反应时间,(002)晶面衍射峰较强,且主衍射峰面的位置一致,当反应时间为6h时,主峰为钽掺杂氧化钨的衍射峰,但有Ta2O5杂峰出现,随着反应时间的增加,Ta2O5杂峰的强度减弱,当反应时间继续增加,Ta2O5的衍射峰强度减弱直至消失,主衍射峰的强度随反应温度的升高而增强,结晶度提高。其中,反应时间为48h时制备的样品的衍射峰强度最高,其结晶性最好。
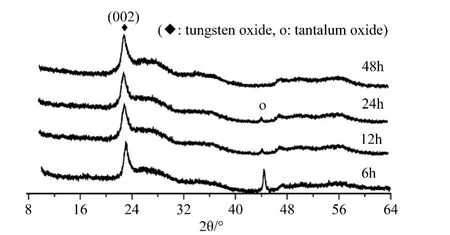
图1 不同反应时间下样品的XRD谱(◆:氧化钨,○:五氧化二钽)Fig.1 XRD patterns of product synthesized at 170℃with different reaction time
2.2 SEM 形貌分析
图2为在不同水热反应时间下获得钽掺杂球形氧化钨的SEM照片。由图2a~图2d可见,获得样品的形貌均为球状,在水热反应初期钨酸钠在酸性条件下形成浅黄色沉淀,形成钨酸根,形成负离子配位多面体,与溶液中的五价钽离子和钠离子形成配位,在高温、高压条件下负载在葡萄糖炭球的表面。图2a、2b为反应6h、12h时,获得钽掺杂氧化钨的SEM照片,可见氧化钨球的大小不一,且球表面不规整,团聚严重,可能由于反应时间太短,反应未进行完全,随着反应时间的延长,原料有充分的反应时间,当反应时间达到24h时(见图2c),随着反应时间的延长,球体团聚现象消失,球外观轮廓较为规整,但球体表面存在少量颗粒。当反应时间达到48h时(见图2d)获得表面光滑的钽掺杂球形氧化钨,轮廓清晰,球体直径为1μm~2μm。

图2 不同反应时间下样品的SEM照片Fig.2 SEM images of samples synthesized at 170℃with different reaction time
2.3 IR分析
图3给出了在不同反应时间获得产品的红外谱图,从图中可知不同反应时间获得的产品在750cm-1处有较强的吸收峰,该吸收峰均由W-O-W的弯曲振动吸收引起,且随着反应时间的增加,吸收峰的强度加强,说明产品中的W的含量增加,同时反应时间延长,吸收峰发生移动揭示了W-O-W夹角发生了变化,可能由于水热反应过程中不断发生脱水缩聚反应,形成不同形貌的产物,从而产生W-O-W夹角的变化,引起吸收峰位置的移动。
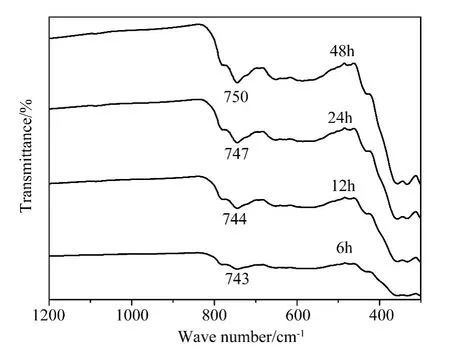
图3 不同反应时间下样品的IR谱图Fig.3 IR spectrum of samples synthesized at 170℃with different reaction time
2.4 紫外-吸收分析
不同条件下水热法合成钽掺杂氧化钨球的紫外可见光的吸收谱如图4,由图可见获得样品的主要紫外吸收峰在480nm左右,在相同的钽掺杂量条件下,随着反应时间的增加,样品对光的吸收量增加,由于在光的照射下,价带的电子被激发至导带,同时产生大量的空穴,新生成的电子与空穴在运动过程若再次相遇便会以光或者热的形式释放能量,从而实现了对光的吸收。因此,水热反应体系中合成氧化钨时,不同反应时间影响了氧化钨内部电子的排列、空穴和缺陷等的形成,从而使得不同反应时间下合成钽掺杂氧化钨球的光吸收特性不同。不同水热反应时间下制备的样品剂的吸收带边值略有差别,由半导体光吸收阀值λg与带隙能Eg的关系式(1),可算出钽掺杂氧化钨球的平均带隙为3.74eV。反应 6h、12h、24h、48h 的样品禁带宽度分别为3.82eV、3.76eV、3.71eV、3.68eV。

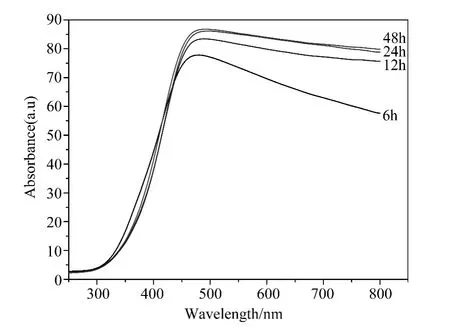
图4 不同反应时间下样品的紫外-可见光的吸收光谱图Fig.4 UV-Vis absorbance spectrum of samples synthesized at 170℃with different reaction time
3 结论
(1)在水热法体系中合成钽掺杂球形氧化钨时,随着反应反应时间的延长,都有利于合成球形氧化钨,在反应温度为170℃和反应时间48h下合成表面规整、轮廓清晰、球体直径为1μm~2μm的钽掺杂球形氧化钨。
(2)对不同反应时间下合成的钽掺杂球形氧化钨进行紫外-可见光的吸收光谱分析可得,随着反应时间的延长,合成的钽掺杂球形氧化钨的光吸收能力也逐渐增加。
[1]Baserga A,Russo V,Di F F,et al.Nanostructured Tungsten Oxide with Controlled Properties:Synthesis and Raman Characterization[J].Thin Solid Film s,2007,515(16):6465 -6469.
[2]Christopher SB,Ivan P P.Atmospheric Pressure Chemical Vapor Deposition of Crystalline Monoclinic WO3and WO3xThin Films from Reaction of WCl6with O2containing Solvents and Their Photochromic and Electrochromic Properties[J].Chem.Mater,2005,17(6):1583 -1590.
[3]Dong J K,Su-ll P.Hydrogen Transport through A-nodic WO3Films[J].Electorchim Acta,1998,43(16217):2341-2347.
[4]Cantalini C,PelinoM,Sun H T,et al.Cross Sensitivity and Stability of NO2Sensors from WO3Thin Film[J].Sensors and Actutors B,1996,35(123):112-118.
[5]Lev,Wu Z,Bharathi S,et al.Sol-gel Materials in Electrochemistry [J].Chem.Mater,1997,11(9):2354-2375.
[6]Christopher S.Griffith,Vittorio Luca,Patrick Yee.Separation of Cesium and Strontium from Acidic Radioactive waste simulants using a microporous tungstate[J].Plyacrylonitrile composite adsorbent,2005,40:1781 -1796.
[7]Zhu K K,He H Y,Xie S H,et al.Crystalline WO3nanowires synthesized by templating method[J].Chemical Physics Letters,2003,377:317 -321.
[8]Erossinvol,Arbiol J,Peiro F,et al.Nanostructured mrtal oxides synthesized hard template method for gas sensing applications[J].Sens Acyuators,B:Chem,2005,109:57 -63.
[9]Cui X Z,Zhang H,Dong X P,et al.Electrochemical catalytic activity for the hydrogen oxidation of mesoporous WO3and WO3/C composites[J].Journal of Materials Chemistry,2009,18:3575 -3580.
[10]Lay G T,Jiann S,Wei H L,et al.Structure and optical properties of mesoporous tungsten oxide[J].Journal of Alloys and Compounds,2005,396:251-254.
[11]Griffith C S,Luca V.Ion-Exchange Properties of Microporous Tungstates[J].Chem.Mater,2004,16(24):4992-4999.
[12]Vittorio Luca,Christopher S.Griffith,Jonathan Widjaja,et al.Cs+and Sr2+Ion-Exchange Properties of Microporous Tungstates[J].Mat.Res.Soc,2004,807:1 -6.
[13]C Martin,G Solana,P Malet,et al.Nb2O5-supported WO3:a comparative study with WO3/Al2O3[J].Catal.Today,2003,78:365 - 376.
[14]Xu Tongguang.Coutrollable preparation and property investigation of nano-sized tantalates photocatalysts[D].Beijing:Tsinghua University,2007.
[15]Rossinyol E,Anna P,Eva P,et al.Synthesis and characterization of chromium-doped mesoporous tungsten oxide for gas-sensing applications[J].Advanced Functional Materials,2007,17:1801 -1806.
[16]Han Peilin.Preparation of nonmetal doped Na-TaO3by hydrothermal process and studies of optical properties[D].Hohhot:Inner Mongolia University,2009.
[17]Fu X M,Yang Z Z,Xu Y.Influence of Hydrothermal Condition on the Optical Absorption Properties and Morphologies of WO3Nanorods[J].Jounal of Synthetic crystals,2011,40(1):242-246(in Chinese).

