橡胶促进剂M提纯技术的研究
欧阳福生,张倩云,李朝达
(华东理工大学化工学院,上海 200237)
2-巯基苯并噻唑(MBT,促进剂 M)是橡胶加工业中普遍使用的一种通用型促进剂,同时它还是许多次磺酰胺类促进剂的母体[1],是使用量最大的橡胶促进剂品种。MBT对改善橡胶的增塑性、硫化特性、焦烧特性具有良好作用[2]。国内外对轮胎橡胶需求的大幅度增长,促进了对MBT市场需求的逐年提高。
现阶段,国内外都是以苯胺法[3]为主生产MBT。由于苯胺法得到的粗品中MBT只占85%左右,其余为中间产物(如苯并噻唑、二苯硫脲、苯胺基苯并噻唑)和原料(苯胺、硫磺),必须对其进行精制提纯。目前MBT产物的精制提纯仍以传统的酸碱法为主。酸碱法精制工艺虽然简单,但产生大量废水,会对环境造成严重污染[4]。相对于合成过程来说,研究更多的是MBT的绿色环保精制工艺。溶剂精制法对MBT提纯是一种有发展前景的环保工艺。精制溶剂有甲苯、苯胺、二硫化碳、二硫化碳-酸碱等[4-9],目前仅有个别厂家采用甲苯溶剂[9]。但这些溶剂有的效果不佳或溶剂本身存在着沸点过低、毒性强、化学稳定性差或萃取过程需要维持较高压力等问题。
1 实验部分
1.1 原料和试剂
MBT粗品(质量分数:MBT 82.37%、硫脲1.27%、硫2.47%,不溶性树脂13.89%),由中石化的南京化工厂提供,并进行烘干脱水。甲苯、苯并噻唑、苯胺、正己烷、二苯硫脲均为分析纯;二甲苯、环状结构溶剂HHS-1、环状结构溶剂HHS-2、芳香醇SL均为化学纯;工业硫磺,w=99.5%。
1.2 萃取剂的筛选
笔者在前期初选有机溶剂时,通过“相似相容原则”来选择对精品MBT溶解度小、对中间产物和残存原料溶解度较大的溶剂作为萃取剂,但结果存在局限性。溶解度参数(用δ表示)是衡量物质相容性方面一个重要物理常数,是对“相似相溶原则”的一种量化[10]。为了有一量化标准来选择效果较好的萃取剂,笔者引入了溶解度参数理论来指导萃取剂的筛选。
目前,物质溶解度参数的获取大多数来自实验测定[11-17]。对于文献中无法得到的产物中MBT、中间产物、残存原料以及部分溶剂的δ,本研究采用基团贡献法中的Fedors法和Hansen法[15]进行计算。Fedors估算方法的基本原理是将物质分子中的基团看做具有可分割性,分别计算出各种基团的内聚能和摩尔体积,再进行加和,最终估算出整个物质分子的溶解度参数值。其大部分基团的内聚能和摩尔体积在文献[15]中都可查询。

式中:δ为溶解度参数,J1/2/cm3/2;∑U 为各基团内聚能加和,J/mol;∑V为各基团摩尔体积加和,cm3/mol。
1.3 溶解度的测定
在一个用导热油加热、采用精密温度计测温,并具有磁力搅拌的装置上,控制油浴在某一温度。在一个装有冷凝管的三口烧瓶中加入50mL溶剂,加入足够量的溶质后,置于油浴中搅拌30min,直至溶液中仍有未溶解的溶质,此时认为溶质在该温度下的溶解已经达到饱和,溶液恒温静置5min,用移液管迅速取5mL上层清液于已称重的称量瓶(m1)中,并迅速称重(m2),然后将称量瓶置于真空干燥箱中蒸发掉溶剂,再将称量瓶称重(m3),则此温度下溶剂对溶质的溶解度的为:
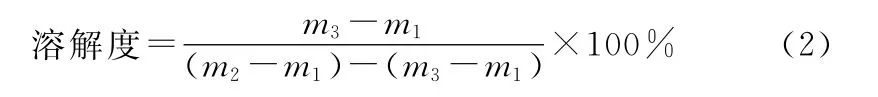
1.4 萃取方法
由于MBT粗品的初熔点在171.2℃,且MBT中“包裹”了中间产物和残存原料,因此应该采用较高的萃取温度,固相才能溶解并与萃取溶剂充分接触,达到提纯效果。MBT粗品在110℃下烘干3h。将5g MBT粗品和一定量的溶剂(根据实验溶剂比需要)加入到三口烧瓶中;加热并搅拌,升温至100℃,萃取时间30min。然后控制一定冷却速度降温至一定过滤温度(过滤温度随溶剂的沸点不同而会有所不同),在此温度下进行恒温过滤。将滤饼移至砂型漏斗中,冷却至室温,用正己烷洗涤,干燥3h后称量。
1.5 分析方法
熔点采用WRS-1B数字熔点仪(上海仪电物理光学仪器有限公司生产)测定。产物的纯度用高效液相色谱进行测定,采用VWD检测器,色谱柱型号为C-18,进样温度保持在20~30℃,流动相为乙腈-磷酸二氢钾,固体试样用二氧六环溶解。
2 结果与讨论
2.1 萃取剂的选择
根据文献[18-19]及基团贡献计算法,得到了与产物中杂质的δ值比较相近(δ=15~30)的有机溶剂,结果见表1。
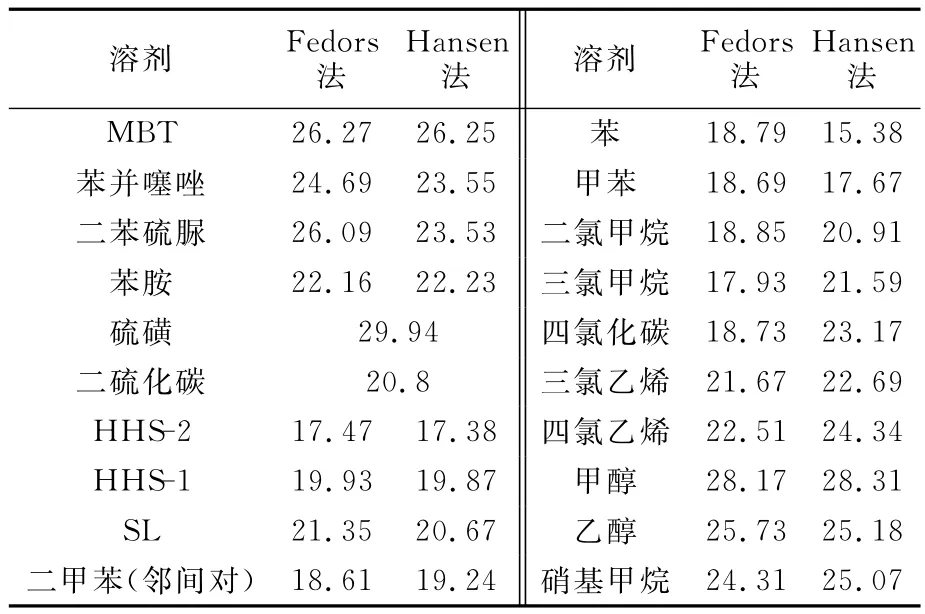
表1 部分溶剂和试剂的δ值 MPa1/2
从表1可见:Fedors法和Hansen法获得的各溶剂的溶解度参数比较接近。从溶解度参数看,MBT与其杂质相差不大,这给溶剂的选择带来较大难度。根据溶解度参数越接近互溶度越大的原则,甲醇、乙醇、硝基甲烷与MBT、苯并噻唑、二苯硫脲与产物和杂质的δ值较接近,不适合作为MBT精制萃取剂;三氯乙烯、四氯乙烯、硝基乙烷虽然与苯并噻唑、二苯硫脲苯、苯胺等杂质的δ值接近而与MBT有一定差距,对MBT产物体系的分离是有利的,但硝基乙烷会与苯胺发生反应,四氯乙烯和三氯乙烯受热易分解或爆炸、毒性较大;因此,硝基乙烷、四氯乙烯、三氯乙烯作MBT精制萃取剂是不适合的。苯、氯苯、二氯甲烷、三氯甲烷、四氯化碳、二硫化碳等溶剂的沸点低、易挥发且毒性较大,也不宜作为MBT精制萃取剂。综合考虑溶解度参数、绿色环保、安全因素,初步选择 HHS-1、HHS-2、SL、二甲苯和甲苯等来考察温度对产物中各组分的溶解度影响,在此基础上再进一步筛选适用于MBT粗品精制的萃取剂。
从δ值看,这5种溶剂的溶解能力次序是SL>HHS-1>二甲苯>甲苯>HHS-2。这5种溶剂的δ值与MBT差距较大,而与杂质(苯并噻唑、二苯硫脲苯、苯胺)的δ值相对接近,也就是说这5种溶剂对MBT溶解度较小,而对MBT产物中的杂质的溶解度较大,满足对萃取溶剂的选择性要求。
2.2 溶剂对MBT粗品中各组分的溶解度曲线测定
为了确定用于MBT精制的萃取剂,需要测定初选溶剂对各组分的溶解度。考虑各溶剂的沸点差异,各溶剂的溶解度测定温度范围会有所不同。
由于上述5种溶剂对苯并噻唑和苯胺的溶解度都很大,并且对硫磺的溶解性较好[17],因此,实验只考察这些溶剂对MBT和二苯硫脲的溶解度,结果见图1~图3。
从图3可见:温度大于100℃时,二苯硫脲在溶剂HHS-2和HHS-1、SL、二甲苯中的溶解度远大于MBT。二苯硫脲的溶解度对温度敏感性比MBT大,尤其是在115℃以上。从这点考虑,若用这些溶剂进行萃取,升高温度对提高产物纯度有利,而且适宜的萃取温度应该在115℃以上。温度大于23℃时,MBT在甲苯中的溶解度大于二苯硫脲,与前面溶剂结果相反,不过在大于40℃时两者溶解度差别也只保持在0.5左右,也即甲苯的选择性几乎没有变化。从溶解选择性上看,在温度大于23℃时,甲苯不如溶剂HHS-2和HHS-1、SL和二甲苯。

图1 MBT和二苯硫脲在HHS-2及二甲苯中的溶解度曲线
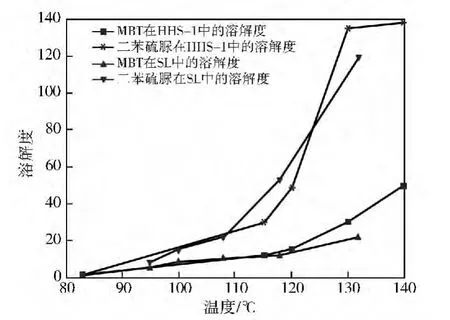
图2 MBT和二苯硫脲在HHS-1及二甲苯中的溶解度曲线
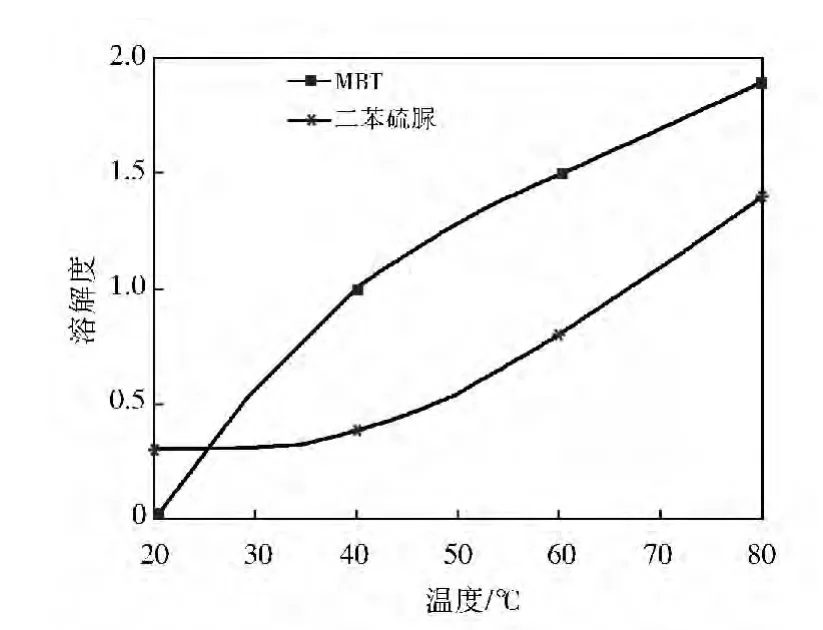
图3 MBT和二苯硫脲在甲苯中的溶解度曲线
从溶解度大小看,5种溶剂对MBT和二苯硫脲溶解度是SL>HHS-1>二甲苯>甲苯>HHS-2。而且,这些溶剂对MBT溶解度较小,而对产物中的杂质溶解度较大。这与它们的溶解度参数大小有较好的一致性。从选择性(二苯硫脲与 MBT溶解度之比)看,HHS-2>SL>HHS-1>二甲苯>甲苯。
2.3 MBT粗品的萃取溶剂初选
实验通过5种溶剂对MBT粗品的精制,筛选出适宜的萃取溶剂。为了能与工业萃取剂甲苯的实验结果进行比较,各溶剂的均采用固液萃取方式。由于MBT粗品中以MBT熔点最高,其余中间产物及残存原料熔点较低,因此产物初熔点越高,说明 MBT纯度越高,这也是GB 11407—2003中设置促进剂MBT初熔点作为质量指标的原因。本研究以初熔点来判断产物纯度。
首先以已在工业上用作萃取剂的甲苯进行MBT粗品精制,以便与其他萃取剂进行对比,结果见图4~图7。从图4和图5可以看出,提高过滤温度或溶剂比,溶解于溶剂中的各组分(MBT和杂质)也会增加,因此产物损失也越大,产率降低,但产物的初熔点(纯度)会提高。相同条件下,精制产物收率依次是SL<二甲苯<甲苯。二甲苯和SL作萃取溶剂时,产物熔点随过滤温度升高而提高的速率均明显大于甲苯。在甲苯溶剂比3∶1、过滤温度70℃条件下,产物初熔点为176.6℃,收率是77.6%。以初熔点为176.6℃为基准,二甲苯在溶剂比2∶1、60℃以上或溶剂比3∶1、57℃以上过滤可以达到,相应的产物收率分别是79.3%和74.3%,效果与甲苯接近;SL在溶剂比2∶1、83℃以上或溶剂比3∶1、72℃以上过滤可以达到,相应的产物收率分别只有是74.6%和63.2%,效果不如甲苯。
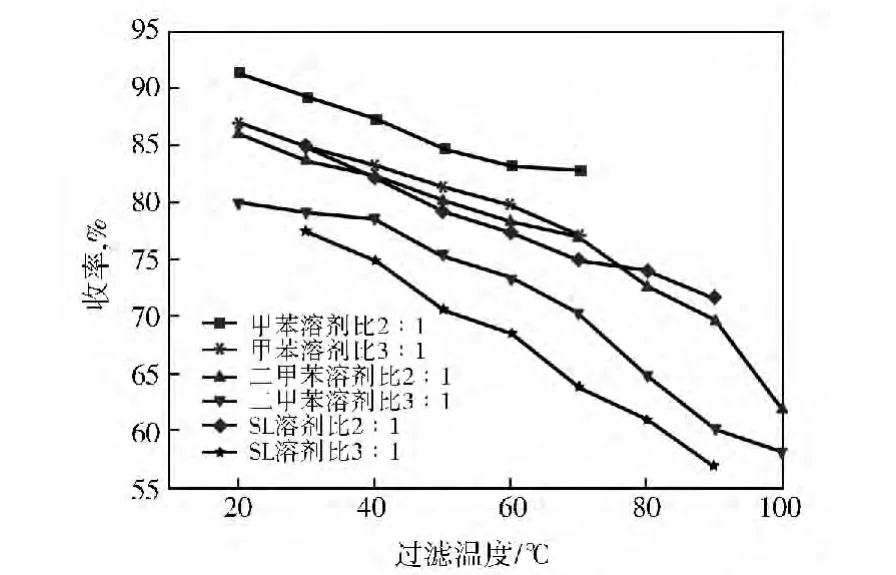
图4 不同萃取剂提纯时过滤温度对MBT产率的影响
由于HHS-2的沸点高于150℃,因此,选择的过滤温度也较高。由图6可见:HHS-2作为萃取剂时,即便溶剂比3∶1、150℃下过滤,产物熔点还低于甲苯溶剂比2∶1、30℃萃取效果,溶剂比5∶1、150℃下过滤,产物初熔点还不到176.6℃。说明HHS-2精制效果远不如甲苯。尽管HHS-2的选择性很高,但由于其对杂质的溶解度很小,因此它不适合作为粗MBT精制的萃取剂。由图7可见,在相同条件下,HHS-1萃取所得产物产率和熔点明显比甲苯作萃取剂时要高。在低于60℃下过滤时,产物熔点和收率均高于二甲苯和SL萃取的产物。综合考虑,HHS-1的萃取效果要优于其他几种溶剂。
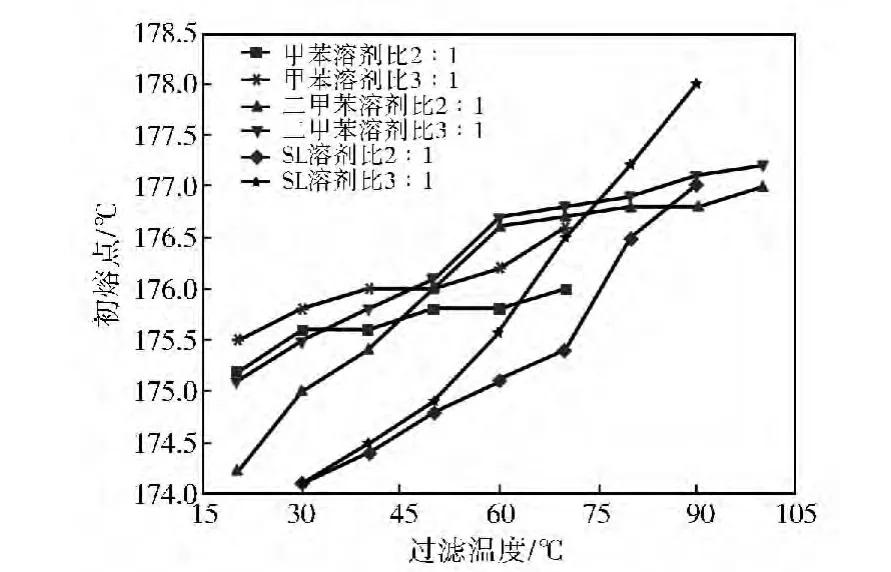
图5 不同萃取剂提纯时过滤温度对产物熔点的影响
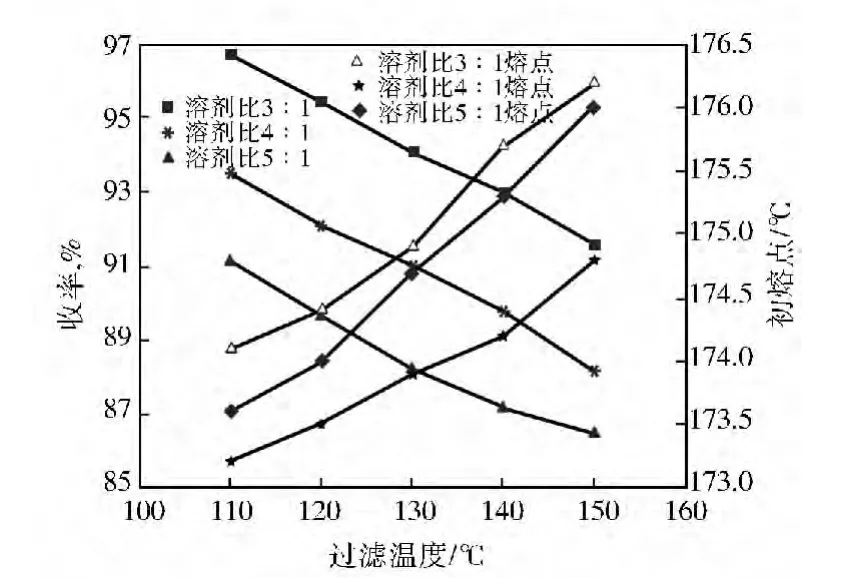
图6 HHS-2萃取时过滤温度对MBT产率的影响

图7 HHS-1萃取时产物过滤温度对产物熔点的影响
2.4 HHS-1作萃取剂的初步工艺
通过考察降温速率、萃取方式、溶剂比等条件对MBT粗品精制效果的影响,寻找萃取效果优于甲苯的工艺条件,也即产物收率大于80%,产物熔点在176.6℃以上。
2.4.1 降温速率
为了能与工业萃取剂甲苯的萃取结果进行比较,筛选溶剂均采用固液萃取方式,这就导致“包裹”在粗品固体颗粒内部的杂质及残存原料不能完全有效与溶剂接触,影响萃取效果。本实验基于常压操作,由于溶剂HHS-1的沸点大于MBT粗品的初熔点(171.2℃),因此,可以采用液液萃取方式,即将固体产物与溶剂混合后边加热、边搅拌,升温至全溶状态。
在固液萃取过程中,由于萃取过程与降温后过滤过程均为固液状态,无晶体爆发式析出过程,故降温速率对产物结果影响不明显。但若是液液萃取过程,则需通过熔融结晶过程将MBT由液态析出为固态,再过滤得到的产物。过饱和热是熔融结晶的推动力,因此控制溶液的过饱和度是控制熔融结晶的重要手段,而过饱和度则主要是由降温速率来决定的。
溶剂比2∶1、180℃下进行液液萃取,控制一定的降温速率,降温至70℃进行过滤,得到产物收率、熔点随降温速率变化关系,结果见表2。由表2可以看出:随着降温速率的加快,产物收率增加,且幅度逐渐增大,同时产物熔点则降低,且下降速率也逐渐增大。这是由于较快的降温速率会出现爆发式MBT晶体颗粒析出,在沉降过程中连带溶液中悬浮的杂质晶体,使得析出过滤得到的产物收率虽有所提升,但纯度因外层包裹有杂质而下降。在降温速率为2.0℃/min时得到的产物结块严重,晶体形态差。这是由于降温速率过快,过饱和度急剧增大,从而形成大量细晶,使得晶核比表面积增大,容易使晶体粘结在一起导致结块。综合收率及纯度,选取液液萃取状态到过滤温度的降温速率为1.0℃/min。
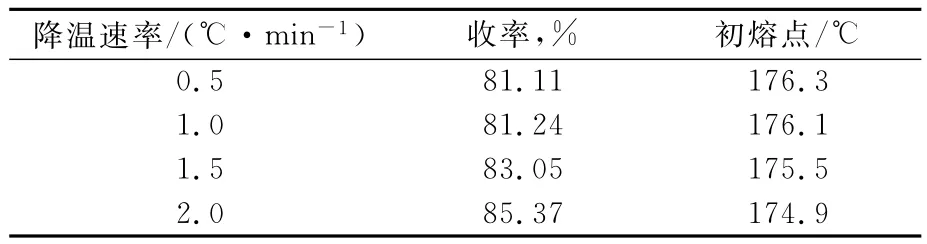
表2 降温速率对产物收率和初熔点的影响
2.4.2 萃取方式和过滤温度
溶剂HHS-1的沸点超过MBT粗品的初熔点,萃取过程可以常压下进行。这里考察了固液和液液萃取两种方式对MBT粗品精制的影响。液液萃取和固液萃取采用的工艺条件为:在一定溶剂比下萃取30min之后,以1.0℃/min降温至20~60℃下过滤,只是液液萃取温度为180℃、固液萃取为100℃,结果见图8和图9。
HHS-1作萃取剂时,固液萃取产物收率高于液液萃取。原因是一方面固液萃取没有完全将MBT粗品颗粒融化,这使得只有颗粒表面杂质溶解,而包裹在内部的一些杂质难以萃取出来,所得到的产物收率偏高。液液萃取得到的产物收率与甲苯固液萃取相差不大,但固液萃取得到的收率明显大于甲苯。对于溶剂HHS-1,无论是固液还是液液萃取,均比甲苯萃取得到的产物熔点高。固液萃取得到的产物的熔点比液液萃取略低,两者熔点相差不到0.2℃。即两种萃取方式得到的产物熔点相差不大,这可能是液液萃取时MBT析出沉降过程中,由于二苯硫脲和苯并噻唑与MBT分子结构类似,表面曲折位置吸附部分杂质[20],使得产物纯度与固液萃取得到的产物相比差别不大。综合考虑,选取固液萃取为MBT粗品精制萃取方式。
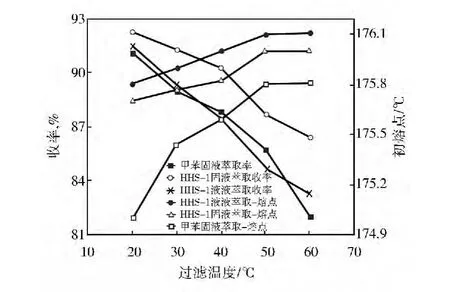
图8 溶剂比2∶1时过滤温度对产物收率和熔点的影响
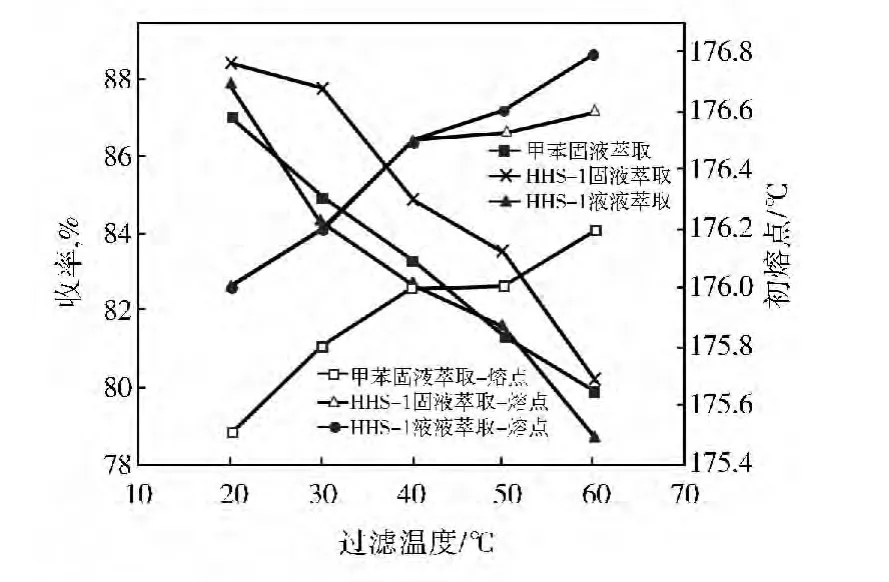
图9 溶剂比3∶1时过滤温度对产物收率和熔点的影响
2.4.3 萃取次数
基于溶剂比过低时冷却后产物凝结现象严重,难以将产物移出进行过滤,最小溶剂比选2∶1。以HHS-1作萃取剂,采用固液萃取方式,将溶剂比4∶1分两次(2∶1)萃取,得到的产物收率及熔点与溶剂比为4∶1萃取一次进行对比,结果见图10。
由图10可以看出:按溶剂比2∶1进行2次萃取,得到的产物收率有所降低,但产物熔点却大大提高(提升0.6~1.0℃)。由于采用固液萃取方式,按溶剂比4∶1一次萃取时,包裹在颗粒中的杂质可能难以与溶剂充分接触而不能被萃取出来,此时若增加萃取次数,不仅可将更多的杂质溶解到溶剂中,也会使得更多的固体颗粒溶解,使这些原先被包裹在颗粒内部的杂质与溶剂相接触,提高萃取率。
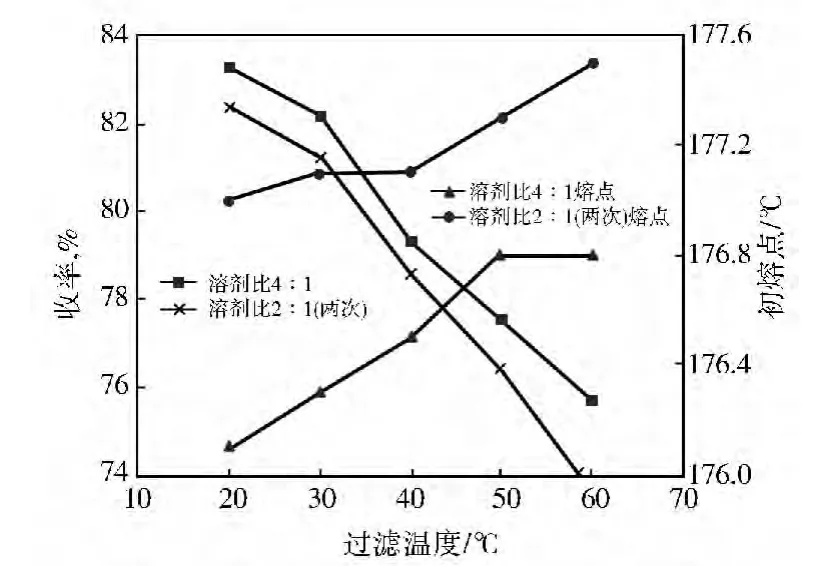
图10 HHS-1溶剂比4∶1萃取一次和溶剂比2∶1萃取次对MBT产率的影响
在采用溶剂比2∶1进行两次萃取后,产物熔点普遍达到了177℃,产物收率有所下降,但收率还是能达到80%以上。因此,对于HHS-1溶剂,宜采用溶剂比2∶1进行两次萃取并在20~35℃进行过滤操作。
2.4.4 产物质量分析
对采用HHS-1溶剂,过滤温度60℃、溶剂比2∶1萃取2次和3次的MBT产物进行了熔点测定和高效液相色谱分析,并与甲苯萃取结果进行比较,结果见表3。
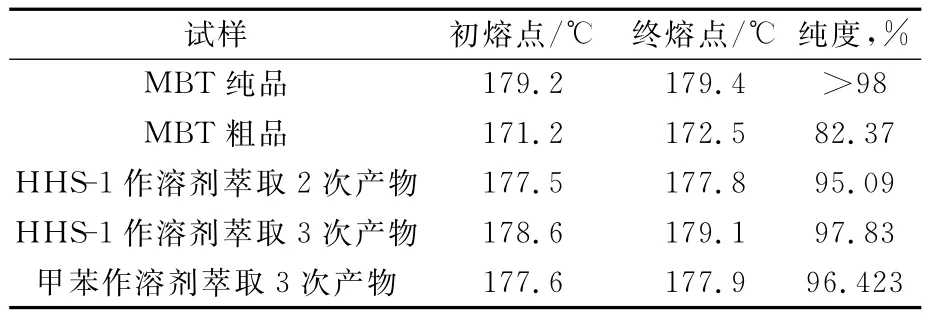
表3 产物熔点和纯度分析
由表3可见:随着萃取次数的增加,产物的初熔点、终熔点明显提高,MBT含量也明显提高。相同条件下,HHS-1作为萃取剂所得产物的熔点和纯度都明显高于甲苯溶剂,说明用HHS-1作萃取剂对MBT精制的效果优于甲苯。
3 结 论
a.通过文献和利用基团贡献法计算得到的一系列溶剂及MBT产物中各组分的溶解度参数,初选出5种MBT精制提纯溶剂,溶解度参数值大小为:SL>HHS-1>二甲苯>甲苯>HHS-2,它们对MBT和二苯硫脲的溶解度大小与其溶解度参数值大小相一致。
b.HHS-1作为MBT提纯萃取剂的效果最佳,它的适宜的萃取工艺条件为:采用固液萃取方式,溶剂比2∶1(2次)、萃取温度100℃下萃取30min、1℃/min降温至20~35℃下过滤。HHS-1可以替代已在工业中使用的甲苯作为工业精制提纯MBT的萃取剂。
[1]周学良,张林栋,朱领地.橡胶助剂[M].北京:化学工业出版社,2002:327-328.
[2]黄君伟,裴文.2-巯基苯并噻唑对天然胶的改性研究[J].化工生产与技术.2010,17(6):18-19.
[3]吕咏梅.橡胶促进剂清洁合成工艺研究进展[J].聚合物与助剂,2007(2):1-6.
[4]Handte,Hofheim am Taunus,Lothar,willlms,et al.Process for the preparation of 2-mercaptobenzothiazole:US,4431813[P].1984-02-14.
[5]范文革.硫化促进剂M萃取精制工艺部分[J].西北民族学院学报:自然科学版,2000,21(34):20-24.
[6]杜孟成,王文博,魏成磊,等.硫化促进剂2-巯基苯并噻唑的纯化工艺:CN,101693701A[P].2010-01-04.
[7]许春华,王传华.中国橡胶助剂工业的清洁生产[M].北京:中国商业出版社,2011.
[8]陈江,陈春光.无废水法生产橡胶硫化促进剂2-巯基苯并噻唑[J].现代化工.2011,31(10):62-66.
[9]杜孟成,马德龙.国内橡胶硫化促进剂MBT的生产技术的进展[C].第十一届全国橡胶工业新材料技术论坛论文集.天津,2013,236-245.
[10]Hildehrand J H,Scott R I.The Solubility of Non-electrolytes[M].3nd Ed.New York:Reinhold,1950.
[11]Hansen C M.The Three Dimensional Solubility Parameter and Solvent Diffusion Coefficient[M].Copenhagen:Danish Technical Press,1967.
[12]高保娇.溶解度参数及其应用[J].山西化工,1998(2):18-20.
[13]刘国杰,黑恩成,史济斌.一个新的溶解度参数[J].化工学报,1994,45(6):665-672.
[14]徐云蕾,俞春芳,黑恩成等.液体内压的预测和新溶解度参数值[J].化工学报,2000,51(3):407-413.
[15]李俊山,孙军,张大龙,等.橡胶配合剂的溶解度参数[J].橡胶参考资料.2007,37(5):28-45.
[16]李俊山,孙军,张大龙.估算橡胶助剂溶解度参数用基团贡献值的研究[J].橡胶工业,1995,42(7):393-396.
[17]欧阳福生,高鹏,李波.溶解度参数法在开发不溶性硫磺新型萃取剂中的应用[J].华东理工大学学报:自然科学版,2010,36(1):25-30.
[18]橡胶工业编写小组.橡胶工业手册:第三分册[M].北京:化学工业出版社,l984.
[19]山西省化工研究所.塑料橡胶加工助剂[M],北京:化学工业出版社,l983.
[20]王美兰.烟碱的提取与纯化[D].无锡:江南大学,2007.

