镉在芙蓉鲤鲫养殖水体中的分布及在鱼体的富集研究
黄华伟,李小玲,刘伶俐,陈湘艺,黄向荣,何志刚,李传武,3
(1. 湖南省水产科学研究所, 湖南 长沙410153; 2. 农业部渔业产品质量监督检验测试中心(长沙), 湖南 长沙410153; 3.湖南省水产原种场, 湖南 长沙410153)
镉是毒性最强的重金属之一,在地壳中丰度较低,但广泛分布于大气、土壤及水体之中。我国土壤的自然镉含量在0.01~1.8 mg/kg 之间,平均值为0.163 mg/kg[1]。近年来,随着工农业三废排放量的增加,加上污水灌溉、肥料施用等因素的影响,使得大量的有毒重金属进入土壤。当前,我国镉污染的耕地面积已达2万hm2,每年生产的镉超标农产品达1.46×109kg,而且呈现出日益加重的趋势[2]。
土壤中的镉具有较强的化学活性,一般不易随水淋滤,不能被土壤微生物所分解,但能被土壤胶体所吸附,并可被水稻等植物吸收和富集,从而通过食物链对人和动物的生命和健康构成严重威胁。镉被人体吸收后,排出非常缓慢,其在人体的半衰期约为16~38 a。而且,镉可在人体内不断积累,对肝脏、肾脏及骨骼系统有较大的毒性[3]。近几年,有关土壤镉污染的修复已成为研究热点。因此,因地制宜、就地利用现有镉污染土地,尤其是在镉稻田产区,调整农业生产结构,开展水产养殖具有重要的社会效益和经济效应。
目前,关于镉对水产动物的毒性效应及其在动物组织中的蓄积研究多集中在水体环境中镉对试验动物的毒性[4-15]及其在组织中的富集和分布规律等方面[16-25],而关于养殖环境下土壤中镉在水产动物体内的富集及其在养殖环境中的分布研究却鲜有报道。笔者在水泥池养殖环境下研究了土壤中镉在芙蓉鲤鲫机体组织中的富集及其在养殖水体和底层土壤环境中的分布,并对芙蓉鲤鲫的食用安全性做了初步探讨,以期为镉污染稻田开展水产养殖提供理论依据和技术支撑。
1 材料与方法
1.1 试验材料
1.1.1 试验对象 试验用芙蓉鲤鲫来自湖南省水产科学研究所鱼类原种场,个体体长为18.25±0.63 cm,个体体重为192.67±23.76 g。试验开始前先暂养一周,选取机体健康、大小规格一致的个体开始正式试验。
1.1.2 供试土壤、水源及饲料 试验用土壤为普通菜园土,取自湖南省水产科学研究所鱼类原种场无污染空地,其理化性状:pH 值6.52,土壤有机质含量为10.34 g/kg,镉含量背景值为0.072 11 mg/kg;其机械组成:<0.002 mm 的颗粒占25%,0.002~0.02 mm 的颗粒占27%,0.02~2 mm 的颗粒占48%。试验用水为普通池塘水,总氮含量0.52 mg/L,总磷含量0.06 mg/L,叶绿素a 含量0.28 mg/L,pH 值6.87,镉含量背景值为0.002 42 mg/L。试验用饲料为通威配合颗粒饲料,镉含量的测定值为0.013 67 mg/kg。
1.1.3 主要仪器及试剂 试验主要仪器有:原子吸收分光光度计(Thermo M SERIES iCE3500);微波消解仪(CEM Mars Xpress),可调式电热板(北京市永光明医疗仪器厂),电子分析天平(沈阳龙腾电子称量仪器有限公司,感量0.000 1 g)。主要试验试剂有:氯化镉(分析纯,天津市科密欧化学试剂有限公司);30%过氧化氢(优级纯,天津市科密欧化学试剂有限公司);盐酸、硝酸、硫酸、氢氟酸、高氯酸、磷酸铵和磷酸氢二铵(优级纯,上海国药集团化学试剂有限公司)。
1.2 试验方法
1.2.1 试验设计 试验在室外水泥池(长5.76 m,宽2.62 m,高0.96 m)中进行,按土壤中外源性镉的添加量不同分为3个试验组,分别为A 组(5 mg/kg)、B 组(50 mg/kg)、C 组(100 mg/kg),再设置一个空白对照组,水泥池底部土壤的铺设厚度为10±1 cm。
1.2.2 试验操作及管理 2014年4月30日,试验开始前,先剔除供试土塘中的杂物,并捣碎成团结块的土壤,使其充分均匀地平铺于水泥池底部,每铺一层土壤后用喷雾机均匀地加入氯化镉溶液,使其充分吸附于供试土塘,铺设完毕待土壤吸附氯化镉溶液2 h后,再缓缓注入供试池塘水体,水泥池水体深度约为0.6 m,静置过夜后于第2 天分别采集水泥池底部的泥样和水体,测定试验初始时刻试验组和对照组水体及底泥中的镉含量。同时,每个水泥池中随机放入芙蓉鲤鲫各60 尾开展正式养殖试验,并测定供试鱼组织中的镉背景值。试验养殖周期为76 d,从2014年5月1日~2014年7月15日,采取静水养殖,期间不换水,每日按鱼体体重的1%投喂配合饲料,并记录水温和水体pH 值。
1.2.3 测定项目及方法 试验开始后,分别于第0、15、30、45、60、75 天采集各试验组水样、泥样及鲫鱼样品。用5.0 L 塑料壶采集水面以下30 cm 处水样,按GB7475-87 中的方法检测水体中镉含量[26];泥样按梅花采样法采集混合样,各点样品等量混合均匀后按四分法弃取,泥样自然风干后,粉碎过20 目尼龙筛,再以四分法弃取,保留100 g 后再次粉碎过100 目尼龙筛,装入自封袋中,按GB/T17141-1997 中的方法测定土壤中镉含量[27]。鲫鱼样品每次采集6~8 尾,分别取其鳞片、鳃、皮肤、背肌、腹肌、肝脏以及肠道组织,捣碎后混匀装入自封袋,按GB/T5009.15-2003 中的方法测定鱼体组织中的镉含量[28]。
2 结果与分析
2.1 养殖池中水体的镉含量变化
在试验水泥池养殖条件下,通过向池底土壤加入不同浓度的外源性镉,注入池塘水体后,由图1 可知,镉在水体中的动态变化表现为:从0~15 d,A 组在试验开始初期和早期含量较高,介于0.005 83~0.006 97 mg/L,均高于渔业水质标准中0.005 mg/L 的镉限量[29];从15~75 d,在中期和后期含量较低,介于0.000 17~0.000 68 mg/L,均低于0.005 mg/L。B 组和C组在试验初期和早期含量较高,分别介于0.129 43~0.157 89 mg/L 和0.173 81~0.245 78 mg/L,均高于0.005 mg/L,试验中期出现回落,而试验后期呈现增高的趋势,且整个试验期间水体中镉含量均高于0.005 mg/L。空白对照组水体中镉含量介于0.001 68~0.003 14 mg/L,相对较为稳定,均低于0.005 mg/L。不同试验组间对比分析可知,随着土壤中镉浓度的增加,养殖水体中的镉含量也随之增加。
2.2 养殖池中底泥的镉含量变化
由图2 可知,在水泥池养殖条件下,镉在底泥中的动态变化表现为:A 组在试验开始初期含量最低,为3.455 76 mg/kg;在随后试验期间介于2.124 35~2.791 71 mg/kg 之间,呈降低的趋势。B 组和C 组,在试验开始初期含量最高,分别为38.285 71 mg/kg 和79.503 70 mg/kg,在随后试验期间含量分别介于20.145 83~27.384 41 mg/kg 和42.281 14~75.436 13 mg/kg,也均呈降低趋势。空白对照组底泥中镉含量介于0.058 26~0.077 96 mg/kg。不同试验组间对比分析可知,随着土壤中镉浓度的增加,养殖池中底泥的镉含量也随之增加。
2.3 养殖芙蓉鲤鲫组织中的镉含量变化
试验期间,养殖水体水温变化范围在22~34℃,pH 值变化范围为6.14~6.87。养殖试验结束后,芙蓉鲤鲫的体长为22.15±0.58 cm,体重为327.33±32.14 g,增重率达68.5%,而且并未出现疾病特征和死亡现象。
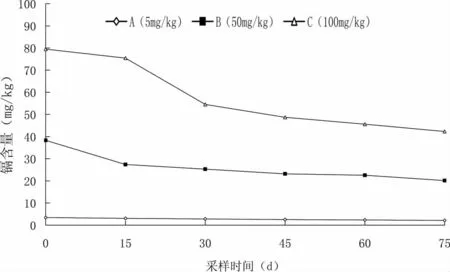
图1 养殖环境中水体镉含量的动态变化

图2 养殖环境中底泥镉含量的动态变化
在试验水泥池养殖环境条件下,镉在芙蓉鲤鲫鳞片中的富集规律见图3。A 组芙蓉鲤鲫鳞片中的镉含量在0.007 33~0.027 73 mg/kg,B 组的镉含量在0.015 76~0.237 88 mg/kg,C 组的镉含量在0.019 16~0.599 16 mg/kg。饲养0~15 d 时,各试验组镉在鱼鳞片中的富集含量最高;饲养15~60 d 时,鱼鳞片中的镉含量逐渐下降;饲养60~75 d 时,镉含量又呈现增加的趋势。不同试验组间对比分析可知,土壤中镉含量越高,芙蓉鲤鲫鳞片中的镉含量也越高。
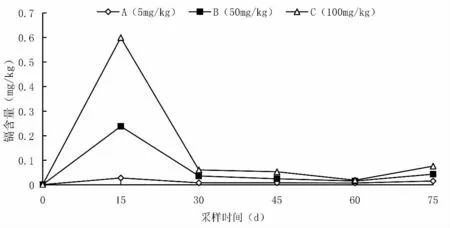
图3 芙蓉鲤鲫鳞片中镉含量的动态变化
镉在芙蓉鲤鲫鳃中的富集规律见图4。A 组芙蓉鲤鲫鳃中的镉含量在0.016 80~0.742 95 mg/kg,B 组的镉含量在0.080 80~0.980 01 mg/kg,C 组的镉含量在0.565 98~1.052 88 mg/kg。饲养0~15 d 时,各试验组镉在鱼鳃中的富集含量最高;饲养15~45 d 时,鱼鳃中镉含量逐渐下降;饲养45~75 d 时,镉含量又呈现增加的趋势。不同试验组间对比分析,土壤中镉含量越高,芙蓉鲤鲫鳃中镉含量也越高。
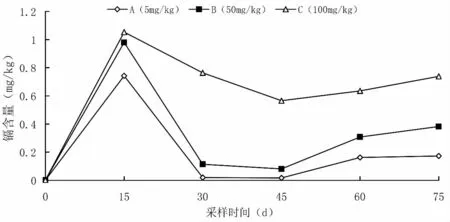
图4 芙蓉鲤鲫鳃中镉含量的动态变化
镉在芙蓉鲤鲫皮肤中的富集规律见图5。A 组芙蓉鲤鲫皮肤中的镉含量在0.004 29~0.011 45 mg/kg,B组的镉含量在0.012 94~0.033 72 mg/kg,C 组的镉含量在0.018 02~0.069 25 mg/kg。饲养0~15 d 时,各试验组镉在皮肤中的富集含量最高;饲养15~60 d 时,皮肤中镉含量逐渐下降;饲养60~75 d 时,镉含量又呈现增加的趋势。不同试验组间对比分析可知,土壤中镉含量越高,芙蓉鲤鲫皮肤中镉含量也越高。

图5 芙蓉鲤鲫皮肤中镉含量的动态变化
镉在芙蓉鲤鲫肌肉中的富集规律见图6 和图7。A 组芙蓉鲤鲫背肌中的镉含量在0.002 22~0.007 28 mg/kg,B 组的镉含量在0.007 94~0.012 95 mg/kg,C组的镉含量在0.010 06~0.041 81 mg/kg;整个试验养殖阶段,芙蓉鲤鲫背肌中的镉含量均低于水产品中镉的限量安全值(0.1 mg/kg)[30]。A 组芙蓉鲤鲫腹肌中镉含量在0.003 46~0.008 12 mg/kg,B 组的镉含量在0.008 02~0.019 47 mg/kg,C 组的镉含量在0.012 53~0.04315mg/kg;整个试验养殖阶段,芙蓉鲤鲫腹肌中镉含量也低于0.1 mg/kg;芙蓉鲤鲫腹部肌肉中镉含量略高于背部肌肉。不同试验组间对比分析可知,土壤中镉含量越高,芙蓉鲤鲫肌肉中镉含量也越高。
镉在芙蓉鲤鲫肝脏中的富集规律见图8。A 组芙蓉鲤鲫肝脏中的镉含量在0.182 29~1.067 81 mg/kg,B组镉含量在0.643 97~2.540 99 mg/kg,C 组镉含量在0.811 35~7.304 47 mg/kg。饲养0~15 d 时,各试验组肝脏中镉含量最高;饲养15~75 d,各试验组肝脏中镉含量呈降低的趋势。不同试验组间对比分析可知,土壤中镉含量越高,芙蓉鲤鲫肝脏中镉含量也越高。

图6 芙蓉鲤鲫背肌中镉含量的动态变化

图7 芙蓉鲤鲫腹肌中镉含量的动态变化
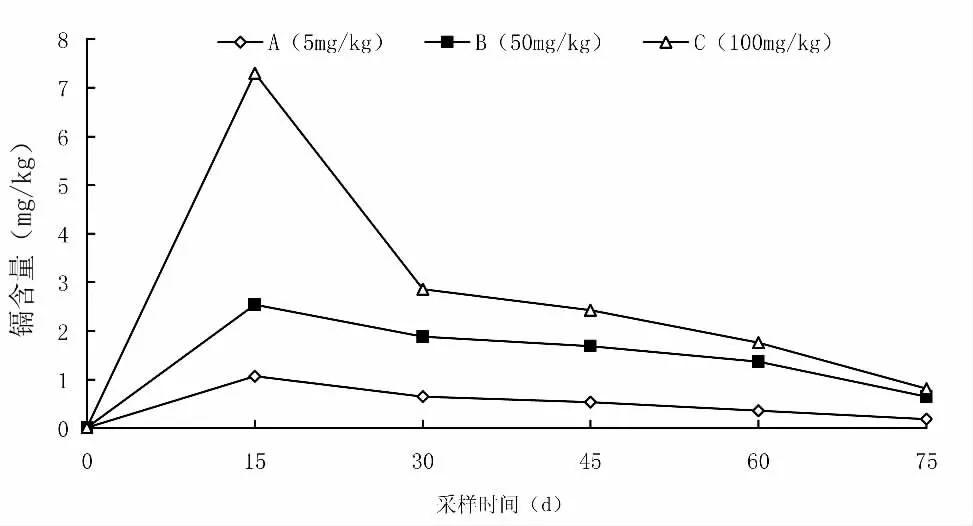
图8 芙蓉鲤鲫肝脏中镉含量的动态变化
镉在芙蓉鲤鲫肠道中的富集规律见图9。A 组芙蓉鲤鲫肠道中的镉含量在0.297 83~5.535 87 mg/kg,B组的镉含量在1.276 69~26.530 14 mg/kg,C 组的镉含量在4.184 42~30.938 16 mg/kg。饲养0~15 d 时,各试验组肠道中的镉含量最高;饲养15~75 d 时,各试验组肠道中镉含量呈降低趋势。不同试验组间对比分析可知,土壤中镉含量越高,芙蓉鲤鲫肠道中镉含量也越高。

图9 芙蓉鲤鲫肠道中镉含量的动态变化
综上所述,养殖试验期间,各试验组芙蓉鲤鲫不同机体组织中镉含量的富集规律表现为:肠道>肝脏>鳃>鳞片>皮肤>腹肌>背肌。
3 结论与讨论
3.1 养殖池中水体的镉含量
在试验水泥池养殖环境条件下,各试验组水体中的镉来源于池底土壤中镉的释放,其含量的高低主要与土壤中外源镉的添加以及芙蓉鲤鲫机体组织的蓄积和排放有关。该试验结果表明,在试验初期和早期,各试验组水体中镉含量较高,A 组水体中镉含量介于0.005 83~0.006 97 mg/L,B 组和C 组镉含量分别介于0.129 43~0.157 89 mg/L 和0.173 81~0.245 78 mg/L,均高于渔业水质标准中0.005 mg/L 的镉限量;在试验中期,水体中的镉含量有所降低,但在试验后期又出现明显升高。这可能与试验初期和早期土壤中外源性镉向水体中的的释放占主导,试验中期水体中镉被芙蓉鲤鲫机体组织所蓄积等有关;而在试验后期水体中镉含量出现明显升高,可能与试验后期池体水位下降,水体容量降低有关。
不同试验组间,随着土壤中镉浓度的增加,养殖水体中的镉含量也呈现递增趋势,且B 组和C 组水体中镉含量在试验期间均明显超过渔业水质标准中0.005 mg/L 的镉限量。这表明水体中镉含量与土壤中外源性镉的添加量呈正相关关系,而且底泥中高浓度的镉可导致养殖水体中镉含量超标,从而污染养殖水体环境。
3.2 养殖池中底泥的镉含量
研究表明,土壤对镉具有较强吸附能力,而且是一个快速过程,95%以上发生在10 m in 之内,1 h 后达到平衡,其吸附率与土壤的类型和特性有关[31]。在试验水泥池养殖环境条件下,各试验组底泥中的镉含量均在试验开始初期最高,分别为3.455 76、38.285 71和79.503 70 mg/kg,而在试验中期和后期逐渐降低,这可能与试验初期底泥中的镉除少量释放于养殖水体中外,大部分被底泥所吸附,而在试验中期和后期,底泥中的镉被芙蓉鲤鲫机体组织所蓄积有关。随着土壤中外源性镉添加量的增加,养殖环境中底泥的镉含量也随之增加,这也表明土壤对镉具有较强吸附能力。
3.3 芙蓉鲤鲫组织中的镉含量
在试验水泥池养殖条件下,芙蓉鲤鲫对镉吸收的主要是通过体表渗透、鳃膜吸附及饵料摄取,镉的蓄积程度取决于其吸收和排放之间的平衡。试验结果表明,各试验组芙蓉鲤鲫鳞片中镉含量均在试验早期最高,而在试验中期出现下降且趋于平稳,在试验后期出现小幅增高,其含量的高低与水体中镉含量的变化趋势基本一致。同时,芙蓉鲤鲫的鳃与养殖水环境直接接触,具有较大的表面积,其鳃膜能对水体中游离的镉离子有直接吸附作用[32],通过鳃的呼吸代谢吸收水体中的镉是鳃中蓄积镉的主要途径,各试验组芙蓉鲤鲫鳃对镉的富集规律表明其含量也与养殖水体中镉含量水平呈正相关关系。另外,各试验组芙蓉鲤鲫皮肤组织中镉含量的变化也与水体中镉含量的变化趋势基本一致,其含量分别介于0.00429~0.01145、0.012 94~0.033 72、0.018 02~0.069 25 mg/kg 之间,均低于水产品镉0.1 mg/kg 的镉限量。此外,芙蓉鲤鲫的腹部肌肉中镉含量总体高于背部肌肉,其肌肉中镉含量一直处于动态变化之中,但也均低于水产品镉0.1mg/kg 的镉限量。这表明试验养殖环境底泥中的高浓度镉并不会对芙蓉鲤鲫可食机体组织造成影响。
研究表明,水体中的镉可以通过呼吸、消化及体表渗透等途径吸收进入水产动物体内[33],随后通过血液循环转运送至鱼体的各个贮存部位,进入机体的镉首先被带到肝肾组织中,而且水产动物体内蓄积的镉绝大部分积累在肝脏和肾脏组织中,约占机体总镉的1/2~2/3[34]。试验结果显示,芙蓉鲤鲫的肝脏是镉蓄积的主要部位,而且在试验早期镉含量即达到最大,在试验中后期有所降低。这表明芙蓉鲤鲫肝脏组织对镉具有一定的解毒能力,镉在芙蓉鲤鲫肝脏中可诱导产生大量络合重金属的金属硫蛋白[35],而且肝脏中过量的镉可经血液循环转移到肾脏排泄[36]或经过肠肝循环从肠道排出体外[37]。
芙蓉鲤鲫为水底层杂食性鱼类,试验养殖环境条件下以人工配合饲料为主要饵料来源,其肠道中的镉多为摄食性带入。对各试验组芙蓉鲤鲫肠道组织中镉含量的测定结果表明,在试验早期肠道镉含量最高,随后也有所下降。这表明试验养殖环境中,芙蓉鲤鲫的肠道组织也是镉蓄积的重要部位,在试验中后期其含量有所降低可能与水温升高,芙蓉鲤鲫的摄食减少,以及养殖环境中底泥的镉含量降低等有关。
试验养殖环境条件下,芙蓉鲤鲫的肝脏、肠道、鳃和鳞片是镉蓄积的主要部位,各试验组芙蓉鲤鲫不同机体组织镉蓄积水平的研究结果表明,其非可食组织中镉含量明显高于可食组织,富集规律表现为:肠道>肝脏>鳃>鳞片>皮肤>腹肌>背肌,这与他人在真鲷、鲤鱼、金鱼、鲫鱼、大菱鲆、泥鳅等中的研究结果基本一致。上述研究结果均表明,水产动物内脏和鳃组织对镉的蓄积水平明显高于肌肉组织,其可食组织是安全的。此外,在克氏原螯虾、栉孔扇贝、文蛤等甲壳类和贝类水产动物中镉积累研究也有相似的结果。芙蓉鲤鲫对镉的生物富积作用是外部生态环境以及自身吸收、代谢和排泄作用的综合表现,镉的蓄积程度取决于吸收和排放之间的平衡,而其机制和机理还有待进一步深入研究。
[1]陈 媛.土壤中镉及镉的赋存形态研究进展[J].广东微量元素科学,2007,14(7):7-12.
[2]赵步洪,张洪熙,奚岭林,等.杂交水稻不同器官镉浓度与累积量[J].中国水稻科学,2006,20(3):306-312.
[3]吴 坚.微量金属对海洋生物的生物化学效应[J].海洋环境科学,1991,10(2):58-62.
[4]陈锡涛.镉对花鲢(Aristichthysnobills)幼鱼、鱼苗和鱼种的急性毒性及其安全浓度的评价[J].环境科学与技术,1991,(4):5-8.
[5]侯丽萍,马广智.镉与锌对草鱼种的急性毒性和联合毒性研究[J].淡水渔业,2002,32(3):44-46.
[6]冯 健,刘永坚,田丽霞,等.草鱼实验性镉中毒对肝胰脏、肾脏和骨骼的影响[J].水产学报,2004,28(2):195-200.
[7]王少博,王维民,郭亚楠,等.重金属镉和铬对草鱼苗的急性和慢性毒性效应[J].兰州大学学报(自然科学版),2007,43(4):60-64.
[8]贾秀英.镉对泥鳅幼鱼的急性和亚急性毒性研究[J].环境污染与防治,2001,23(5):227-228.
[9]王瑞龙,马广智,方展强.铜、镉、锌对唐鱼的急性毒性及安全浓度评价[J].水产科学,2006,25(3):117-120.
[10]陈朝阳,谢进金,卓丽娜.镉对金鱼的急性毒性研究[J].泉州师范学院学报(自然科学版),2006,24(6):104-107.
[11]刘亚杰,王笑月.锌、铜、铅、镉金属离子对海湾扇贝稚贝的急性毒性试验[J].水产科学,1995,14(1):10-12.
[12]隋国斌,杨 凤,孙丕海,等.铅、镉、汞对皱纹盘鲍幼鲍的急性毒性试验[J].大连水产学院学报,1999,14(1):22-26.
[13]高淑英,周栋梁,厉红梅.汞、镉、锌和锰对日本对虾仔虾的急性毒性[J].海洋通报,1999,18(2):93-96.
[14]臧维玲,戴习玲,江 敏,等.Cu2+和Cd2+对斑节对虾幼虾的毒性作用[J].水产科技情报,2001,28(5):198-201.
[15]王 茜,王 兰,席玉英,等.镉对长江华溪蟹的急性毒性与积累[J].山西大学学报,2003,26(2):176-178.
[16]马 健.鲤鱼对食物及水中镉的摄取及在组织中的分配[J].国外环境科学技术,1997,(2):21-24
[17]戴家银,郑微云,洪丽玉,等.铜、铅、镉在真鲷幼鱼组织的积累与分布[J].海洋科学,1997,(6):8-9.
[18]孟晓红,贾 瑛,付超然.重金属稀土元素污染在水生物体内的生物富集[J].农业环境保护,2000,19(1):50-52.
[19]刘长发,陶 澍,龙爱民.金鱼对铅和镉的吸收蓄积[J].水生生物学报,2001,25(4):244-249.
[20]方展强,杨丽华.重金属在鲫幼鱼组织中的积累与分布[J].水利渔业,2004,24(6):23-26.
[21]翟毓秀,杨学松,宁劲松,等.镉在大菱鲆体内蓄积规律及对生长和食品安全影响初探[J].海洋水产研究,2005,26(4):26-31.
[22]吕雪飞,邓玉林,周群芳.镉在雄性泥鳅体内的富集分布[J].化学通报,2010,(10):932-937.
[23]朱玉芳,崔勇华,戈志强,等.重金属元素在克氏原螯虾体内的生物富集作用[J].水利渔业,2003,23(1):11-12.
[24]王 凡,赵元风,吴益春,等.栉孔扇贝对Cd的积累和排出[J].湛江海洋大学学报,2005,25(4):95-98.
[25]陈细香,吴文杰,陈月琴.重金属镉在文蛤体内的富集和消除研究[J].安徽农业科学,2013,41(26):10653-10656.
[26]GB7475-87.水质铜、锌、铅、镉的测定.原子吸收分光光度法[S].
[27]GB/T17141-1997.土壤质量铅、镉的测定石墨炉原子吸收分光光度法[S].
[28]GB/T5009.15-2003.食品中镉的测定[S].
[29]GB11607-89.渔业水质标准[S].
[30]GB2762-2005.食品中污染物限量[S].
[31]刘育红.土壤镉污染的产生及治理方法[J].青海大学学报(自然科学版),2006,24(2):75-79.
[32]Gordon K P.Gill surface interaction model for tracemetal toxicity to fish:Role of complexion,pH and water hardness[J].Environmental Science&Technology,1983,17:342-347.
[33]Rainbow P S,White S L.Comparative strategies of heavy metal accumulation by crustaceans:zinc,copper and cadmium in a decapod,an amphipod and abarnacle[J].Hydrobiologia,1989,174(3):245-262.
[34]McGeer JC,Szebedinszky C,McDonald D G,et al.Effects of chronic sublethalexposure towaterborneCu,Cd,or Zn in rainbow trout2:tissue specificmetalaccumulation[J].Aquatic Toxicology,2000,50:245-256.
[35]Allen P.Soft-tissue accumulation of lead in the blue tilapia,Oreochromis aureus(steindachner),and the modifying effects of cadmium and mercury[J].Biological Trace Element research,1995,50(3):193-208.
[36]Cinier C C,Ramel M P,Faure R,et al.Cadmium bioaccumulation in carp(Cyprinus carpio)tissuesduring long-term high exposure:analysis by inductively coupled plasma-mass spectrometry[J].Ecotoxicology and EnvironmentalSafety,1997,38(2):137-143.
[37]KraalM H,Kraak M H S,GrootC J,etal.Uptakeand tissue distribution of dietary and aqueous cadmium by carp(Cyprinus carpio)[J].Ecotoxicology and EnvironmentalSafety,1995,31(2):179-183.

