金属氧化物掺杂TiO2光氧双重降解室内甲醛
杨大伟,魏 鑫,王传宇,吕继祥,毕 然
(1.大连工业大学轻工与化学工程学院,辽宁大连 116034;2.大连工业大学纺织与材料工程学院,辽宁大连 116034)
金属氧化物掺杂TiO2光氧双重降解室内甲醛
杨大伟1,魏鑫2,王传宇2,吕继祥1,毕然1
(1.大连工业大学轻工与化学工程学院,辽宁大连116034;2.大连工业大学纺织与材料工程学院,辽宁大连116034)
采用浸渍-沉淀的方法制备第六副族金属氧化物三氧化钼(MoO3)、三氧化铬(CrO3)、三氧化钨(WO3)及三氧化钕(NdO3)掺杂二氧化钛(TiO2)的甲醛降解剂,将所制备的甲醛降解剂用于降解室内甲醛。通过紫外-可见分光光度计(UV-vis)、X射线衍射(XRD)、氮气吸附-脱附、吡啶原位红外、氨气程序升温脱附对甲醛降解剂进行测试与表征。实验结果表明:第六副族金属氧化物掺杂后的甲醛降解剂的降解效率均比纯TiO2高,并且掺杂后的甲醛降解剂吸收光谱的阀值波长发生红移。其中TiO2-MoO3具有最高的降解率,达到40.5%,吡啶原位红外测试表明TiO2-MoO3既有B酸中心又有L酸中心,氨气程序升温脱附测试表明TiO2-MoO3的酸强度相对较强。所制备的甲醛降解剂具有光、氧双重降解甲醛的效果。
TiO2;光催化;甲醛降解;第六副族金属氧化物
0 引 言
甲醛作为主要的室内空气污染物,广泛存在于新型建材及家居产品中[1]。吸入甲醛气体会增加人们患眼癌、皮肤癌等风险[2]。因此,降低甲醛含量以改善室内空气质量对保护人类的健康十分重要。TiO2由于具有无毒、化学性质稳定、价廉等特点,作为甲醛降解剂广泛地应用在降解甲醛中[35]。但纯TiO2由于禁带宽度只有3.2eV[6],只能在紫外光的照射激发下才能产生光催化效应,对自然光的利用率很低,因此在降解甲醛过程中并没有很高的降解率[7]。为了决解决上述问题,需对二氧化钛进行改性,如对TiO2的表面进行修饰[8]来提高TiO2的光催化效率。作者制备了第六副族金属氧化物MoO3、CrO3、WO3及NdO3掺杂TiO2的甲醛降解剂降解室内甲醛,考察了不同的甲醛降解剂分别在紫外、自然光、黑暗条件下降解甲醛的效果。
1 实 验
1.1试剂与仪器
主要试剂:四氯化钛;硫酸;钼酸铵;氧化铬;磷钨酸;硝酸钕;甲醛。
主要仪器:XRD-6100型X射线衍射仪,北京众和创业科技发展有限责任公司;JW-BK222型静态氮气吸附仪,北京精微高博科学技术有限公司;EQUINOX55型红外光谱仪,德国布鲁克公司;氨气程序升温脱附仪,大连理工大学;88-1型磁力搅拌器,常州市博瑞仪器制造厂;远红外快速干燥箱,上海三星电热仪器厂;SX-2.5-10型箱式电阻炉,上海跃进医疗器械厂。
1.2甲醛降解剂的制备
甲醛降解剂(TiO2-MO3,其中MO3分别代表第六副族金属氧化物CrO3、MoO3、WO3、NdO3)通过浸渍-沉淀的方法制得。将0.5mol的四氯化钛溶于200g去离子水中,25℃条件下滴加氨水,调节pH至10。在20℃下沉降20h,减压过滤。用去离子水洗涤滤饼至不含氯离子(氯离子可以用硝酸银溶液检测)。将滤饼用远红外快速干燥箱在100℃下干燥至恒重。研细、过200目筛,得到白色氢氧化钛粉末。在50mL的小烧杯中加入10mL浓度为1mol/L的硫酸,将TiO2与MO3按照摩尔比为5∶1加到硫酸中,浸渍4h,减压过滤、在110℃的干燥至恒重550℃焙烧3h。所得的产物为甲醛降解剂TiO2-MO3。
1.3降解甲醛实验方法
降解甲醛实验方法:在30cm×30cm× 30cm的密闭容器中加入2g甲醛降解剂。用刮板将甲醛降解剂刮成约35cm2的薄层。将5mL的甲醛气体注入密闭容器中。在密闭容器中放置循环风机,开启风机使甲醛气体分散均匀。在自然光下每2h取一个空气样本,按国标GB/T 15516—1995用乙酰丙酮分光光度法测甲醛含量。选取降解效果最好的甲醛降解剂,分别在自然光、紫外光、黑暗条件下测甲醛降解率。
2 结果与讨论
2.1甲醛降解剂降解甲醛的效率
所制备的甲醛降解剂在自然光的条件下,随着光照时间的不同,降解甲醛的效率见图1。
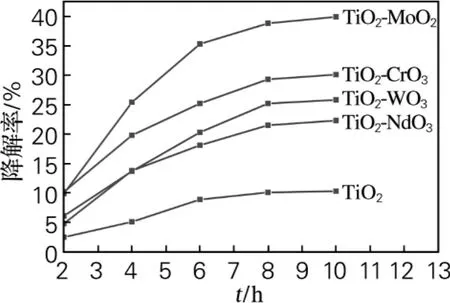
图1 自然光下光照时间对甲醛降解率的影响Fig.1 The effect of degradation rate of formaldehyde on illumination time under natural light
图1分别为甲醛降解剂纯TiO2及TiO2-CrO3、TiO2-MoO3、TiO2-WO3、TiO2-NdO3在自然光条件下对甲醛气体的降解率。甲醛的初始浓度为0.25mg/L。从图1中可以看出自然光条件下10h后,甲醛降解剂经过第六副族金属氧化物掺杂的甲醛降解剂其催化效率高于纯TiO2,其中甲醛降解剂TiO2-MoO3降解甲醛的效率最高,达到40.5%,而未经掺杂的甲醛降解剂纯TiO2的降解率只有10.3%,甲醛降解剂TiO2-MoO3的降解效率是纯TiO2的近4倍。
不同光照条件下甲醛降解剂TiO2-MoO3的降解率见表1。

表1 TiO2-MoO3对甲醛的降解率Tab.1 Formaldehyde degradation rates of TiO2-MoO3
由表1可以看出,TiO2-MoO3对甲醛有催化降解效果。其中,紫外光条件下的降解效率最高,这是因为紫外光能使TiO2价带中的电子激发到导带,在导带形成高活性的电子,同时在价带产生一个带正电的空穴,高活性的电子和空穴具有很高的催化活性,能使甲醛氧化降解。在黑暗的条件下,没有光照射到TiO2的表面,不能使价带电子跃迁到导带,没有能够产生使甲醛降解的活性电子与空穴,此时甲醛不能被光催化降解。黑暗中甲醛发生降解的原因是TiO2-MoO3表面与H2SO4在焙烧过程中,形成了B酸、L酸中心,酸性中心的存在可使甲醛氧化降解。
2.2UV-vis吸收光谱分析
在300~800nm波长下的紫外可见光谱见图2。结果表明相较于未经掺杂的甲醛降解剂TiO2,经过MoO3掺杂过的甲醛降解剂在紫外区域有很强的吸收峰。
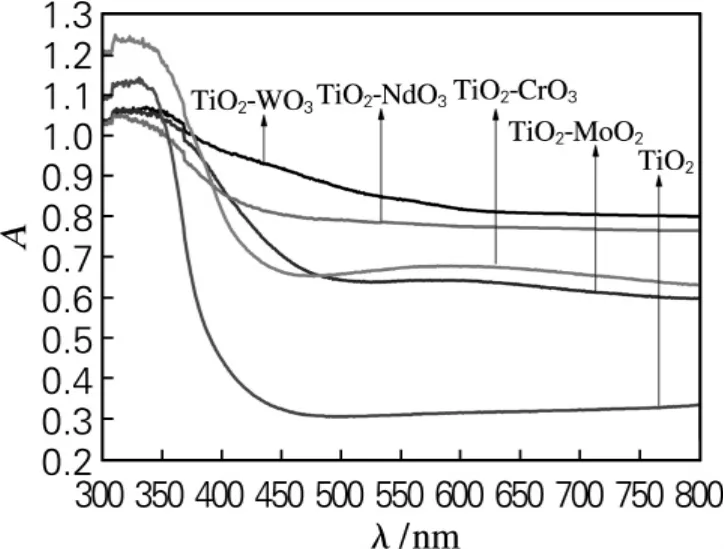
图2 甲醛降解剂的紫外-可见分光光谱图Fig.2 UV visible spectrophotometer spectra of formaldehyde degradation agents
未经掺杂的甲醛降解剂TiO2的吸收边缘为390nm,具有3.18eV的带隙能量。甲醛降解剂TiO2-MoO3的吸收边缘为730nm,具有1.69eV的带隙能量。甲醛降解剂TiO2-WO3、TiO2-NdO3、TiO2-CrO3的吸收边缘为590、480、680nm,对应的带隙能量为2.10、2.58、1.82eV。由此可见,掺杂后的甲醛降解剂的吸收边缘都大于未经掺杂的甲醛降解剂纯TiO2,说明掺杂后能够在接近自然光的范围吸收光,而未经掺杂的甲醛降解剂纯TiO2只能在紫外光条件下才能光催化降解。结果表明:经过第六副族金属氧化物掺杂后,能更好地吸收可见光,在自然光下的催化降解。其中TiO2-MoO3降解甲醛的效率最高。
2.3甲醛降解剂的XRD谱图
图3为甲醛降解剂TiO2-CrO3、TiO2-WO3、TiO2-NdO3及TiO2-MoO3在550℃煅烧后的XRD谱图。由XRD谱图中可以看出,所制备的甲醛降解剂中的TiO2的晶型是锐钛矿和金红石型的混合,第六副族金属氧化物的加入使得TiO2的结晶程度发生了变化,TiO2-MoO3中位于25°左右的TiO2的结晶程度要好于TiO2-NdO3、TiO2-WO3及TiO2-CrO3。

图3 甲醛降解剂的XRD谱图Fig.3 XRD patterns of formaldehyde degradation agents
2.4甲醛降解剂的结构特性
甲醛降解剂的结构特性由氮气吸附-脱附在77K条件下测得,甲醛降解剂的比表面积、孔体积及平均孔径见表2。
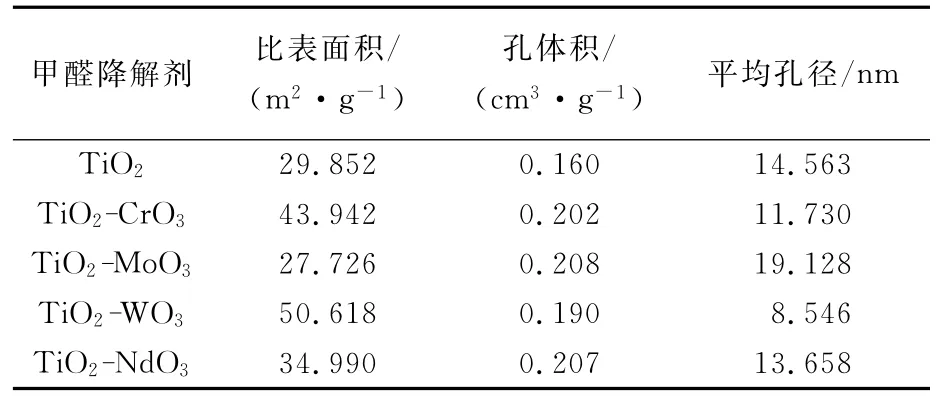
表2 甲醛降解剂的结构性质Tab.2 Structure of the formaldehyde degradation agents
由表2可以看出,甲醛降解剂的比表面积的范围在27.726~50.618m2/g,孔体积在0.160~0.208cm3/g、平均孔径在8.546~19.128nm。其中,TiO2-WO3的比表面积最大,为50.618m2/g,TiO2-MoO3的孔体积及平均孔径最大,分别为0.208cm3/g、19.128nm。
2.5TiO2-MoO3的酸性表征
甲醛降解剂TiO2-MoO3的酸性可以通过吡啶原位红外光谱及氨气程序升温脱附联合表征。
2.5.1TiO2-MoO3的吡啶原位红外光谱分析
甲醛降解剂TiO2-MoO3的酸性中心可以通过吡啶原位红外光谱测得,TiO2-MoO3的吡啶原位红外光谱见图4。从图4中可以看出甲醛降解剂TiO2-MoO3既存在B酸中心、L酸中心,又存在B酸中心与L酸中心的混合。1538cm-1处为吡啶与B酸中心结合产生的特征峰,1488cm-1处出现的特征峰为B和L酸结合的特征峰,1447cm-1处出现的特征峰为吡啶与L酸中心相结合产生的特征峰[8]。
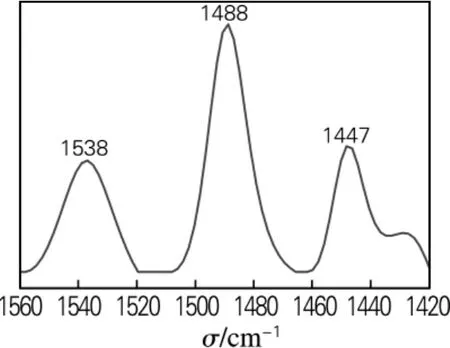
图4 甲醛降解剂TiO2-MoO3吡啶原位红外光谱Fig.4 FT-IR spectra of adsorbed pyridine on the formaldehyde degradation agent TiO2-MoO3
2.5.2TiO2-MoO3的氨气程序升温脱附分析
甲醛降解剂TiO2-MoO3的酸强度可以通过氨气程序升温脱附测得,TiO2-MoO3的氨气程序升温脱附见图5。
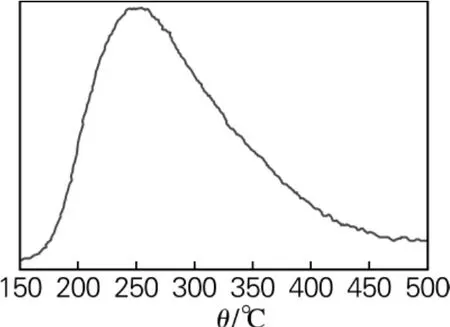
图5 甲醛降解剂TiO2-MoO3的氨气程序升温脱附Fig.5 NH3-TPD spectra of the formaldehyde degradation agent TiO2-MoO3
图5中峰的位置能够反映出酸的强度,峰的面积可以反映出总酸量的大小。TiO2-MoO3在250℃附近出现了明显的特征峰,说明所制备的降解剂具有中等强度酸性。
3 结 论
用浸渍-沉淀的方法制备了第六副族金属氧化物掺杂TiO2的甲醛降解剂TiO2-CrO3、TiO2-MoO3、TiO2-WO3及TiO2-NdO3,将其用于氧化催化降解甲醛。研究结果表明,掺杂之后的降解剂有更高的降解效率,其中,TiO2-MoO3降解效率最高,达到40.5%。降解剂在紫外条件下降解效率最高,通过在自然光、黑暗条件下的对比可知,在黑暗条件下存在降解效率是降解剂氧化催化的结果。所制备的降解剂具有光氧双重催化氧化室内甲醛的效果。
[1]KHANMMOHAMMADIM,GARMARUDIAB,ELMIZADEHH,etal.Spectrophotometricevaluationofthephotocatalyticdegradationofformaldehyde byFe2O3-TiO2nanohybrid[J].JournalofIndustrial andEngineeringChemistry,2014,20(4):1841-1844.
[2]ZHANGGaoke,QINXi.Efficientphotocatalytic degradationofgaseousformaldehydebytheTiO2/tourmalinecomposites[J].MaterialsResearchBulletin,2013,48(10):3743-3749.
[3]LEIGe,XUMing-xia,FANGHai-bo.Photocatalyticdegradationofmethylorangeandformaldehydeby Ag/InVO4-TiO2thinfilmsundervisible-lightirradiation[J].JournalofMolecularcatalysisA:Chemical,2006,258(1/2):68-76.
[4]ZENGLei,SONGWu-lin,LIMinghui,etal.CatalyticoxidationofformaldehydeonsurfaceofH-TiO2/H-C-TiO2withoutlightilluminationatroomtemperature[J].AppliedCatalysisB:Environmental,2014,147:490-498.
[5]ZHAGNXin,LIUQing-qing.Visible-light-induced degradationofformaldehydeovertitaniaphotocatalyst co-dopedwithnitrogenandnickel[J].AppliedSurfaceScience,2008,254(15):4780-4785.
[6]YANGLiping,LIUZhengyan,SHIJianwei,etal.DegradationofindoorgaseousformaldehydebyhybridVUVandTiO2/UVprocesses[J].Separation andPurificationTechnology,2007,54(2):204-211.
[7]AKBARZADEHR,UMBARKARSB,SONAWANERS,etal.Vanadia-titaniathinfilmsfor photocatalyticdegradationofformaldehydeinsunlight
[J].AppliedCatalysisA:General,2010,374(1/2):103-109.
[8]MAXin-bin,WANGSheng-ping,GONGJin-long,etal.AcomparativestudyofsupportedTiO2catalystsandactivityinesterexchangebetweendimethyl oxalateandphenol[J].JournalofMolecularCatalysis,2004,222(1/2):183-187.
DoubledegradationofindoorformaldehydewithTiO2doped withmetaloxidephotocatalysis-oxygen
YANGDawei1,WEIXin2,WANGChuanyu2,LYUJixiang1,BIRan1
(1.SchoolofLightIndustryandChemicalEngineering,DalianPolytechnicUniversity,Dalian116034,China;2.SchoolofTextileandMaterialEngineering,DalianPolytechnicUniversity,Dalian116034,China)
Theformaldehydedegradationagentstitania(TiO2)copedwithmolybdenumtrioxide(MoO3),chromiumtrioxide(CrO3),tungstentrioxide(WO3)werepreparedbythe impregnation-precipitationmethodandusedfordegradationofindoorformaldehyde.The formaldehydedegradationagentsweretestedandcharacterizedbyUV-visiblespectrophotometer(UV-vis),Xraydiffraction(XRD),nitrogenadsorption-desorption,pyridine-situFT-IRand ammoniatemperatureprogrammeddesorption.Theresultsshowedthatthedegradationefficiencyof TiO2dopedwiththesixthsub-groupmetaloxideswerehigherthanthatofthepureTiO2,inwhich thresholdwavelengthabsorptionspectrumoftheformaldehydedegradationagentredshiftafter doped.TiO2-MoO3hasthehighestdegradationrateat40.5%amongtheseformaldehydedegradation agents.Thepyridine-situFT-IRshowedthatTiO2-MoO3hadbothBacidsitesandLacidsites.The ammoniatemperatureprogrammeddesorptionshowedthattheacidstrengthofTiO2-MoO3was relativelystrong.Thepreparedformaldehydedegradationagentshavephotocatalysis,oxygen,doubleeffectofdegradationofformaldehyde.
TiO2;photocatalysis;formaldehydedegradation;sixthsubgroup metaloxide
TQ134.1
A
1674-1404(2015)02-0118-04
2014-03-31.
杨大伟(1970-),男,副教授,E-mail:yangdw@dlpu.edu.cn.

