齐墩果酸通过TGR5调节肥胖小鼠体内糖脂代谢的实验研究
陈小松,闫 柳,郭志辉,李 铭,黄楚珊
(福建医科大学附属协和医院整形外科福建福州350001)
·基础研究·
齐墩果酸通过TGR5调节肥胖小鼠体内糖脂代谢的实验研究
陈小松,闫柳,郭志辉,李铭,黄楚珊
(福建医科大学附属协和医院整形外科福建福州350001)
目的:本研究通过建立肥胖小鼠的动物模型,探索天然植物药齐墩果酸OA是否通过褐色脂肪中高表达的TGR5受体调节能量代谢,消耗能量达到减肥效果及其作用的机制。方法:取8~10周龄野生型与TGR5-/-两组小鼠分别给予普通或高脂饮食。8周后,高脂饮食小鼠随机分为两组,一组继续喂饲高脂饮食,另一组改以HFD+OA继续喂养8周。共喂养16周后进行糖耐量实验,并取肝脏脂肪组织做病理学观察,RT-PCR检测肝脏糖代谢相关基因的表达。喂养过程中监测小鼠体重。结果:TGR5激活可调节OA诱导的减肥效应,并增强肥胖小鼠胰岛素敏感性、降低血糖,减少肝脏组织脂质沉积,下调肝脏糖异生代谢酶相关基因的表达。结论:OA可明显减少后天性肥胖小鼠体内脂质堆积,减轻肥胖小鼠体重,调节糖代谢,其作用是通过激活胆汁酸膜受体TGR5实现的。
TGR5;齐墩果酸;肥胖;糖脂代谢;TGR5-/-鼠
随着人类生活方式的改变,肥胖的患病率日益增高,与之而来的高血压、高血脂、糖尿病等多种代谢性疾病,更是严重威胁人类健康[1]。引起肥胖的因素众多,如何有效控制体重,减少相关并发症的发生,成为人们关注的热点话题[2]。最近,研究将胆汁酸信号分子作为治疗代谢紊乱的新靶标加以强调,包括肥胖与2型糖尿病的治疗[3]。TGR5(G proteincoupled receptor for bile acids,TGR5)作为胆汁酸膜受体,对糖脂代谢具有重要的调控作用。TGR5在褐色脂肪组织(brown adipose tissue,BAT)中表达、以及近来关于成人体内褐色脂肪组织的阐述提示了一种潜在的抗肥胖方法,即以TGR5作为靶受体来增加产热[4]。TGR5在褐色脂肪(BAT)中的线粒体上高表达,通过胆酸-TGR5-CAMP-D2-T3-UCP通路导致三磷酸腺苷(adenosine triphosphate,ATP)合成降低,从而调节能量代谢的动态平衡达到减肥效果[5]。齐墩果酸OA(oleanolic acid,OA)来源于木犀科植物齐墩果(又称油橄榄)叶,具有护肝降酶效用[6]。OA是TGR5天然植物配体,可使高脂饮食的动物体重下降,能提高糖耐[7],但与TGR5关系不清楚。这里笔者将探讨天然化合物OA在调节糖脂代谢过程中TGR5的必要性。
1 材料和方法
1.1实验动物
选取8~10周龄C57BL/6J与TGR5-/-(TGR5 konckout,TGR5-/-)小鼠(由福建医科大学实验动物中心提供)作为研究对象。小鼠于SPF环境饲养,12h光照/12h黑暗交替,自由饮食及饮水。野生型与TGR5-/-小鼠各随机分为3组:对照组(N)、高脂饮食组(HFD)及高脂饮食+齐墩果酸组(HFD+OA),每组5只。喂养周期为16周。给药周期为后8周。基础饲料为标准颗粒,高脂饲料由60%的普通饲料,加入8%的熟猪油、20%的白砂糖和10%的蛋黄粉,2%胆固醇组成。普通饲料能量组成脂肪10%,蛋白质22%,碳水化合物60%,其他8%;高脂饲料能量组成脂肪40%,蛋白质13%,碳水化合物40%,其他7%。HFD+OA组在高脂饲料喂养8周后,按照10mg/kg小鼠体重的剂量在饲料中参入OA继续喂养8周,共喂养16周。喂养过程中每周检测小鼠体重。喂养结束后,采小鼠尾血进行葡萄糖耐量实验(glucose tolerance test,GTT),取小鼠腹腔内脂肪组织称重,取肝脏组织提取RNA进行Real time PCR分析,部分肝脏经10%福尔马林固定后进行HE染色。
1.2小鼠腹腔白色脂肪的分离
处死小鼠后,仔细分离出小鼠腹腔内的全部白色脂肪,并称重,以此代表小鼠体内脂肪重量。
1.3组织学观察
肝组织以10%福尔马林固定,而后脱水、浸蜡、切片,常规苏木精-伊红染色然后进行标准组织学学观察。
1.4代谢评估
小鼠过夜禁食16h后腹腔注射D-葡萄糖(2g/ kg体重)进行GTT实验。分别于注射前、注射后15min、30min、60min、90min及120min采集小鼠尾静脉血液,通过便携式血糖仪检测血糖浓度。
1.5RT-PCR
根据产品说明书用TRⅠ试剂提取总RNAs。通过SuperScript第一链合成系统用2µg合成cDNA,以cDNA为模板,加入特异性引物和2Xsyb Green,通过Applied Biosystem 7300 RT-PCR系统对mRNA进行扩增。按照两步法标准PCR扩增程序进行反应:95℃30s预变性,95℃5s~60℃34s并循环40次,95℃15s,60℃1 min,95℃15s。引物设计如下:
M36b4-F:5’-GCCCTGCACTCGCTTTCT-3’,
M36b4-R:5’-CAACYGGGCACCGAGGCAACAGTTG-3’;
G6pc-F:5’-TTCCCCACCAGGTCGTGGCT-3’,
G6pc-R:5’-GGTGGACCCATTCTGGCCGC-3’;
Pck1-F:5’-TGCACTCTGTGGGGTGCCCT-3’,
Pck1-R:5’-TCTCTGCGGTCCGGGAGGTG-3’;
Pdk4-F:5’-TGAAGGCAGCCCGCTTCGTG-3’,
Pdk4-R:5’-GGGCAGCTCTTGCCGCAGAA-3’。
结果分析:利用Applied Biosystem软件绘制标准曲线对每一个检测基因及内参基因M36b4定量进行统计分析。
1.6数据分析
数据采用x±s表示。无特殊说明时,通过双边t检验分析组间是否有显著差异。
2 结果
2.1TGR5激活可调节OA诱导的减肥效应
OA是从橄榄叶中提取的三萜类化合物。在体外能够激活TGR5,从而控制小鼠体重[7]。然而,TGR5是否是体内OA调节代谢的受体尚不清楚。通过喂养过程中监测小鼠体重笔者发现,无论是野生型小鼠还是TGR5-/-小鼠,经高脂喂养后体重均明显上升,而给予OA干预后,可减少动物体重(图1)。与高脂组相比,OA喂养第8周时可显著减少动物体重(图2)。而在TGR5-/-组,OA的减肥作用明显受到抑制(图2)。喂养第16周时,实验终止,测小鼠体重予以对比。对于野生型小鼠来说,给予OA干预,动物体重可下降至普通饮食组水平。然而,尽管OA能够显著减少TGR5-/-组高脂饮食组小鼠体重,但与普通饮食组仍存在较大差异(图2)。这些结果明确指出TGR5能够调节OA诱导的减肥效应。
2.2TGR5激活可提高肥胖小鼠糖耐量水平
OA可降低实验小鼠的高血糖[7]。为了鉴定OA的降血糖效应是否通过TGR5的激活实现,在喂养结束后,笔者对比了野生组与TGR5-/-组小鼠的糖耐量。结果显示,两组小鼠经HFD喂养均引起糖耐量增高,血糖在空腹及腹腔注射葡萄糖后各个时间点,HFD组血糖值均高于对照组,且在15、30、60、120min时有显著差异。而经过OA治疗,可显著提高野生组小鼠、而非TGR5-/-的糖耐量(图3),表明OA提高糖耐具有TGR5依赖性。

图1 喂养结束后各组小鼠照片
2.3TGR5激活可减轻肝脏组织脂质沉积
喂养结束,取小鼠肝脏组织制作石蜡切片,常规HE染色后镜检观察,与对照组肝脏组织相比,无论是野生型还是TGR5-/-小鼠,HFD组小鼠肝细胞肿大,肝组织中可见多个脂肪空泡。给予OA干预后,野生组小鼠肝脏组织脂肪空泡明显减少,脂质沉积减少,并可观察到部分肝细胞形态恢复正常。而TGR5-/-小鼠在经OA治疗后,肝组织仍有较多脂肪空泡(图4),说明OA对肝脏脂质代谢的调节是通过激活TGR5实现的。
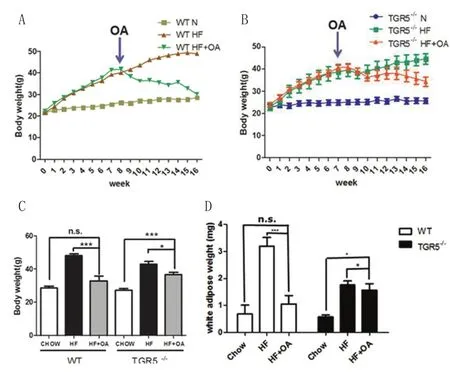
图2 TGR5调节OA抗肥胖效应
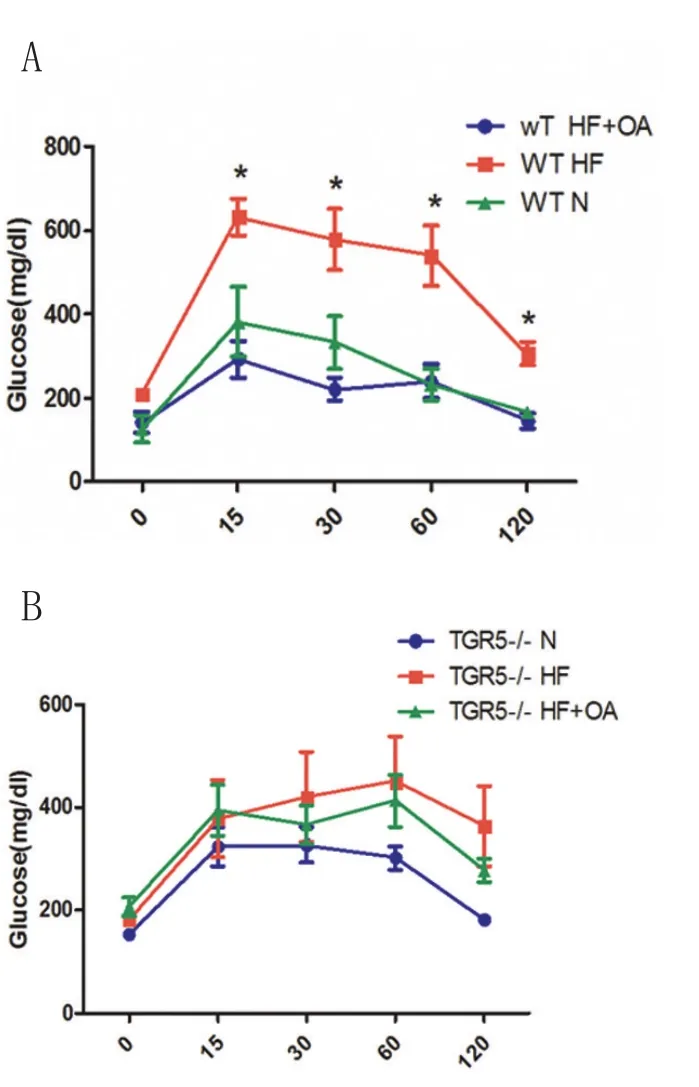
图3 TGR5调节OA提高糖耐量效应
2.4TGR5可调节肝脏糖代谢相关基因的表达
葡萄糖-6-磷酸酶(glucose-6-phosphatase,G6pc)、磷酸烯醇式丙酮酸羧化酶1(phosphoenolpyruvate carboxykinase 1,Pck1)和丙酮酸脱氢酶激酶4(pyruvate dehydrogenase kinase 4,Pdk4)为调节糖异生代谢的三个关键酶。笔者检测了这些关键酶在小鼠肝脏的表达水平,野生型小鼠在给予高脂饮食后,三个关键酶的mRNA水平均有增加,其中G6pc的转录显著增加,Pck1与Pdk4的mRNA表达虽无显著统计学差异,但具有跟G6pc相同的变化趋势。在经过OA干预后,这三种关键酶的mRNA表达水平均明显降低。而在TGR5-/-小鼠,HFD组小鼠肝脏G6pc、Pck1的mRNA表达水平增加,Pdk4的mRNA水平则低于对照组。OA干预后,三种关键酶的mRNA表达水平未见下降,G6pc的mRNA表达水平甚至略有升高(图5)。这些结果表明TGR5对于OA调节肝脏糖代谢相关基因的表达是必要的。

图4 TGR5激活可减轻肝脏组织脂质沉积

图5 RT-PCR检测肝脏相关基因表达
3 讨论
过度肥胖是一种疾病,不仅影响形体美感,更是导致众多疾病的温床。而安全有效的减肥药的匮乏,严重制约了对肥胖的治疗,以致肥胖的患病率快速增长,成为世界性公共卫生问题[8]。
TGR5是G蛋白偶联受体,同法尼酯X受体(farnesoid X receptor,FXR)一样属胆汁酸受体,在许多组织中均有高表达,如肝、小肠、褐色脂肪和脾脏[9]。TGR5和FXR在糖类及能量代谢中均发挥重要作用[10]。TGR5可活化胰高血糖素样肽1(glucagonlike peptide 1,GLP-1)提高肥胖小鼠的糖耐受[11]。TGR5在能量消耗中也起到关键性作用。TGR5通过cAMP依赖的甲状腺激素激活Ⅱ型碘化甲状腺氨酸脱碘酶,这是胆汁酸的基本作用之一[12-13]。胆汁酸通过TRG5能使D2在褐色脂肪和骨骼肌这些产热组织中高表达,使甲状腺素(T4)转变为三碘甲状腺原氨酸(T3),T3能诱导解偶联蛋白(uncoupling protein,UCP)表达而产热[12]。综上,通过激活胆酸TGR5-CAMP-D2-T3-UCP通路导致ATP合成降低,从而调节能量代谢的动态平衡。
基于上述研究,笔者以高脂饮食诱导野生型及TGR5-/-肥胖小鼠模型,通过对比观察OA干预对两种类型肥胖小鼠的不同作用,探讨OA降脂降糖效应与TGR5的关系。研究发现,给予高脂饮食,野生型与TGR5-/-小鼠的体重及肝脏脂肪含量均有增加,经过OA治疗,野生型小鼠体重可显著下降至接近对照组水平,部分肝细胞也能够恢复正常,而OA的这种对体内脂肪堆积及肝组织脂质沉积的抑制作用在TGR5-/-小鼠却并不明显,说明TGR5对OA调节肥胖与糖耐受是必要的。通过检测肝脏糖异生代谢关键酶mRNA的转录水平,笔者观察到OA可在一定程度上抑制糖异生的关键酶,促进肝组织糖酵解效应,从而降低野生型,而非TGR5-/-小鼠的血糖水平,揭示出OA调节肝脏糖代谢具有TGR5依赖性。
总之,当前的研究证明OA对体内糖脂代谢的调节作用是通过激活TGR5得以实现的。近来,miRNAs作为人类疾病潜在的治疗新靶标得到了大量的关注,包括治疗肥胖与糖尿病[14-15]。研究发现,将OA作为一种工具来筛选可被TGR5激活调节的下游肝脏miRNAs[16],miR-26a能够被显著诱导,说明TGR5的激活可增加miR-26a表达[17]。亦有研究证实,miR-26a能够阻止肥胖诱导的胰岛素抵抗及肝脏合成过多脂质[18]。因此,通过激活TGR5调节miRNA的表达,可成为未来治疗肥胖相关代谢疾病的新方向。
[1]Bray GA,Bellanger T.Epidemiology,trends,and morbidities of obesity and the metabolic syndrome[J].Endocrine,2006,29(1):109-117.
[2]LiuJ.Pharmacologyofoleanolicacidandersolic[J]. Ethnopharmacol,1995,49(2):57-68.
[3]Kuipers F,Blocks VW,Groen AK.Beyond intestinal soapbile acids in metabolic control[J].Nat Rev Endocrinol,2014,10(8):488-498.
[4]Chen X,Lou G,Meng Z,et al.TGR5:a novel target for weight maintenance and glucose metabolism[J].Experimental Research,2011:853501.
[5]Watanabe M,Houten SM,Mataki C,et al.Bile acids induce energyexpenditurebypromotingintracellularthyroid hormone activation[J].Nature,2006,439(7075):484-489.
[6]Amico V,Barresi RV,Chiliemi DF,et al.Bioassay-guided isolation of antiproliferative compounds from grape(Vitis vinifera)stems[J].Nat Prod Commum,2009,4(1):27-34.
[7]Sato H,Genet C,Strehle A,et al.Anti-hyperglycemic activity of a TGR5 agonist isolated from olea europaea[J].Biochem Bioph Res Com,2007,362(4):793-798.
[8]Tahrani AA,Bailey CJ,Del Prato S,et al.Management of type 2 diabetes:new and future developments in treatment[J]. Lancet,2011,378(9786):182-197.
[9]Maruyama T,Tanaka K,Suzuki J,et al.Targeted disruption of G protein-coupled bile acid receptor1(Gpbar1/M-Bar)in mice[J].Endocrinol,2006,191(1):197-205.
[10]Li T,Francl JM,Boehme S,et al.Glucose and insulin induction of bile acid synthesis:mechanisms and implication in diabetes and obesity[J].Biol Chem,2012,287(3):1861-1873.
[11]Harach T,Pols TW,Nomura M,et al.TGR5 potentiates GLP-1 secretion in response to anionic exchange resins[J]. Sci Rep,2012,2:430.
[12]Kawamata Y,Fujii R,Hosoya M,et al.A G protein-coupled receptor responsive to bile acids[J].J BiolChem,2003,278(11):9435-9440.
[13]Maruyama T,Miyamoto Y,Nakamura T,et al.Identification of membrane-type receptor for bile acids(M-BAR)[J]. Biochem Biophys Res Commun,2002,298(5):714-719.
[14]RottiersV,NaarAM.MicroRNAsinmetabolismand metabolic disorders[J].Nat Rev Mol Cell Biol,2012,13(4): 239-250.
[15]VanRooijE,OlsonEN.MicroRNAtherapeuticsfor cardiovascular disease:opportunities and obstacles[J].Nat Rev Drug Discov,2012,11(11):860-872.
[16]Meng Z,Fu X,Chen X,et al.miR-194 is a markerof hepaticepithelial cells and suppesses metastasis of liver cancer cells in mice[J].Hepatology,2010,52(6):2148-2157.
[17]Chen X,Xu H,Ding L,et al.Identification of miR-26a as a Target Gene of Bile Acid Receptor GPBAR-1/TGR5[J]. PLoS ONE,2015;10(6):e0131294.
[18]Fu XH,Dong BN,Tian Y,et al.MiR-26a regulates insulin sensitivity and metabolism of glucose and lipids[J].J Clin Invest,2015,125(6):2497-2509.
编辑/张惠娟
Effect of OA on glucose and lipid metabolism in obese mice by its receptor TGR5
CHEN Xiao-song,YAN Liu,GUO Zhi-hui,LI Ming,HUANG Chu-shan
(Department of Plastic Surgery,Union Hospital of Fujian Medical University,Fuzhou 350001,Fujian,China)
Objective To explore the effect of the natural compound OA on regulating glucose and lipid metabolism by its receptor TGR5 in BAT in diet-induced obesity animal models.Methods Wildtype and TGR5-/-mice(n=5/group)between 8 and 10 weeks old were fed with HFD or the control regular chow diet for 8 weeks.Then mice fed with HFD were randomly divided into two groups.One group were kept feeding with HFD.The other group was switched to HFD+OA for additional 8 weeks. Glucose tolerance test was detected after 16 weeks.Hematoxylin and eosin staining was performed for standard histological examination in liver tissues.Expression of genes related to glucose metabolism in liver was measured by Rael-time PCR.Mouse body weights were monitored during the entire process.ResultsTGR5 is required to mediate the effect of OA on obesity and glucose regulation.TGR5 activation enhanced insulin sensitivity in TGR5-/-mice.Activities on TGR5 induced lipid deposition and down-regulated the mRNA levels of G6pc in liver.Conclusion The effect of OA on body weight control and anti-hyperglycemia in obese mice is achieved by its receptor TGR5.
TGR5;oleanolic acid;obesity;glucose and lipid metabolism;TGR5-/-mice
Q591.5
A
1008-6455(2015)21-0027-05
国家自然科学基金,NO.81372092;福建省科技计划重点项目,NO.2011Y0029;福建省卫生厅中青年骨干人才项目,NO.2103-ZQN-ZD-15
2015-08-15
2015-10-30

