肉苁蓉苯乙醇总苷对高原脑水肿大鼠水通道蛋白4的影响△
陶义存,董翔,许永华,靳春丽,屠鹏飞
(1.新疆医科大学基础医学院,新疆 乌鲁木齐 830011;2.兰州军区乌鲁木齐总医院,新疆 乌鲁木齐 830011;3.北京大学 药学院,北京 100191)
·基础研究·
肉苁蓉苯乙醇总苷对高原脑水肿大鼠水通道蛋白4的影响△
陶义存1,董翔2,许永华2,靳春丽1,屠鹏飞3*
(1.新疆医科大学基础医学院,新疆 乌鲁木齐 830011;2.兰州军区乌鲁木齐总医院,新疆 乌鲁木齐 830011;3.北京大学 药学院,北京 100191)
目的:观察肉苁蓉苯乙醇总苷预防给药对高原脑水肿模型大鼠的作用。方法:大鼠随机分为正常对照组、模型组、大花红景天口服液组(1.78 mL·kg-1·d-1),肉苁蓉苯乙醇总苷低、中、高剂量组(75、150、300 mg·kg-1·d-1),每组12只,灌胃预防给药10 d,第8天起除正常对照组外其余各组置于模拟海拔5000 m高原环境72 h建立高原脑水肿模型,观察各组大鼠脑组织病理改变,检测脑组织干湿比、脑组织水通道蛋白4(aquaporin-4,AQP4)的表达变化。结果:与正常对照组(脑组织干湿比为:4.65±0.10)相比,模型组大鼠脑组织干湿比(5.14±0.16)显著升高,脑组织AQP4表达增加(模型组表达为正常组的2.21±0.46倍)。肉苁蓉苯乙醇苷能够降低脑组织含水量(低中高剂量组依次为:4.68±0.08,4.66±0.10,4.66±0.18),且能降低高原脑水肿大鼠脑组织水通道4mRNA(低中高剂量组依次为正常组的:1.20±0.30,1.03±0.17,1.12±0.33倍)和蛋白的表达,改善高原脑水肿大鼠脑水肿病理改变。结论:肉苁蓉苯乙醇苷能够预防高原脑水肿的发生,可能与其抑制水通道4的表达有关。
管花肉苁蓉;苯乙醇总苷;高原脑水肿;水通道蛋白4
高原脑水肿(high-altitude cerebral edema,HACE)一般发生在初次进入海拔超过3000 m高原环境时,由于机体对高原低压低氧环境的不适应而导致的一种严重威胁生命的疾病,它与高原反应、高原肺水肿是急性高原病的3种表现形式[1]。尽管关于高原脑水肿的研究相比高原肺水肿较少,但相关研究表明水通道4蛋白表达的增多,从而增加血脑屏障通透性,参与脑水肿形成和发展,在高原脑水肿的发生中发挥着重要作用[2-3]。
管花肉苁蓉Cistanchetubulosa(Schenk)R.Wight为中药肉苁蓉的基源植物之一,具有补肾阳、益精血、润肠通便之功效。化学成分研究表明,肉苁蓉主要含苯乙醇苷类(phenylethanoid glycosides)、环烯醚萜及其苷类(iridoids and iridoid glycosides)、木脂素及其苷类(lignans and lignan glycosides)、寡糖酯类(oligosaccharide esters)、多糖类(polysaccharides)等成分,其中松果菊苷、毛蕊花糖苷等苯乙醇苷类为其主要药效成分[4]。多年来对肉苁蓉苯乙醇苷的药理研究表明其具有抗缺氧、抗辐射、清除自由基等作用[5-7],与抗高原病有效成分红景天苷具有相似的药理作用。为了解肉苁蓉苯乙醇苷类是否具有抗高原脑水肿作用,本研究利用西北地区特殊环境人工实验舱建立大鼠高原脑水肿模型[8-9],对管花肉苁蓉苯乙醇总苷(phenylethanoid glycosides fromCistanchetubulosa,简称PhGs-Ct)对高原脑水肿的预防作用及其可能的作用机制进行了研究,以期为肉苁蓉临床新用途的拓展提供科学依据。
1 材料
1.1 动物
实验动物Wistar大鼠,SPF级,雌雄各半,体重180~220 g,购自新疆医科大学实验动物中心,动物生产许可证号SCXK(新)2011-0004,动物使用许可证号为SYXK(新)2011-0004。实验设计通过了新疆医科大学第一附属医院伦理学审核,符合实验动物伦理学要求。
1.2 动物饲养条件
前7天,各组动物饲养在SPF环境实验室。后3天,正常对照组仍饲养在SPF环境,其余各组饲养在海拔5000 m低氧环境(大气压为54.1 Kpa,氧分压为11.52 Kpa)。SPF环境如下:
温度:22~26 ℃;
相对湿度:40%~70%;
光照条件:12 h/12 h明暗交替;
通风情况:全新风;
动物房的一般清洁消毒:0.2%新洁尔灭拖擦清洗。
1.3 仪器
西北特殊环境人工实验舱(兰州军区乌鲁木齐总医院,DY-2),光学显微镜(日本Nikon公司,E200),组织切片机(德国美康公司,HM340E),电子天平(梅特勒-托利多仪器有限公司,AL204,精度0.1 mg),化学发光成像系统(上海勤翔科学仪器有限公司,Chemiscope 3000),凝胶成像系统(美国UVP公司,Bio Doc Imaging)实时定量PCR仪(美国ABI公司,7500 Fast)。
1.4 药品与试剂
管花肉苁蓉苯乙醇总苷(北京大学屠鹏飞教授提供,含量90.70%,用蒸馏水配制成相应浓度的溶液);大花红景天口服液(西藏藏药集团股份有限公司,120503,国药准字B20070002,10 mL*12支);免疫组化染色试剂盒(北京中杉金桥生物技术有限公司,SP-9000),AQP4抗体(Santa Cruz Biotechnology,L9057)。
2 方法
2.1 分组与用药
Wistar大鼠随机分为6组:正常对照组,模型组,大花红景天口服液组(1.78 mL·kg-1·d-1),PhGs-Ct低剂量组(75 mg·kg-1·d-1)、PhGs-Ct中剂量组(150 mg·kg-1·d-1)、PhGs-Ct高剂量组(300 mg·kg-1·d-1),每组12只。各组均在SPF环境饲养,正常对照组、模型组灌胃蒸馏水,其余各组按照相应剂量灌胃给药,连续给药10 d,7 d后除空白对照组外其余各组置于模拟海拔5000 m高原环境的人工实验舱中饲养。舱内高度以10 m·s-1的速度匀速上升到海拔5000 m水平(大气压为54.1 Kpa,氧分压为11.52 Kpa),其间动物自由进水及进食,每24 h开舱半小时给药,添加饲料及饮水[10]。
2.2 动物处理
各组大鼠出仓后立即腹腔注射戊巴比妥钠(2%,2.0 mL·kg-1)麻醉,腹主动脉取血,打开颅腔,取脑组织,取左脑上半部称重后锡箔纸包裹测定组织湿干比,左脑下半部4%多聚甲醛固定,用于HE染色及AQP4免疫组化。右脑-80 ℃冰箱冻存,用于测定AQP4 mRNA的表达。
2.3 脑组织病理学观察
脑组织放入4%的多聚甲醛中充分固定后,脱水、包埋、切片、HE染色,不同放大倍数光学显微镜下观察病理改变,并拍摄图片。
2.4 脑组织湿干比
取左脑上半部称重后,锡箔纸包裹脑组织,置烘箱(80 ℃,72 h)干燥至恒重,称干重量,计算湿干比:湿干比=干燥前组织重量/干燥后组织重量。
2.5 免疫组化测定AQP4的表达
采用亲合素-生物素复合物(Avidin Biotin Complex,ABC)染色,二氨基联苯胺显色法。
免疫组化步骤如下:切片,烤片、脱蜡、水化,组织抗原修复,淬灭内源性过氧化物酶活性,封闭,加入一抗,加入二抗,滴加试剂ABC,DAB显色,复染、分化、透明,封片。
2.6 AQP4 mRNA表达的测定
提取脑组织总RNA,DNase I消化样品RNA中的DNA,进行RNA琼脂糖凝胶电泳,将RNA反转录为cDNA,进行cDNA检测。
AQP4荧光实时定量PCR引物由上海生工有限公司合成,见下表。

基因名序列β-actinF:5'-GAGACCTTCAACACCCCAGC-3'R:5'-ATGTCACGCACGATTTCCC-3'AQP4F:5'-TTGGACCAATCATAGGCGC-3'R:5'-GGTCAATGTCGATCACATGC-3'
2.7 统计学分析
采用SPSS 16.0软件进行分析,计量数据均采用均数±标准差表示,数据先进行正态性检验,符合组间比较采用独立样本t检验,不符合进行对数转换。检验水准为α=0.05。
3 结果
3.1PhGs-Ct对高原脑水肿大鼠脑组织病理改变的影响
在光镜下观察各组大鼠脑组织病理切片可见,正常对照组脑组织分子层、外颗粒细胞层、椎体层细胞层、内颗粒细胞层、多行细胞层结构清楚,未发现病变。模型组大鼠脑组织毛细血管充血、水肿,分子层、椎体层细胞水肿明显。PhGs-Ct低剂量组大鼠脑组织分子层部分血管扩张充血水肿,细胞轻度水肿,水肿较模型组减轻。PhGs-Ct中剂量组大鼠脑组织部分脑膜下血管扩张充血,偶见细胞水肿,水肿较模型组明显减轻。PhGs-Ct高剂量组分子层无明显水肿,血管周围轻度水肿,水肿较模型组明显减轻。大花红景天组大鼠脑组织分子层散在水肿,散在血管极轻度水肿,水肿较模型组明显减轻。可知模型组大鼠脑组织明显水肿,模型成立。管花肉苁蓉苯乙醇总苷、大花红景天可以降低高原脑水肿模型大鼠脑水肿程度。具体结果见图1。
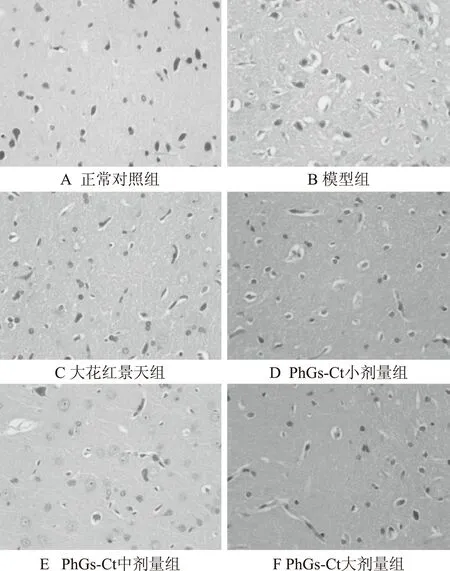
图1 PhGs-Ct对高原脑水肿大鼠脑组织病理改变的影响(HE×400)
3.2PhGs-Ct对高原脑水肿大鼠脑组织湿干比的影响
与正常对照组相比,模型组脑组织湿干比显著升高,差异具有统计学意义(P<0.01),说明模型成立。PhGs-Ct低、中、高剂量组和大花红景天组大鼠脑组织湿干比与模型组相比均降低,差异具有统计学意义(P<0.01),管花肉苁蓉苯乙醇总苷各剂量组与大花红景天组脑组织湿干比比较,差异无统计学意义。具体结果见表1。
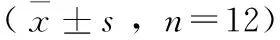
表1 PhGCs对高原脑水肿大鼠脑组织湿干比的影响
注:**表示与正常对照比,P<0.01;##表示与模型组比,P<0.01。
3.3PhGs-Ct对高原脑水肿大鼠脑组织AQP4表达的影响
用免疫组织化学法检测脑组织AQP4的表达发现,AQP4主要在大鼠脑组织脉络丛表达。空白对照组大鼠脑组织AQP4表达弱阳性,在急性高原病模型组大鼠脑组织强阳性表达,PhGs-Ct低、中、高剂量组和大花红景天组大鼠脑组织AQP4表达弱阳性,尤其是PhGs-Ct低剂量组大鼠脑组织AQP4表达接近正常组。可知模型组大鼠脑组织AQP4蛋白在调控水-电解质平衡的部位表达增多,管花肉苁蓉苯乙醇总苷能降低高原脑水肿大鼠脑组织AQP4蛋白的表达,从而抑制水肿的发生。具体结果见图2。
3.4PhGs-Ct对高原脑水肿大鼠脑组织AQP4 mRNA表达的影响
荧光定量PCR检测脑组织AQP4 mRNA的表达发现,与正常对照组相比,模型组大鼠脑组织AQP4 mRNA表达量显著升高,是其2.21倍(P<0.01)。与模型组相比,PhGs-Ct低剂量组、PhGs-Ct中剂量组、PhGs-Ct高剂量组和大花红景天组大鼠脑组织AQP4 mRNA表达量下降(分别为正常对照组的1.20、1.03、1.12和1.09倍),差异有统计学意义(P<0.01)。PhGs-Ct各剂量组与大花红景天组相比差异无统计学意义。PhGs-Ct中剂量组、PhGs-Ct高剂量组和大花红景天组可使大鼠脑组织AQP4 mRNA表达量恢复到正常水平(P>0.05)。具体结果见表2。
3.5AQP4 mRNA表达量与脑组织含水量的相关性分析
利用线性回归分析各组大鼠脑组织湿干比与AQP4 mRNA表达量的相关性,方差分析结果F=192.112,P<0.01,R2=0.773,线性关系见图3。可见脑组织含水量与AQP4 mRNA表达量成正比,脑水肿程度与AQP4 mRNA表达量正相关。

图2 PhGs-Ct对高原脑水肿大鼠脑组织AQP4表达的影响
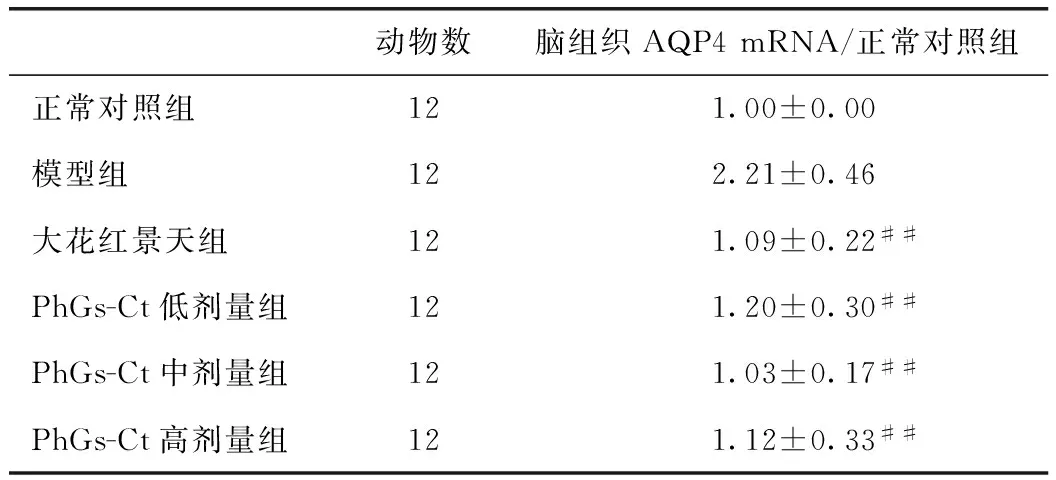
动物数脑组织AQP4mRNA/正常对照组正常对照组121.00±0.00模型组122.21±0.46大花红景天组121.09±0.22##PhGs-Ct低剂量组121.20±0.30##PhGs-Ct中剂量组121.03±0.17##PhGs-Ct高剂量组121.12±0.33##
注:##表示与模型组比,P<0.01。
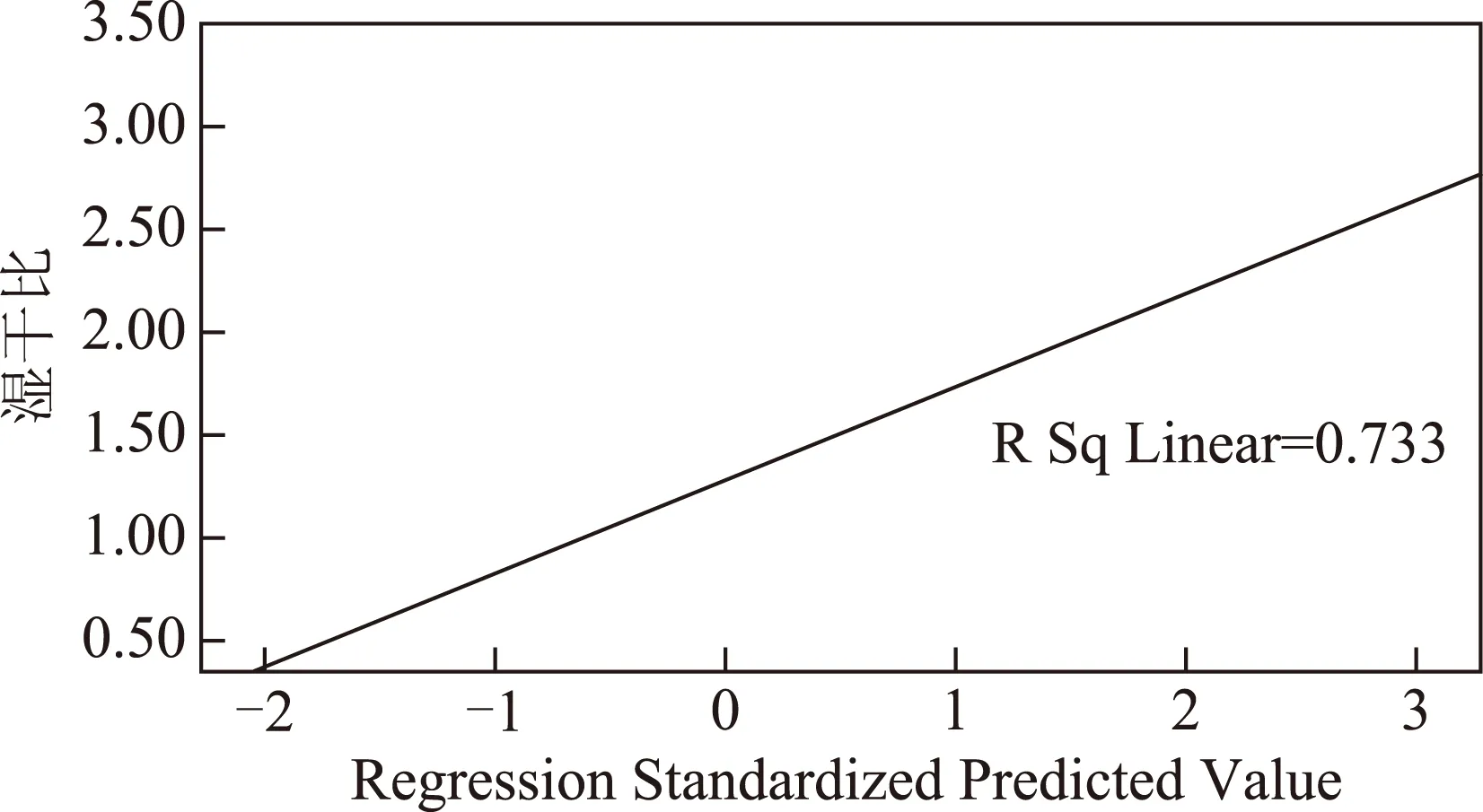
图3 湿干比与AQP4 mRNA表达量线性回归散点图
4 讨论
水通道蛋白(aquaporins,AQPs)是一组对水有高度选择性的膜转运蛋白,广泛分布于各种组织,在水的分泌和吸收,细胞内外水平衡过程中发挥着重要作用。迄今为止,在哺乳动物体内发现至少有13种水通道蛋白,即AQP0~AQP12,其主要功能是便于水和一些小分子溶质如甘油、尿素等的快速跨膜运动。中枢神经系统存在的水通道蛋白主要为AQP1 和AQP4,其中尤以AQP4分布最为广泛[11],AQP4具有高度快速转运水的能力,比其它的水通道蛋白对水的通透性强3~4倍,在脑内水电解质平衡的调节上发挥着重要作用[12-13]。研究表明AQP4与脑水肿发生密切相关[14-15]。
本研究结果表明,管花肉苁蓉苯乙醇总苷可以降低高原脑水肿模型大鼠脑组织的湿干比,能够预防高原脑水肿的发生发展。本研究采用免疫组化法检测了各组大鼠脑组织AQP4的表达,并用荧光定量PCR检测了AQP4 mRNA在大鼠脑组织中表达量的变化,发现高原脑水肿模型大鼠脑组织AQP4蛋白和mRNA表达量显著增加,提示AQP4参与了高原脑水肿的形成。管花肉苁蓉苯乙醇总苷可以抑制高原脑水肿模型大鼠脑组织AQP4蛋白和mRNA的表达,可能通过抑制AQP4的表达来预防高原脑水肿的发生。含水量的增加是组织水肿的重要标志,本研究通过计算组织湿干比表示组织含水量的多少,通过线性回归发现脑组织干湿比与AQP4 mRNA表达量正相关,肉苁蓉改善脑水肿与其抑制水通道蛋白AQP4的表达有一定联系。随着西部大开发的深入进行和旅游业的长足发展,越来越多的平原居民将进入高原环境,所以由高原环境引起的高原病的防治极为重要。本研究表明,肉苁蓉具有预防高原脑水肿的潜在作用,为肉苁蓉新用途的拓展提供实验依据。
目前高原脑水肿动物的相关研究中,很少研究动物整体行为的改变[15-16]。但急性高原病患者首先出现的一系列神经学症状,如头痛、恶心、呕吐、失眠、疲乏、头昏眼花、共济失调等,重者精神智力障碍以至昏迷。这些神经学症状是以大脑病变为基础的,即早期的血脑屏障病变到极端严重情况——高原脑水肿(HACE)[17]。本研究结果提示肉苁蓉具有预防高原脑水肿的潜在作用,可能会有效预防上述症状的发生。
[1] West JB,English Translation of “Nomenclature,Classification,and Diagnostic Criteria of High Altitude Disease in China”[J].High Altitude Med Biol,2010,11(2):169-172.
[2] 杨晓文,可金星,陈代伦,等.高原反应的脑病理与水通道蛋白-4(AQP4)的相关性实验研究[J].第三军医大学学报,2005,(27)16:1685-1689.
[3] 张衍,王焕成,宋明爱.依达拉奉改善大鼠血脑屏障损伤的AQP-4机制研究[J].中国实用神经疾病杂志,2010,(13)2:5-7.
[4] 蔡鸿,鲍忠,姜勇,等.不同产地管花肉苁蓉中有效成分的定量分析[J].中草药,2007,38(3):452-455.
[5] 木合布力·阿布力孜,毛新民,热娜·卡斯木,等.肉苁蓉苯乙醇苷在HL-60细胞中的抗氧化活性研究[J].中国药理学通报,2008,(24)3:362-364.
[6] 刘凤霞,王晓雯,罗兰,等.肉苁蓉苯乙醇苷对β-淀粉样肽所致阿尔采末病小鼠模型学习记忆的影响及其机制[J].中国药理学通报,2006,22(5):595-599.
[7] 刘智勤,陈鹊汀,李岩,等.肉苁蓉对化疗荷瘤小鼠造血和免疫功能的影响[J].北京中医药大学学报,2010,(33)11:758-761.
[8] 许永华,张琼,曹金军,等.创建大型复合低压舱扩大医学实验平台种类[J].中国比较医学杂志.2012,22(7):60-63.
[9] 骆新,李建英,许永华,等.肉苁蓉苯乙醇苷对大鼠高原脑水肿的防治作用[J].中南药学.2014,12(8):747-750.
[10] 陶义存,是文辉,许永华,等.模拟高原环境下高原肺水肿大鼠模型的建立[J].中国实验动物学报,22(1):76-78.
[11] Arciénegaa II,Bruneta JF,Blocha J,et al.Cell locations for AQP1,AQP4 and 9 in the non-human primate brain[J].Neuroscience,2010,167(4):1103-1114.
[12] Nico B,Mangieri D,Tamma R,et al.Aquaporin-4 contributes to the resolution of peritumoural brain oedema in human glioblastoma multiforme after combined chemotherapy and radiotherapy[J].Eur J Cancer,2009,45(18):3315-3325.
[13] Taya K,Marmarou C,Okuno K,et al.Effect of secondary insults upon aquaporin-4 water channels following experimental cortical contusion in rats[J].J Neurotrauma,2010,27(1):229-239.
[14] Tang YP,Wu P,Su JJ,et al.Effects of Aquaporin-4 on edema formation following intracerebral hemorrhage[J].Experimental Neurology,2010(223):485-495.
[15] 梁林,杨术旺,龚海英.水通道蛋白4在高原脑水肿大鼠脑组织中的表达变化及意义[J].武警医学院学报,2011,20(12):932-938.
[16] 邓志宽,郑健,赵士福,等.高原大鼠脑组织Rho激酶活性变化及其与高原脑水肿关系的实验研究[J].中华医学杂志,2009,89(13):923-927.
[17] 杨晓文,可金星,陶忠芬,等.高原环境中大鼠脑水肿与水通道蛋白4的表达变化[J].中国临床康复,2005,9(9):84-87.
PreventiveEffectofPhenylethanoidGlycosidesfromCistanchetubulosaonRatswithHighAltitudeCerebralEdema
TAOYicun1,DONGXiang2,XUYonghua2,JINChunli1,TUPengfei3*
(1.BasicMedicalDepartmentOfXinjiangMedicalUniversities,Urumqi830011,China;2.XinjiangGeneralHospitalofLanzhoumilitaryregion,Urumqi,830011,China;3.SchoolofPharmacy,PekingUniversity,Beijing100191,China)
Objective:To observe the effect and mechanism of phenylethanoid glycosides fromCistanchetubulosa(PhGs-Ct)on rats with high-altitude cerebral edema.Methods:PhGs-Ct was given prophylactically for 10 days.Then the rats model of high-altitude cerebral edema was established by using hypobaric chamber in a simulated environment of 5000 m altitude.Pathologic changes of rat brain tissue,the wet/dry weight ratios(W/D)of brain,the expression of AQP4 mRNA and protein were observed.Results:Compared with the control group,the high altitude cerebral edema model rats showed the remarkable character of cerebral edema and the higher W/D of brain(5.14±0.16 vs 4.65±0.10),and the expression of AQP4 mRNA(2.21±0.46)and protein were increased.While PhGs-Ct were able to decrease W/D of brain(4.68±0.08,4.66±0.10,4.66±0.18 respectively),reduce the expression of AQP4 mRNA(1.20±0.30,1.03±0.17,1.12±0.33 respectively)and protein in brain tissue,improve pathological change of brain tissue.Conclusion:PhGs-Ct is able to prevent the high altitude cerebral edema via decreasing the protein and mRNA expression of AQP4 in brain tissue.
Cistanche tubulosa;PhGs-Ct;high altitude cerebral edema;AQP4
2015-03-30)
国家自然科学基金项目(NO 81160416)
*
屠鹏飞,教授,研究方向:天然药物活性成分与新药研究、中药质量分析;Tel:(010)82802750,E-mail: pengfeitu@bjmu.edu.cn
10.13313/j.issn.1673-4890.2015.4.002
——题《圣山系-金巅》

