基于核磁共振的山药与麸炒山药化学成分比较
董泰山,韩晓静
(1.高平市新农合管理中心,山西 晋城 048400;2.山西药科职业学院,山西 太原 030031)
·基础研究·
基于核磁共振的山药与麸炒山药化学成分比较
董泰山1,韩晓静2*
(1.高平市新农合管理中心,山西 晋城 048400;2.山西药科职业学院,山西 太原 030031)
目的:比较山药与麸炒山药的化学组成差异,为其质量控制提供研究依据。方法:采用1H-NMR代谢组学技术对山药和麸炒山药进行分析,通过聚类分析、主成分分析、递归支持向量机分析等多种多元统计方法阐明其化学差异成分。结果:山药核磁共振指纹图谱中共指认出了代谢物23种,多元统计分析显示不同批次的山药之间差异较小,而不同批次的麸炒山药组间差异较大,山药中丙氨酸、谷氨酰胺及苹果酸含量较高,麸炒山药中异亮氨酸、亮氨酸、蔗糖、α-葡萄糖、γ-氨基丁酸、天冬酰胺、酪氨酸及苯丙氨酸含量较高。结论:本研究采用代谢组学技术从多成分角度比较了山药与麸炒山药的差异,为山药、麸炒山药质量标准研究提供了依据。
山药;麸炒山药;植物代谢组学;NMR;多元统计
山药为薯蓣科植物薯蓣DioscoreaoppositaThunb.的干燥根茎,属多年生缠绕草本植物,始载于《神农本草经》,列为上品。山药饮片的历代炮制方法有清炒、麸炒、土炒等,生山药和麸炒山药都是中医临床常用的品种。山药具有补脾养胃,生津益肺,补肾涩精功能。用于脾虚食少,久泻不止,肺虚喘咳,肾虚遗精,带下,尿频,虚热消渴。麸炒山药补脾健胃。用于脾虚食少,泄泻便溏,白带过多[1]。
化学成分研究表明,山药中含有丰富的蛋白质、游离氨基酸、多种微量元素、多糖、尿囊素、淀粉酶、胆碱等多种成分,这些化学成分是山药营养价值和功效的物质基础[2]。对于山药在炮制后的化学成分变化,有学者使用薄层色谱、紫外光谱、高效液相色谱等方法对其进行比较,结果显示其区别在于山药麸炒后5-羟甲基糠醛、糠醛等成分含量升高[3],而尿囊素有所升高或不变[4-5]。然而,山药化学成分复杂,现有研究尚未从整体上反映出山药与麸炒山药的化学差异。
近年来基于核磁共振的植物代谢组学技术已经成功用于多种中药的质量分析与评价[6],如厚朴[7]、人参[8]、地黄[9]、远志[10]等,为中药质量控制提供了一种有别于指纹图谱的整体性分析方法。本研究采用基于NMR代谢组学技术对山药与麸炒山药进行化学比较研究,从化学角度阐明山药与麸炒山药的差异,为山药与麸炒山药的质量控制以及差异成分与功效的相关性研究提供参考。
1 仪器与材料
1.1 仪器与试剂
Bruker 600-MHz AVANCE III NMR Spectrometer(600.13 MHz质子频率,德国布鲁克公司600兆核磁仪),超声波清洗器(KQ5200E,昆山市超声仪器有限公司),旋转蒸发仪(RE-52A,上海亚荣生化仪器厂),SC-3610低速离心机(安徽中科中佳科学仪器有限公司),TGL-16高速台式冷冻离心机。
NMR试剂:重水(Norell,Landisville,USA),氘代甲醇(99.8%,Merck,Germany),氘代氢氧化钠(Armar,Switzerland),3-三甲基硅基[2,2,3,3-d4]氘代丙酸钠(TSP,Cambridge Isotope Laboratories Inc.,MA)。甲醇为分析纯,娃哈哈纯净水。
1.2 材料
从山西省太原市长城药店、荣华药店、新河药店中购买了4个不同批次的麸炒山药和4个不同批次的山药,共8个批次,每批样品平行做两次实验(1~8号为麸炒山药,9~16号为山药)。山药、麸炒山药经山西药科职业学院韩晓静讲师鉴定,标本保存在山西药科职业学院。
2 方法
2.1 样品制备
参照文献报道方法进行供试品溶液制备[10]。精密称取山药、麸炒山药样品粉末200 mg 置于10 mL离心管中,分别加纯净水及甲醇各3 mL,漩涡混匀1 min,超声提取25 min,离心(3500 r·min-1)25 min,然后用移液枪将澄清部分转移至25 mL圆底烧瓶中,减压浓缩蒸干。于测定前用NMR试剂溶解,用氘代甲醇400 μL与缓冲重氢水(Buffer:KH2PO4溶于D2O中,以1 mol·L-1氘代氢氧化钠溶液调节pH值至6.0,含0.1% TSP)400 μL溶解,离心(13 000 r·min-1)10 min,移取上清液600 μL于5 mm核磁管中待测。
2.21H-NMR测定
样品在25 ℃下于600 MHz NMR仪上测定,测定频率为600.13 MHz,扫描次数为64,谱宽12 345.7 Hz,傅里叶变换0.188 Hz,脉冲间隔D1为1 s,延迟时间为5.0 s,相调节、基线调节及峰校正均为手动。样本提取物核磁测定采用noesyppr1d序列压制水峰,用氘代甲醇进行锁场,内标为TSP。
2.3 数据分析
核磁图谱采用MestReNova软件(version 8.0.1,Mestrelab Research,Santiago de Compostella,西班牙)进行处理。对图谱的相位、基线及平滑进行校正并实现位移的定标后,以δ0.04积分段对化学位移区间δ0.77 ~9.49进行分段积分。核磁图谱中δ4.78~5.14(残余水峰)和δ3.29~3.33(残余甲醇峰)不进行积分。将积分后的数据保存至Excel表中,进行后续分析。
将Excel表中的积分数据先导入SPSS 16.0软件中进行HCA聚类分析,不同类间距离的测量方法使用Between-groups法、距离种类使用Block。然后将其导入SIMCA-P13.0(Umetrics,Umea,Sweden)软件中进行主成分分析(principal component analysis,PCA)、偏最小二乘法判别分析(partial least squares discriminant analysis,PLS-DA)和正交偏最小二乘法判别分析(Orthogonal PLS-DA,OPLS-DA)。此外,利用代谢组学分析网站(hppt://www.metaboanalyst.ca)进行递归支持向量机分析(R-SVM)。根据分析结果,找出差异性代谢产物,对其相对峰面积进行t检验,以寻找显著性差异代谢产物。
3 结果与分析
3.1 代谢组学分析
通过文献报道数据[11-13]以及BMRB数据库(www.bmrb.wisc.edu.com)对照,从山药与麸炒山药图谱中指认出23个代谢产物。
由图1可见,山药与麸炒山药的核磁图谱大致可以分为3个区域,即脂肪区、碳水化合物区和芳香区。脂肪区位于高场端,化合物主要为有机酸和氨基酸。在脂肪区(δH3.10~δH0.00),山药与麸炒山药信号相似,共有的氨基酸包括丙氨酸、异亮氨酸、亮氨酸、精氨酸、谷氨酸、苏氨酸、谷氨酰胺、天冬酰胺、γ-氨基丁酸等,共有的有机酸包括柠檬酸、苹果酸等。碳水化合物区(δH5.50~δH3.10)主要为糖类物质,包括α-葡萄糖、β-葡萄糖、蔗糖以及尿囊素等。由于麸炒山药在炒制过程中会有糖类的损失,故山药中的α-葡萄糖较麸炒山药而言含量高。另外由于糖类成分复杂,且结构相近,糖区信号重叠非常严重,难以鉴定指认出更多的糖类物质。芳香区位于谱图的低场区(δH10.0~δH5.50),化合物类型主要是芳香氨基酸。指认的芳香氨基酸包括苯丙氨酸和酪氨酸。此外在图谱中还检测到了5-羟甲基糠醛、葫芦巴碱、尿苷、腺苷和甲酸等化合物。指认的各类化合物的核磁数据见表1。
由于山药、麸炒山药的化学组成复杂,得到的核磁图谱中含有大量的化学指纹信息,因此,需借助多元统计分析方法对两者进行深入比较。

注:A.麸炒山药;B.山药。图1 山药与麸炒山药的1H-NMR图谱
3.2 多元统计分析
3.2.1 HCA分析 HCA是以分类依据的条件作为指标或变量,把要对其进行分类的对象作为样品,根据它们所表现的变量特征,按相似程度的大小或亲疏关系加以归类,样品间距离越短,相似性越高,则越容易聚为一类,最后把分类系统直观地用图形(如树状图)表示出来[14]。本文中HCA是以各样品的氢核磁共振峰的积分值为指标或变量进行分析。
山药与麸炒山药的聚类结果如树状图所示(见图2),其中横坐标表示样品间距离的大小,纵坐标为样品编号。在树状图中,每个样本平行做两份的明显聚在一起,说明测试过程的重复性和稳定性较好。山药样本9~16号明显聚在一类,说明不同批次的山药样本之间差异较小,可以归为一类。而不同批次的麸炒山药样本没有聚在一起,且随着横坐标的增大,1~4号样本先与山药样本聚为一类,说明1~4号样本与山药的化学成分差异较小,7~8号样本和5~6号样本与山药的差异较大。这也说明了不同批次的麸炒山药由于厂家、炮制的工艺不同而导致了不同麸炒山药之间的差异较大,未能聚成一类。

表1 山药、麸炒山药中主要化合物的NMR数据归属

图2 山药与麸炒山药的HCA 分析结果
3.2.2 PCA分析 PCA分析是以一种有序的方式提取并保留了有用的信息,连续的主成分所包含的信息量越来越少。PCA分析的得分图能方便地对不同类别进行判别,在得分图中,在该主成分上投影值的绝对值越大,表明该主成分对该类的区分有着越大的影响[15]。本研究中PCA分析所用软件为SIMCA-P13.0。
对山药、麸炒山药提取物进行PCA分析,以主成分1的得分值(t1)和主成分2的得分值(t2)为横纵坐标构建得分散点图(见图3A)。由图3可以看出,第1主成分和第2主成分可以解释63.8%(t1:53.2%,t2:10.6%)的原变量信息,不同批次的山药样本明显聚集在一起,说明组内差异小,即组内聚集;而不同批次的麸炒山药比较分散,说明组内差异较大,原因在于不同厂家炮制工艺不同而导致差异较大。该结果与HCA分析相吻合。
由于PCA分析是无监督的分析方法,只反映了数据的原始状态,即观察到的试验样品的自然分布和组别关系,不能忽略组内误差、消除与研究目的无关的随机误差,为了进一步分析组别差异,确定山药与炒山药的化学差异成分,本研究继续采用有监督的PLS-DA分析和OPLS-DA分析对数据进行分析。
3.2.3 PLS-DA分析及OPLS-DA分析 PLS-DA分析和OPLS-DA分析是有监督的模式识别方法。PLS-DA分析着重强调组间的差异,而将组内的差异降至最低,更能把握多维数据的整体特征和变异规律。OPLS-DA分析可以去除与Y矩阵(在本研究中Y为分组信息)无关的X矩阵的变化,从而使X矩阵和Y变量之间的关系最大化,即可以使两组分类的差别达到最大,从而确定两组之间的化学差异成分。
本研究先对山药与炒山药进行PLS-DA分析,其模型参数为R2=91.0%,Q2=98.8%,证明模型可靠。另一方面,可用排列实验证明模型的有效性(见图3B)。表示Q2的回归线与左边纵轴相交并处于零点以下,左端任何一次随机排列产生的R2、Q2均小于右端,且两条回归线斜率较大,最右端的两个值差距较小,说明原始模型的预测能力大于任何一次随机排列Y变量的预测能力,可见上述方法模型是有效的。图3C为OPLS-DA的得分散点图,从图中明显得出,与无监督的PCA得分图相比,山药与麸炒山药样本有最大程度的分离,这样便于更准确地寻找化学差异代谢物。结合S-Plot图(图3D)和VIP值,在VIP值大于0.7的范围内寻找差异标志物。结果显示山药中丙氨酸、谷氨酰胺及苹果酸的含量较高,而麸炒山药中异亮氨酸、亮氨酸、蔗糖、α-葡萄糖、γ-氨基丁酸、天冬酰胺、酪氨酸及苯丙氨酸的含量较高。

注:A.PCA得分散点图;B.排列实验;C.OPLS-DA得分散点图;D.S-Plot图。图3 山药与麸炒山药的多元统计分析
在SPSS 16.0中进一步采用t检验来验证上述结果,如表2所示,山药与麸炒山药中异亮氨酸、蔗糖、α-葡萄糖、γ-氨基丁酸、天冬酰胺的差异具有统计学意义(P<0.05),酪氨酸差异具有统计学意义(P<0.01)。
3.2.4 递归支持向量机分析(R-SVM)
采用Metaboanalyst网站的R-SVM分析对山药和麸炒山药的差异成分进行分析。R-SVM分析根据各个特征在svm分类器中的贡献率大小从分类结果中提取使分类器性能最好的特征,以实现维数约简的目的[16]。从图4A中可以看出,当变量的数目是98,错误率是0%,当变量数目为29~49时,错误率提高到3.1%,这表明NMR图谱能正确区分山药与麸炒山药。从图4B中可以看出,由天冬酰胺、蔗糖、α-葡萄糖、酪氨酸以及未知特征峰6.73、6.41、6.33、6.29、4.57、4.37、3.41、3.37、3.45、5.45、5.17是区分山药与麸炒山药的主要差异代谢物,且在麸炒山药中的含量较高,与多元统计分析及t检验分析的结果一致。
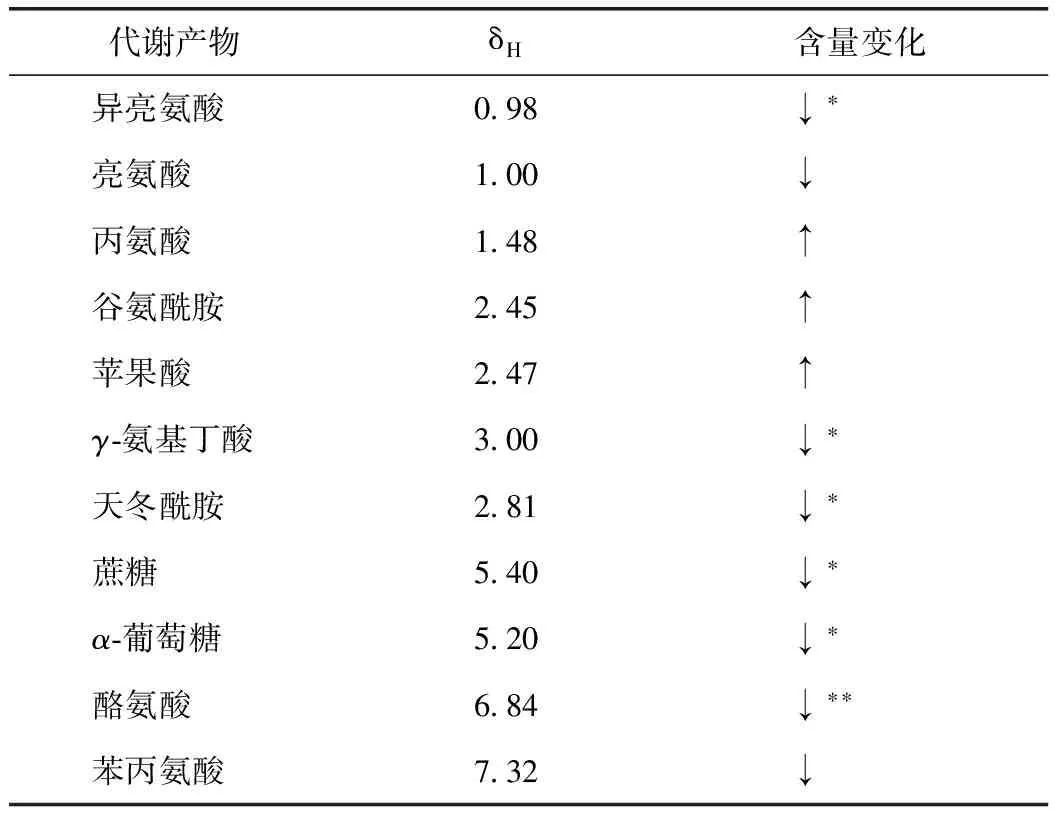
表2 山药与麸炒山药差异代谢物
注:(1)*P<0.05,**P<0.01;(2)↑表示在山药中含量高,↓表示在麸炒山药中含量高。
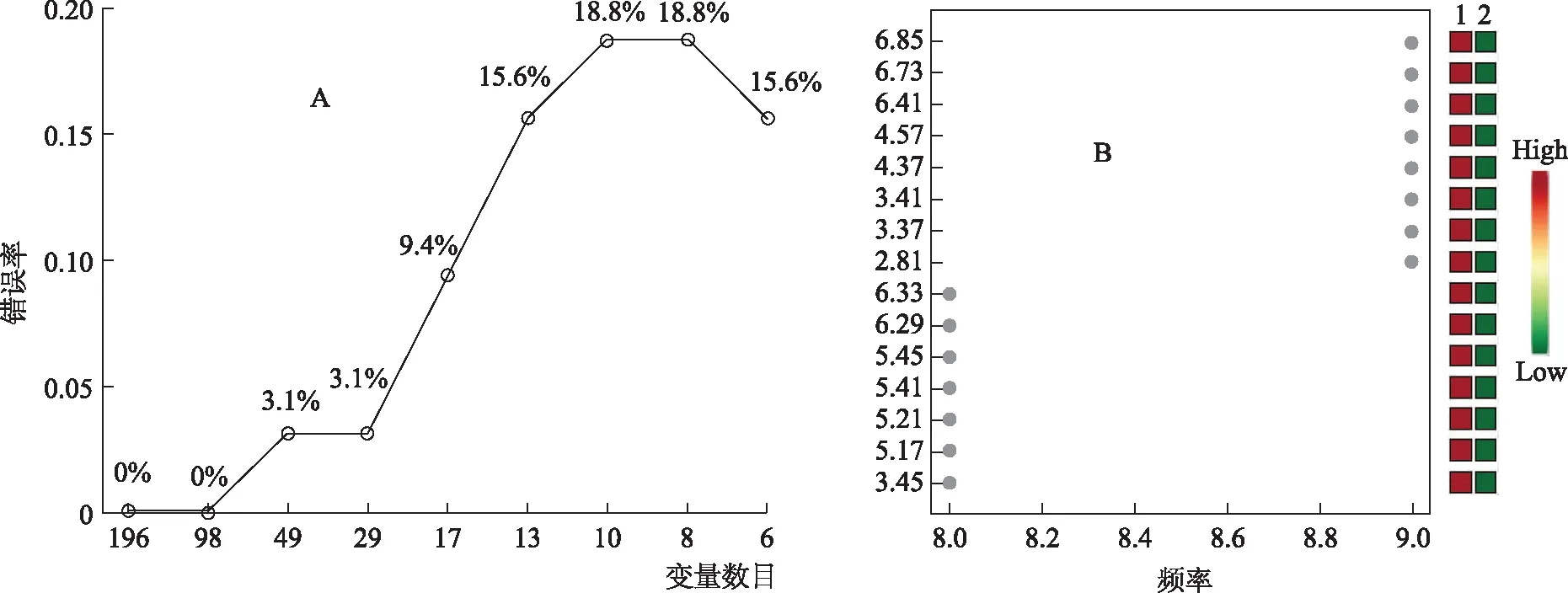
注:A.递归SVM分类图;B.差异变量图。图4 山药、麸炒山药R-SVM分析
4 讨论
本研究采用基于核磁共振的代谢组学技术对山药与麸炒山药的化学差异进行了比较,结合多元统计分析、t检验以及R-SVM分析结果,可以看出山药与麸炒山药存在显著的化学差异,山药中丙氨酸、谷氨酰胺及苹果酸的含量较高,麸炒山药中异亮氨酸、亮氨酸、蔗糖、α-葡萄糖、γ-氨基丁酸、天冬酰胺、酪氨酸及苯丙氨酸的含量较高。在中医临床中,山药的功效以补肾涩精、益肺敛阴为主,而麸炒山药以补脾健胃为主。本研究确定的山药与麸炒山药的差异成分与功效差异的相关性值得进一步深入研究。此外,本研究发现不同麸炒山药之间的化学组成差异较大,而山药之间的差异较小,说明炮制工艺对麸炒山药的影响较大。麸炒山药是中医临床常用中药,为了保证临床用药的安全有效,应进一步规范麸炒山药的炮制工艺,保证中药饮片质量的均一稳定。
在植物代谢组学分析中,核磁共振的优势体现在所检测化学成分的类型较全面,可以检测含有氢原子的大多数化合物,尤其适合于在液相色谱柱上不保留的强极性成分和无紫外吸收的化学成分。此外,代谢组学技术的核心是数据的预处理方法和统计方法的正确选择和应用。多种分析手段将产生海量数据,如何在数据分析中剔除冗余信息,以及如何有效整合多种分析技术产生的多维数据,及其预处理和统计分析均具有极大的难度[17]。因此将核磁共振技术与多种多元统计分析方法相结合,可以准确确定差异成分,发现样本之间的细微差异。综上所述,采用核磁共振代谢组学技术对中药材进行质量分析,不仅备样简单、分析时间短,而且可以多成分反映药材的化学组成信息,有望为中药材的质量控制提供新的思路。
[1] 国家药典委员会.中华人民共和国药典:一部[S].北京:中国医药科技出版社,2010:27.
[2] 赵宏,谢晓玲,万金志,等.山药的化学成分及药理研究进展[J].今日药学,2009,19(3):49-52.
[3] 华惠良,孔翠萍,于生,等.HPLC法测定山药不同炮制品中5-羟甲基糠醛及糠醛的含量[J].内蒙古中医药,2012,31(22):41.
[4] 杨连菊,冯学锋,杨京玉,等.生山药及麸炒山药的质量标准研究[J].中国中药杂志,2010,35(21):2846-2849.
[5] 王海波,蔡宝昌,李伟东.山药麸炒前后尿囊素含量的比较[J].南京中医药大学学报,2004,20(3):165-166.
[6] 徐旻,林东海,刘昌孝.代谢组学研究现状与展望[J].药学学报,2005,40(9):769-774.
[7] Jiang Y,Vavsse J,Gilard V,et al.Quality assessment of commercial Magnoliae officinalis Cortex by1H NMR-based metabolomics and HPLC methods[J].Phytochemical Analysis,2012,23:387-395.
[8] Yang S O,Shin Y S,Hyun S H,et al.NMR-based metabolic profiling and differentiation of ginseng roots according to cultivation ages[J].Journal of Pharmaceutical and Biomed-ical Analysis,2012,58:19-26.
[9] Chang W T,Choi Y H,Van der Heijden R,et al.Traditional processing strongly affects metabolite composition by hydrolysis in Rehmannia glutinosa roots[J].Chemical and Pharmaceutical Bulletin,2011,59(5):546-552.
[10] 王雪洁,李震宇,薛水玉,等.基于植物代谢组学技术的远志不同炮制品质量控制研究[J].中草药,2012,43(9):1727-1737.
[11] He P,Li Z Y,Xing J,et al.1H NMR based metabolic profiling of the processing effect on Rehmanniae Radix[J].Analytical Methods,2014,6(8):2736-2744.
[12] Zhi H J,Qin X M,Sun H F,et al.Metabolic Fingerprinting ofTussilagofarfaraL.Using1H NMR Spectroscopy and Multivariate Data Analysis[J].Phytochemical Analysis,2012,23(5):492-501.
[13] Jung J Y,Jung Y,Kim J S,et al.Assessment of Peeling of Astragalus Roots Using1H NMR-and UPLC-MS-Based Metabolite Profiling[J].Journal of agricultural and food chemistry,2013,61(43):10398-10407.
[14] 王连芝.蔓荆子药材的质量及其指纹图谱的研究[D].哈尔滨:黑龙江中医药大学,2003.
[15] 漆小泉,王玉兰,陈晓亚.植物代谢组学-方法与应用[M].北京:化学工业出版社,2011:304.
[16] Zhang X G,Lu X.Recursive SVM feature selection and sample classification for mass-spectrometry and microarray data[J].BMC Bioinformatics,2006,7(1):197-210.
[17] 李震宇,李爱平,张福生,等.植物代谢组学技术在山西道地药材研究中的应用[J].中草药,2013,44(7):785-789.
ComparisonofChemicalComponentsbetweenDioscoreaeRhizomaandDioscoreaeRhizomaPreparatausingNMRSpectroscopy
DONGTaishan1,HANXiaojing2*
(1.NCMSManagementCenterofGaoping,Jincheng048400,China;2.ShanxiPharmaceuticalCollege,Taiyuan030031,China)
Objective:To compare the chemical components of Rhizoma Dioscoreae(RD)and Rhizoma Dioscoreae Preparata(RDP),and provide a basis for quality evaluation.Methods:NMR-based metabolomic approach combined with cluster analysis,Principal component analysis(PCA)and some other multivariate statistical analysis were used to investigate the differential metabolites of RD and RDP.Results:Twenty-three metabolites were identified in the1H-NMR spectra,and the multivariate statistical analysis showed that RD and RDP could be separated clearly.RD contained more alanine,glutamaine,and marlic acid,while RDP more isoleucine,leucine,sucrose,α-glucose,GABA,asparagine,tyrosine and phenylalanine.Conclusion:The results revealed the chemical differences between RD and RDP in a holistic way,and provide a scientific basis for assessing the quality of RD and RDP.
Rhizoma Dioscoreae;Rhizoma Dioscoreae Preparata;NMR;multivariate statistical analysis
2014-11-06)
*
韩晓静,讲师,研究方向:中药活性成分、药材质量标准;Tel:(0351)2392535,E-mail:jitazhilian@126.com
10.13313/j.issn.1673-4890.2015.7.007

