软锰矿气固流态化两段焙烧制备锰酸钾
李斌,冯雅丽,李浩然
软锰矿气固流态化两段焙烧制备锰酸钾
李斌1,冯雅丽1,李浩然2
(1. 北京科技大学 土木与环境工程学院,北京,100083;2. 中国科学院 过程工程研究所 生化工程国家重点实验室,北京,100190)
针对锰酸钾的制备过程中碱与锰摩尔比和反应温度较高的问题,以低品位软锰矿为原料,采用马弗炉−石英流化床层二段焙烧工艺,制备锰酸钾的过饱和溶液。同时研究流化床中温度对锰转化率影响的动力学方程。研究结果表明:碱与锰摩尔比和流化床焙烧温度对锰转化率影响较大,最佳实验条件是碱与锰摩尔比为3.2:1,马弗炉焙烧时间为1 h,焙烧温度为400 ℃,流化床焙烧时间为2.5 h,焙烧温度为260 ℃,水汽流速为120 L/h,水汽温度为70 ℃;在此条件下,锰的转化率最高,可达94.4%。流化床反应的表观反应活化能为62.605 kJ/mol,反应速率受表面化学反应的控制。
软锰矿;气固流态化;锰酸钾
锰酸钾是高锰酸钾生产过程中必要的中间产品,其氧化物高锰酸钾在医药、石油、采矿以及生产用水和污水处理方面发挥着巨大的作用,生产高锰酸钾的第1步是制取锰酸钾,因此,其制取工艺就显得非常重要。目前,国内外生产锰酸钾的方法主要是固相法和液相法。固相法因其生产效率低(需耗时50~60 h),技术较落后且操作条件恶劣等因素逐渐被液相氧化法取代[1]。后者具有转化率高、能耗低和耗时短(4~6 h)的优点,且可处理含锰量稍低、硅量稍高的锰矿。但该体系碱与锰摩尔比高(5:1~15:1),在高温(300 ℃左右)下对设备的腐蚀性较强[1−3]。本文作者采用马弗炉−气固流化床两段焙烧工艺,首先在马弗炉中进行一段预氧化焙烧,再在持续通入高温水汽的流化床中进行二段焙烧,焙烧产物经碱浸、过滤后蒸发浓缩得到锰酸钾的过饱和溶液。与传统制备锰酸钾的方法相比,此工艺利用了流态化床层条件下气—固接触面积大、传热传质效率较高、反应速率较快的特点,进一步缩短了总反应时间(2~3 h)、降低了反应温度(260 ℃左右)和碱与锰摩尔比(3.2:1)。此外,目前工业上制备锰酸钾所用的锰矿中二氧化锰的品位多在55%以上,而本试验所用原料成分复杂且品位更低,这为高锰酸钾工业原料的适用范围拓展了更广阔的空间。
1 试验
1.1 试验原料
试验所用原料来自贵州某地锰矿,其主要化学多元素分析及X线衍射分析分别见表1和图1。

表1 原料的主要化学多元素分析结果(质量分数)
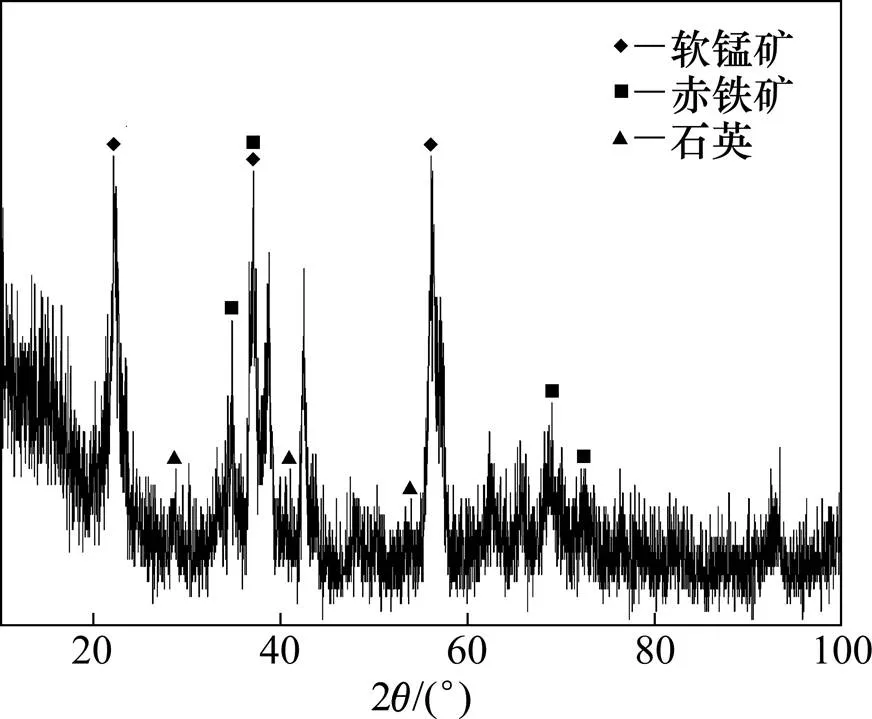
图1 原矿X线衍射图
从表1和图1可以看出:该矿物中的主要成分为软锰矿,杂质的主要成分为赤铁矿和石英。
1.2 试验流程及原理
试验流程图如图2所示。
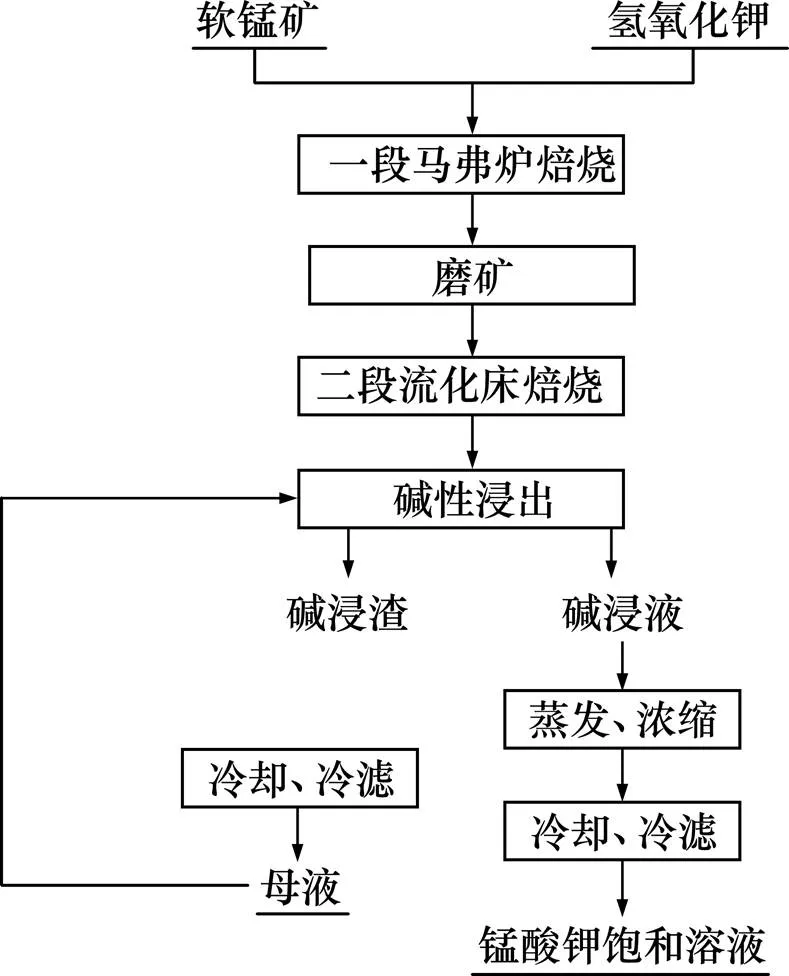
图2 试验流程图
软锰矿氧化制备锰酸钾的过程较为复杂,一般认为是锰由四价逐步氧化成六价的过程,反应第1步是MnO2活化为K2MnO3:
MnO2+2KOH=K2MnO3+H2O (1)
K2MnO3不稳定,会立刻发生自身的氧化还原反应,分解生成K2MnO4和MnO[4−6]。暴露在空气中的MnO很快会被氧化生成MnO2,从而继续参与反应。另一方面,K2MnO3也可以被直接氧化生成K2MnO4:
K2MnO3+[O]=K2MnO4(2)
随后,生成的K2MnO4也会同MnO2发生氧化还原反应,生成五价的K3MnO4:
K2MnO4+MnO2+4KOH=2K3MnO4+2H2O (3)
而五价的K3MnO4在氧气充足的条件下,会被氧化生成六价的K2MnO4[7]:
2K3MnO4+H2O+[O]=2K2MnO4+2KOH (4)
总反应式为
2MnO2+4KOH+O2=2K2MnO4+2H2O (5)
1.3 试验设备
主要试验设备为SX2-4-10箱式马弗炉、XMB-70型三辊四筒棒磨机、SG2-15-12FB流化床电阻炉、石英流化床、DF-101S集热式恒温加热磁力搅拌器、DZF-6020型真空干燥箱、SHZ-DⅢ型循环水式多用真空泵、DK-98-II电子万用电炉。流化床设备示意图如图3所示。

1—加湿装置;2—流化床电阻炉;3—石英流化床;4—温度控制器;5—除尘装置
1.4 实验方法
将原料在棒磨机中磨细至粒径小于74 μm占95%左右,每次量取20 g矿样,加入一定量分析纯氢氧化钾,充分混匀后于马弗炉中进行一段焙烧,取出后经棒磨机磨细至小于74 μm的颗粒质量分数占50%以上,加入流化床中进行二段焙烧,并持续通入一定量的高温水蒸气,待产物冷却后用100 g/L的氢氧化钾溶液溶解并真空过滤,滤液经蒸发浓缩得到锰酸钾的过饱和溶液。
2 结果与讨论
2.1 碱与锰摩尔比对锰转化率的影响
试验条件:选取碱与锰摩尔比分别为(2.8:1,3.0:1,3.2:1,3.4:1,3.6:1),在马弗炉中焙烧1 h,取出磨细后加入流化床中焙烧2.5 h,考察最终锰转化率的变化情况,其结果如图4所示。
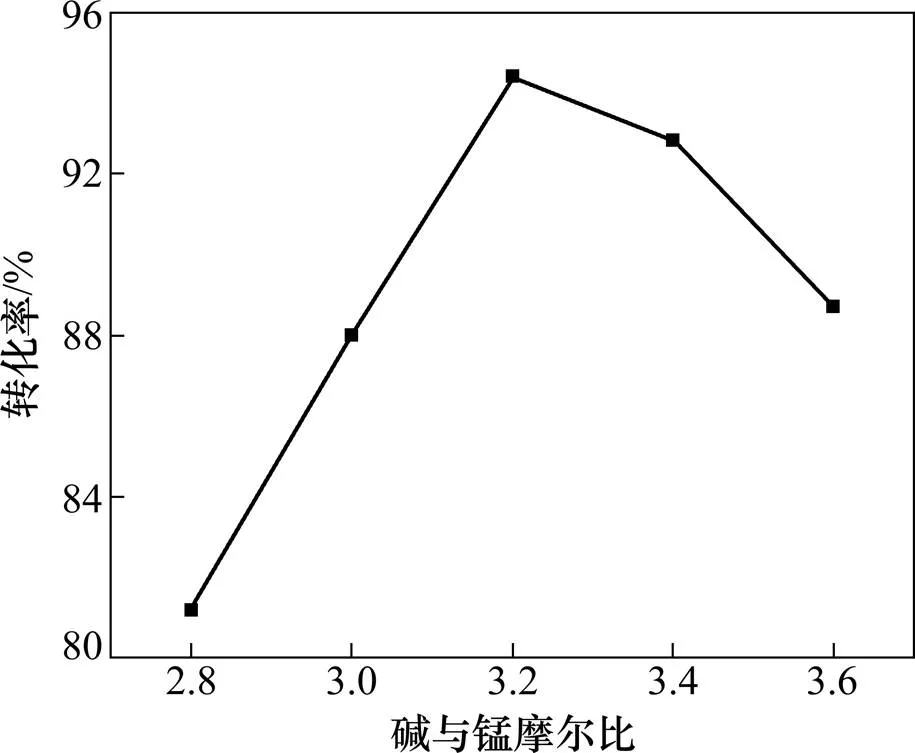
图4 碱与锰摩尔比对锰转化率的影响
软锰矿制备锰酸钾试验的关键在于MnO2中4价锰的活化条件。K2MnO4为暗绿色晶体,在640~680℃可分解为Mn3O4,O2和K2O[8]。在碱性溶液中MnO4−能被OH−还原成MnO42−,并放出O2,反应式如下:
4 MnO4−+4OH−→4MnO42−+O2+2H2O (6)
在强碱环境中MnO4−不稳定[9],碱溶法只可将MnO2氧化为MnO42−,不能直接氧化为MnO4−。由图4可知:当碱与锰摩尔比较低时,焙烧后的锰转化率不高,只有80%左右,在碱与锰摩尔比为3.2:1时,锰转化率达到最高,为94.4%,其后随着碱量进一步加大,锰转化率呈快速下降趋势。其主要原因可能是当碱与锰摩尔比较低时,低浓度的碱在床层中流动性受到限制,会抑制反应的继续进行;当碱与锰摩尔比过高时,床层中已生成的K2MnO4会与过量的氢氧化钾反应生成复盐K2MnO3·3K2O(见式(7)),复盐的生成降低了K2MnO4的产量[10−11];另一方面,过量的氢氧化钾在流化床高温水蒸汽混合的气氛中极易吸水黏结在石英管壁和床层底部,造成床层堵塞,流化效果差,使得锰的转化率进一步降低。
2K2MnO4+6KOH=2K2MnO3·3K2O+3H2O+O2(7)
图4所示曲线呈倒V型,说明在一定范围内增加碱浓度对反应有利,但碱浓度过高时对设备的腐蚀也更严重,说明碱与锰摩尔比对锰转化率的影响较大。
2.2 马弗炉焙烧时间和温度对锰转化率的影响
选取碱与锰摩尔比为3.2:1,在马弗炉300,350,400,450和500 ℃的条件下分别反应0.5,1.0,1.5,2.0和2.5 h,再将产物磨细后加入流化床中反应,最终锰的转化率如图5所示。
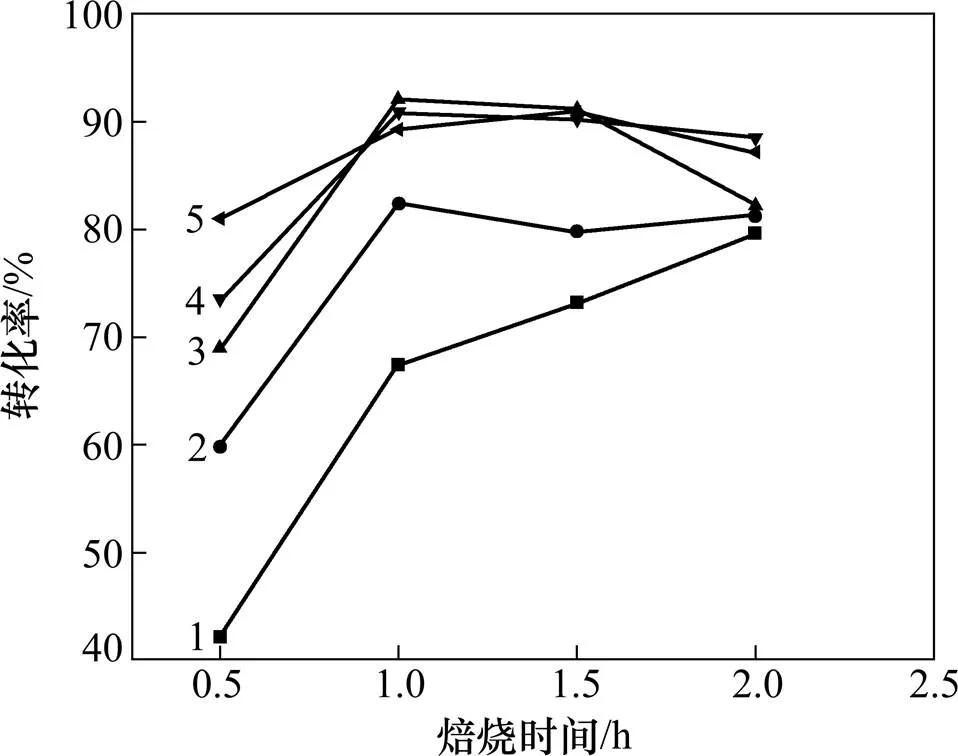
温度/℃:1—300;2—350;3—400;4—450;5—500
由图5可知:在不同温度下,焙烧时间由0.5 h增加到1.0 h,锰转化率均有较大幅度的增加,反应物中的水分大量蒸发,促进了反应(1)的进行;当焙烧时间超过1.0 h后,锰转化率基本保持稳定。此时炉内氧气和水分已基本耗尽,故反应(1)和(2)已基本停滞,而反应(3)生成的K3MnO4也无法被进一步氧化成K2MnO4。进一步延长焙烧时间,考察锰转化率随焙烧温度的变化,发现温度由300 ℃升至400 ℃过程中,锰转化率有大幅度的增加;在温度超过400 ℃时,增幅不明显。故选择焙烧温度为400 ℃,焙烧时间为1.0 h较为合适,此时锰转化率约为92.1%。
2.3 流化床水汽流速和温度对锰转化率的影响
研究结果表明:增大流化床中的水汽流速可显著提高锰的转化率[12]。在熔融氢氧化钾的环境下,MnO2中四价锰的活化温度为230~270 ℃,生成的K2MnO3开始活化,其后的一系列反应还需要供给足够的有效氧和过量的氢氧化钾,并在一定量水分环境下才能使反应顺利进行[13−14]。将碱与锰摩尔比为3.2:1,马弗炉焙烧400 ℃,1.0 h后的反应物磨细,加入流化床中反应,调节水汽流速分别为60,80,100,120,140和160 L/h,水汽温度分别为50,60,70和80 ℃,锰的转化率见图6。
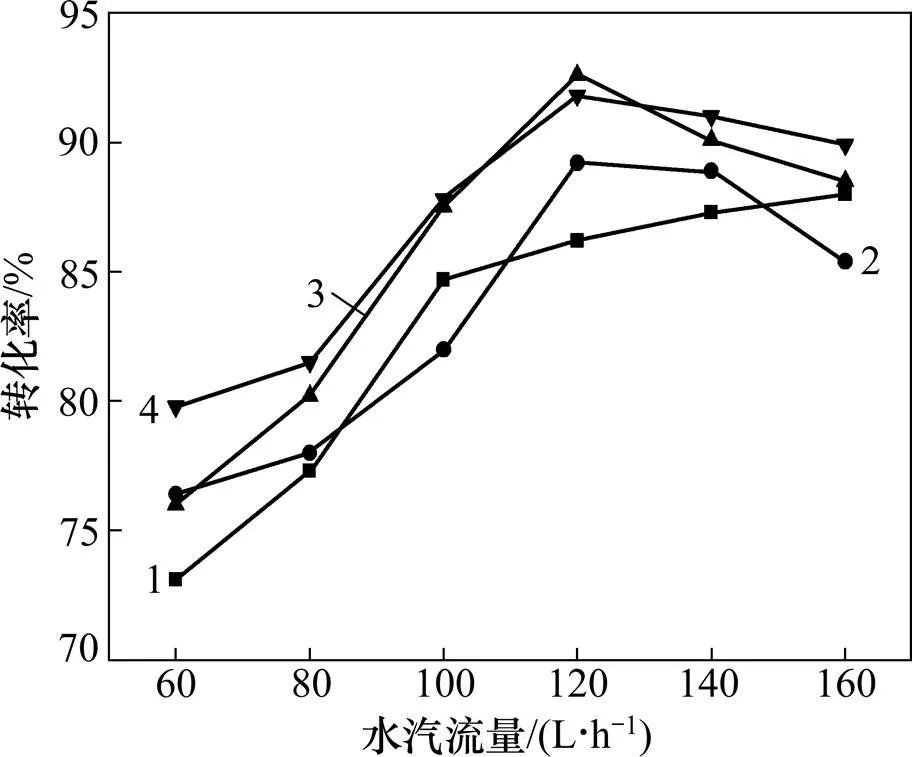
温度/℃:1—50;2—60;3—70;4—80
由图6可以看出,随着水汽流速的增加,锰转化率的增速也不断变大,在水汽流速为120 L/h左右时达到最大值92.9%,锰转化率开始逐渐下降。反应初期生成的K2MnO4和过量未反应的氢氧化钾生成复盐K2MnO3·3K2O(式(7))。水汽流速过高时,在高温下,流态化床层中复盐可再次转化为锰酸钾(式(8)),水分子沿颗粒缝隙进入床层内部,扩大了孔隙度,使物料与空气的接触面积增大,提高了反应速率。当水汽流速大于120 L/h时,部分K2MnO4分子被气泡包裹,阻碍了其与水分子的接触,同时少量K2MnO4分子被水蒸气带出,使得锰转化率降低。由此可知水汽流速对锰转化率的影响较大,应选取120 L/h左右较适宜。
2K2MnO3·3K2O+3H2O+2[O]→2K2MnO4+6KOH (8)
由图6还可以看出,水汽温度由50 ℃升至70 ℃的过程中,锰转化率增长较快,而70 ℃以后则趋于平缓,因此,水汽温度应选择70 ℃较适宜。
2.4 流化床焙烧温度对转化率的影响
将碱与锰摩尔比为3.2:1,马弗炉焙烧400 ℃,1 h后的反应物磨细,调节水汽流速为120 L/h,水汽温度为70 ℃,在流化床焙烧温度分别为220,240,260,280和300 ℃的条件下,最终锰转化率如图7所示。

图7 二段焙烧温度对锰转化率的影响
由图7可以看出:当温度由220 ℃升至260 ℃时,锰转化率由82.8%升至92.4%,这可能是由于温度升高使化学反应速度加快,单位时间内分子之间的有效碰撞机会也随之增多。当温度过高时,细粒物料在床层内已经烧结成块,流动性有所降低,氧气向反应界面扩散的阻力逐渐增加,锰的吸氧速率随之降低,因而锰转化率略有降低,最终保持稳定。因此,选择流化床焙烧温度在260 ℃左右比较合适。
2.5 流化床焙烧时间对锰转化率的影响
将碱与锰摩尔比为3.2:1,马弗炉焙烧400 ℃,1.0 h后的反应物磨细,调节水汽流速为120 L/h,水汽温度为70 ℃,流化床焙烧温度为260 ℃,选取焙烧时间分别为1.0,1.5,2.0,2.5和3.0 h,锰转化率如图8所示。

图8 二段焙烧时间对锰转化率的影响
由图8可知:在流化床中加热1.5 h后,锰的转化率可达到80%以上,随着时间的延长,转化率继续缓慢增长,至2.5 h后逐渐趋于稳定。将产物用100 g/L的氢氧化钾溶液溶解后过滤,滤液经蒸发浓缩后得到锰酸钾的过饱和溶液,其中锰酸钾的质量浓度为173 g/L。此时反应(4)已基本完成。若继续反应,床层内部伴随其发生可逆反应:
3MnO42−+2H2O→MnO2+2MnO4+4OH−(9)
在此反应中,MnO42−歧化生成MnO2和MnO4−,使得产率下降。同时,KOH在过量的情况下也对此可逆反应有抑制作用。
3 流化床反应动力学
对于流化床中发生的主要反应式为
2MnO2(s)+4KOH+O2(g)→2K2MnO4+2H2O (10)
本研究拟采用固体产物层生成的致密固体与气体间的反应来研究流化床反应中温度对二氧化锰转化率的影响[15]。对于级不可逆反应,相应的速率方程为:
式中:为二氧化锰的转化率;r为反应的速率常数;C,b为级不可逆反应中气体反应物在气流主体表面处的浓度,mol/cm3;和分别为反应式(10)中气体与固体反应物的系数;为固体反应物的浓度,mol/m3;0为颗粒半径,为反应时间,h。
在流化床的氧化过程中,令
其中:′为表观速率常数。则式(11)可变为
将式(13)中左边用表示:
在研究流化床中温度对二氧化锰转化率的影响时,该动力学研究应保证氧化过程中反应物浓度、反应温度、水汽流速、水汽温度等条件恒定的状态。
阿伦尼乌斯公式[15]阐述了恒定浓度下的反应体系中反应温度与反应速率的关系:
式中:为反应速率常数;为频率因子;为摩尔气体常数;为反应的活化能,kJ/mol;为反应温度。
对式(15)两边取对数,得
由式(12)得
以ln′对1/作图得1条直线,由直线斜率为−/可求出反应的活化能。
在碱与锰摩尔比为3.2:1、马弗炉焙烧400 ℃下反应1.0 、二段焙烧水汽流速为120 L/h、水汽温度为70 ℃的条件下,流化床焙烧温度对二氧化锰转化率的影响如图9所示。
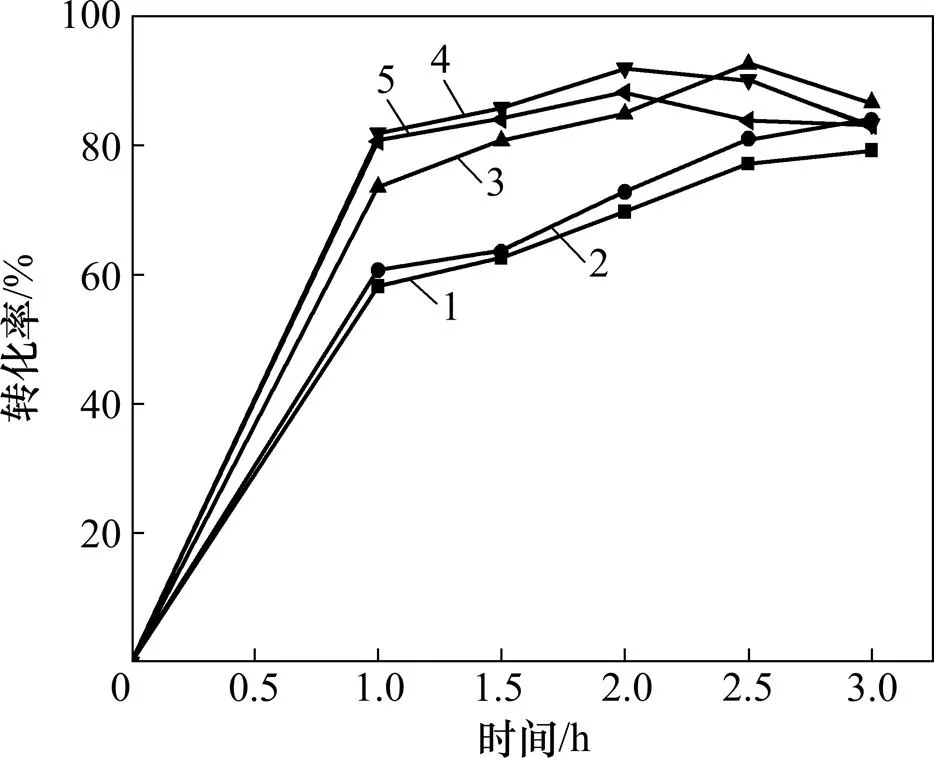
温度/℃:1—220;2—240;3—260;4—280;5—300
将图9结果用式(13)处理,结果如图10所示。
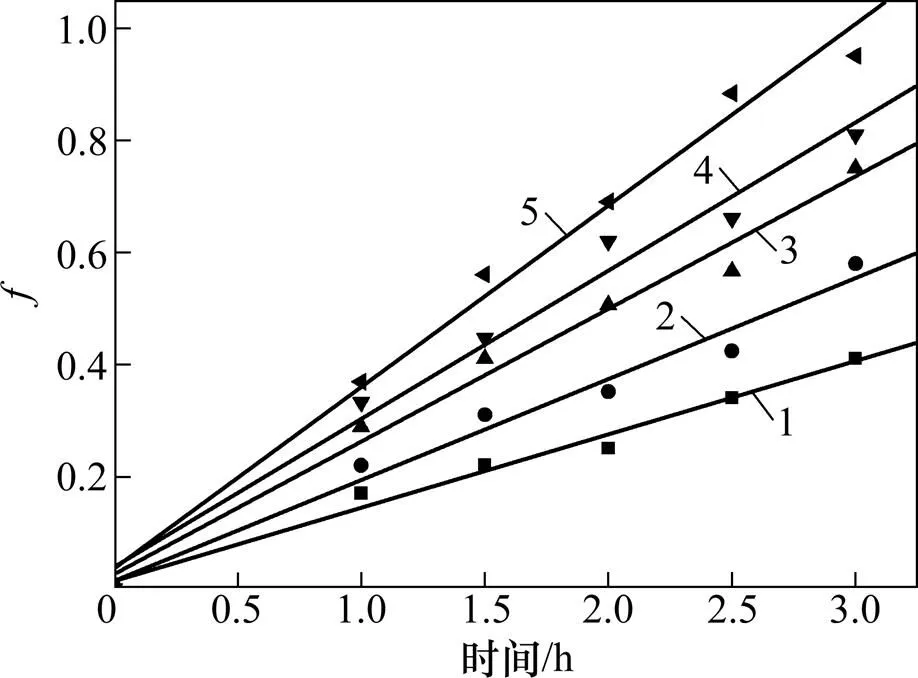
1—220 ℃时f=0.136x;2—240 ℃时f=0.187x;3—240 ℃时f=0.253x;4—280 ℃时f=0.298x;5—300 ℃时f=0.345x
图9和图10的结果表明,流化床焙烧温度对二氧化锰的转化率影响较大,升高温度可显著提高锰的转化率。以不同温度下ln′对1/作图,结果如图11所示。
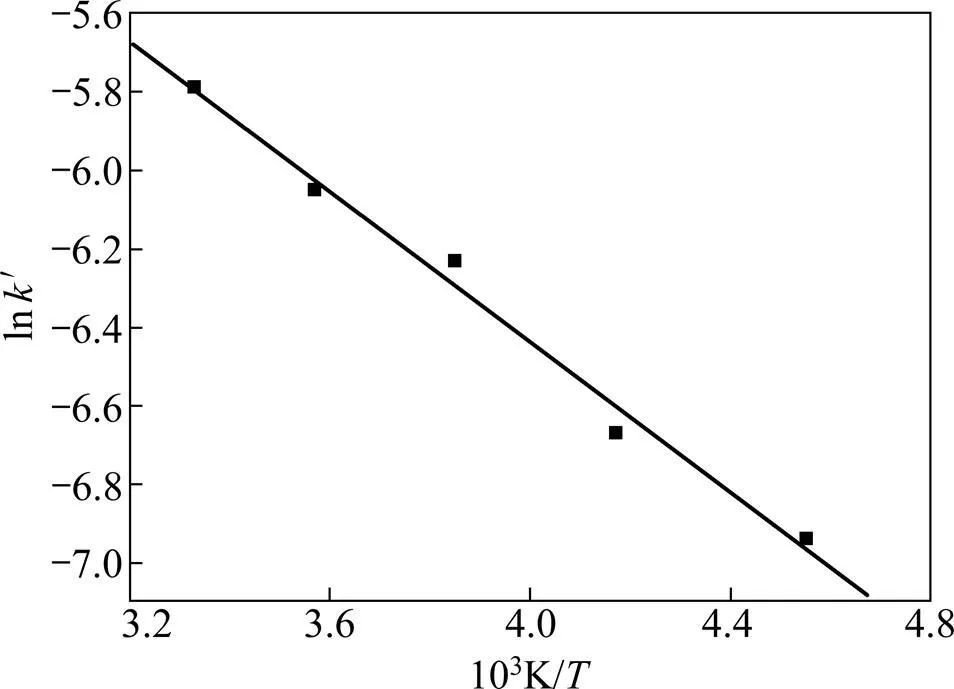
图11 ln k′与1/T关系图
由图11直线斜率可求得流化床反应中表观活化能= 62.605 kJ/mol,根据杨显万等[16]提出的反应速率判据(>42 kJ/mol)可进一步判断该氧化过程受表面化学反应控制。据图11结果可建立流化床温度对二氧化锰转化率影响的动力学方程为
4 结论
1) 通过单因素试验对转化条件进行了优化,最优条件为碱与锰摩尔比3.2:1,一段马弗炉焙烧温度 400 ℃,焙烧时间1.0 h,二段流化床焙烧温度260 ℃,焙烧时间2.5 h,水汽流速120 L/h,水汽温度70 ℃。在此条件下软锰矿的转化率最高可达94.4%。经碱浸蒸发浓缩制得的锰酸钾过饱和溶液质量浓度为 173 g/L。
2)气固流态化两段焙烧制备锰酸钾的主要影响因素是碱与锰摩尔比和流化床焙烧温度。其中,碱与锰摩尔比较低时会使床层的流动性变差,若过高则会有复盐K2MnO3·3K2O生成,同时极易造成床层堵塞并黏结;在一定温度范围内升高流化床的温度可显著提高锰转化率。
3) 在流化床焙烧过程中,适宜的水汽流速会增大床层的孔隙度和接触面积,防止K2MnO4分子被水蒸气带出。
4)流化床焙烧温度对锰转化率影响较为显著。流化床反应的表观活化能=62.605kJ/mol,反应速率受表面化学反应控制,温度对锰转化率影响的动力学方程为。
[1] 徐静, 王吉坤, 彭东. 低压制备锰酸钾的正交实验研究[J]. 矿冶, 2010, 19(4): 68−71.
XU Jing, WANG Jikun, PENG Dong. Orthogonal test of preparation potassium manganate during low pressure[J]. Mining and Metallurgy, 2010, 19(4): 68−71.
[2] 王纪学. 云南某低品位软锰矿的回收及深加工利用研究[D]. 北京: 北京科技大学土木与环境工程学院, 2011: 82−120.
WANG Jixue. The research of recycling and deep processing of a low grade pyrolusite from Yunnan[D]. Beijing: University of Science and Technology Beijing. School of Civil and Environmental Engineering, 2011: 82−120.
[3] 彭东, 王吉坤. 三相加压氧化制备锰酸钾的反应动力学[J]. 硅酸盐学报, 2012, 40(12): 1767−1772.
PENG Dong, WANG Jikun. Reaction kinetics of potassium manganate prepared by three-phase compression oxidation process[J]. Journal of the Chinese Ceramic Society, 2012, 40(12): 1767−1772.
[4] Pagnanelli F, Furlani G, Valentini P, et al. Leaching of low-grade manganese ores by using nitric acid and glucose optimization of the operating conditions[J]. Hydrometallurgy, 2004, 75(1/2/3/4): 157−167.
[5] Sahoo R N, Naik P K, Das S C. Leaching of manganese ore using oxalic acid as reductant in sulphuric acid solution[J]. Hydrometallurgy, 2001, 62(3): 157−163.
[6] 瞿仁静. 低品位锰矿液相法生产锰酸钾技术[J]. 环境科学导刊, 2010, 29(S2): 1−3.
QU Renjing. Summary on technology of low-grade manganese liquid method producing potassium permanganate[J]. Environmental Science Survey, 2010, 29(S2): 1−3.
[7] 户少勇, 王吉坤. 高压釜制备锰酸钾小型试验[J]. 有色金属(冶炼部分), 2010(4): 52−54.
HU Shaoyong, WANG Jikun. The small-scale research for autoclave preparation manganese acid potassium[J]. Nonferrous Metals (Smelting Part), 2010(4): 52−54.
[8] Ahmad S, Peiman M, Soheila N, et al. Green oxidations. The use of potassium permanganate supported on manganese dioxide[J]. Tetrahedron, 2004, 60(5): 11415−11420.
[9] 大连理工大学无机化学教研室. 无机化学[M]. 北京: 高等教育出版社, 2001: 129−138.
Inorganic Chemistry Department of Dalian University of Technology. Inorganic chemistry[M]. Beijing: Higher Education Press, 2001: 129−138.
[10] Becerra M E, Arias N P, Giraldo O H, et al. Soot combustion manganese catalysts prepared by thermal decomposition of KMnO4[J]. Applied Catalysis B: Environmental, 2011, 102: 260−266.
[11] Sorensen B, Gaal S, Ringdalen E. Phase composition of manganese ores and their change in the process of calcinations[J]. International Journal of Mineral Processing, 2010, 94(3/4): 101−110.
[12] Ghafari S, Aziz H A, Isa M H, et al. Application of response surface methodology to optimize coagulation flocculation treatment of leachate using poly-aluminum chloride and alum[J]. Journal of Hazardous Materials, 2009, 163(2/3): 650−656.
[13] Bafghi A, Zakeri, Zl Ghasemi, et al. Reduction dissolution of manganese ore in sulfuric acid in the presence of iron metal[J]. Hydrometallurgy, 2008, 90(4): 207−212.
[14] Hariprasad D, Dash B, Ghosh M K, et al. Leaching of manganese ores using sawdust as a reductant[J]. Mineral Engineering, 2007, 20(1): 293−295.
[15] 华一新. 冶金过程动力学导论[M]. 北京: 冶金工业出版社, 2004: 148−153.
HUA Yixin. An introduction to metallurgical process dynamics[M]. Beijing: Metallurgical Industry Press, 2004: 148−153.
[16] 杨显万, 邱定蕃. 湿法冶金[M]. 北京: 冶金工业出版社, 1998: 164−211.
YANG Xianwan, QIU Dingfan. Hydrometallurgy[M]. Beijing: Metallurgical Industry Press, 1998: 164−211.
Gas-solid fluidized two-stage roasting of pyrolusite for preparation of potassium manganate
LI Bin1, FENG Yali1, LI Haoran2
(1. School of Civil and Environmental Engineering, University of Science and Technology Beijing, Beijing 100083, China;2. National Key Laboratory of Biochemical Engineering, Institute of Process Engineering,Chinese Academy of Sciences, Beijing 100190, China)
To solve the problem of higher alkaline-manganese mole ratio and reaction temperature in the preparation of the potassium permanganate, using low grade pyrolusite as raw materials, supersaturated solution of potassium permanganate was prepared by the two-stage roasting in the muffle furnace and the quartz fluidized bed. The kinetics of the impact of temperature in fluidized bed on the conversion rate of manganese was studied. The results show that the alkali manganese mole ratio and roasting temperature of fluidized bed have greater influence on the conversion, the highest conversion rate of manganese reaches 94.4% under the best experimental conditions of the molar ratio of alkaline manganese of 3.2:1, the time of the muffle furnace of 1 h, the temperature of the first roasting of 400 ℃,the time of the fluidized bed of 2.5 h, the temperature of the first roasting of 260 ℃, the moisture flow rate of 120 L/h, and the moisture temperature of 70 ℃. The apparent reaction activation energy for this reaction is 62.605 kJ/mol, and the reaction rate is controlled by the surface chemical reaction.
pyrolusite; gas-solid fluidized; potassium manganate
TF792
A
1672−7207(2015)02−0379−07
2014−02−13;
2014−04−20
国家自然科学基金资助项目(21176026,21176242);中国大洋矿产资源研究开发计划项目(DY125-15-T-08);国家高技术研究发展计划(863计划)项目(2012AA062401)(Projects (21176026, 21176242) supported by the National Natural Science Foundation of China; Project (DY125-15-T-08) supported by the China Ocean Mineral Resources Research & Development Program; Project (2012AA062401) supported by the National High-Tech Research & Development Program (863 Program))
李浩然,博士,从事非传统的资源利用研究;E-mail:hrli@home.ipe.ac.cn
10.11817/j.issn.1672-7207.2015.02.001
(编辑 赵俊)

