飞机草总黄酮体外抑菌活性与体内抗大肠埃希菌感染效果
郑锦庆,王小宁,岳 杰,马 驿,巨向红,林红英,陈进军
(广东海洋大学农学院,广东 湛江 524088)
飞机草总黄酮体外抑菌活性与体内抗大肠埃希菌感染效果
郑锦庆,王小宁,岳杰,马驿,巨向红,林红英,陈进军
(广东海洋大学农学院,广东湛江524088)
提取飞机草(Eupatorium odoratum Linn.)总黄酮,从抑菌圈、最小抑菌浓度(MIC)及最小杀菌浓度(MBC)等方面探讨飞机草总黄酮对金黄色葡萄球菌(Staphylococcus aureus)、鸡白痢沙门氏菌(Salmonella pullorum)、枯草芽孢杆菌(Bacillus subtilis)、大肠埃希菌(Escherichia coli)的体外抑菌活性;经腹腔注射大肠埃希菌感染小鼠后,灌胃给予飞机草总黄酮,观察供试小鼠腹泻率,测定小鼠粪便大肠埃希菌数及血清抗体水平(IgM、IgA和IgG),评价飞机草总黄酮的体内抗感染作用。结果表明,金黄色葡萄球菌对飞机草总黄酮最为敏感,其抑菌圈直径为19.50 mm,MIC为0.015 6 g/mL,MBC为0.031 3 g/mL;160 mg/kg的飞机草总黄酮可降低小鼠腹泻率和粪便大肠埃希菌数(P < 0.01),提高血清IgA(P < 0.01)和IgG含量(P < 0.05)。飞机草总黄酮具有体内、体外抗菌作用。
飞机草;总黄酮;体外抑菌;体内抗感染
飞机草(Eupatorium odoratum Linn.)别名香泽兰,为菊科泽兰属多年生草本植物,原产中美洲,1934年在我国云南南部发现。飞机草作为外来物种,对自然环境危害严重,目前已入侵我国南方大部分地区,是一种具有竞争性的有害物种。迄今从飞机草中分离、鉴定出的化学成分以黄酮类、萜类、挥发油和植物甾醇类为主,其中黄酮类化合物含量尤为丰富,全草总黄酮质量分数达2.07%,无水乙醇浸膏中总黄酮质量分数达12.57%[1]。飞机草具有抑菌、消炎、解毒、促进伤口愈合等功效[2-4],且其多种药效证明与其所含黄酮类化合物有关[5]。对飞机草进行兽医药效学研究是将其“变害为宝”的有益尝试。本研究制备飞机草总黄酮,探讨其体外抑菌活性及体内抗大肠埃希菌感染效果,为飞机草总黄酮提取物用于畜禽腹泻控制提供试验依据。
1 材料与方法
1.1菌种与培养基
金黄色葡萄球菌(Staphyloccocus aureus)(ATCC 25923)、鸡白痢沙门氏菌(Salmonella pullorum)(ATCC14028)、大肠埃希菌(Escherichia coli)(CMCC44752)、枯草芽孢杆菌(Bacillus subtilis)[CMCC(B) 63501]由广东海洋大学兽医微生物教研室提供。LB营养肉汤、营养琼脂及麦康凯培养基购自北京陆桥技术有限责任公司。
1.2动物
昆明种清洁级小鼠,雌雄各半,体质量20 ~ 23 g。
1.3主要仪器与试剂
主要仪器有生化培养箱(LRH-150B,上海博迅实业有限公司医疗设备厂)、医用净化工作台(YJ-875DA,上海博讯实业有限公司医疗设备厂)、旋转蒸发器(RE-52AA,上海亚荣生化仪器厂)、KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司)、循环水多用真空泵(SHZ-Ⅱ,河南巩义市英峪予华仪器厂)、酶标仪(MK3型,美国Thermo公司)等。ELISA试剂盒购自上海泛柯实业有限公司,其他试剂均为分析纯。
1.4细菌悬液制备
将菌种接种于营养琼脂培养基上,37 ℃条件下培养16 h,挑取单个菌落接种至肉汤培养基,37℃条件下培养16 h后,用平板计数法计数,用肉汤稀释至107~ 109cfu/mL备用。
1.5飞机草总黄酮制备
将采自广东湛江湖光岩的飞机草阴干,粉碎,过孔径150 μm筛,于4 ℃条件下保存。参考杨逄建等方法[1],以总黄酮为提取目标物,取飞机草粉10 g,置于旋转蒸发仪梨型蒸发器中,加入500 mL体积分数60%乙醇,浸泡24 h后将其置于超声波清洗器中,以频率20 kHz提取30 min后将提取液安装到旋转蒸发仪上在70℃下减压蒸发进行提取4 h,同时打开冷凝阀门回收乙醇。提取液冷却,过滤,得飞机草黄酮化合物提取液。将飞机草总黄酮提取液用10倍体积的石油醚萃取,除去叶绿素,再用乙酸乙酯萃取纯化,挥发去乙酸乙酯,得纯化的总黄酮浸膏,密封,于4 ℃冰箱内保存备用。经定性检测[6],该提取物中黄酮类化合物显色反应为强阳性,而其他生物活性成分如生物碱等均为阴性。以芦丁为标准品,利用分光光度法[7]定量测得该提取物含总黄酮质量分数为18.84%。
1.6飞机草总黄酮体外抑菌试验
抑菌圈测定:采用打孔法测定抑菌圈直径[8]。
最小抑菌浓度(MIC)测定:采用试管倍比稀释法,每个菌种3个重复。
最小杀菌浓度(MBC)测定:将上述培养物继续培养至48 h,接种于普通琼脂平板上,培养8~12 h后观察,无细菌生长的最小药物浓度即为该药物的最小杀菌浓度(MBC)[9]。
1.7飞机草总黄酮体内抗感染试验
将90只试验小鼠分为空白对照组,飞机草总黄酮高、中、低剂量组,自愈组等5个组,每组18只小鼠。高、中、低剂量组(160、40、10 mg/kg):小鼠腹腔注射约3×108个大肠埃希菌后3 h开始给高、中、低剂量组小鼠灌胃给予不同剂量的飞机草黄酮,每天1次;自愈组小鼠只用大肠埃希菌腹腔注射感染,不作任何处理;空白对照组小鼠用生理盐水代替飞机草总黄酮和大肠埃希菌悬液。每天观察粪便,计算腹泻率,于感染大肠埃希菌后1、4、7 d无菌采集小鼠粪便,对大肠埃希菌计数,并采集小鼠血清,用ELISA法测定血清抗体IgM、IgA、IgG含量。
1.8数据统计分析
数据采用SPSS 17.0软件中的ANOVA程序进行方差分析,多重比较用LSD法,P < 0.05为显著水平,结果以平均值±标准差(SD)表示。
2 结果与分析
2.1供试细菌对飞机草总黄酮的药物敏感性
飞机草总黄酮对4种供试细菌的抑菌圈均大于10 mm,达中度敏感以上。其中对金黄色葡萄球菌的抑菌活性最强,抑菌圈直径达19.50 mm;对大肠埃希菌的抑菌活性最弱,抑菌圈直径为11.00 mm,达中度敏感(表1)。

表1 飞机草总黄酮(0.5 g/mL)对4种细菌的抑菌活性Table 1 Bacteriostatic activity of flavonoids ( 0.5 g/mL ) from Eupatorium odoratum against 4 strains of bacteria
2.2飞机草总黄酮对供试细菌的MIC、MBC
飞机草总黄酮对金黄色葡萄球菌的MIC、MBC最低,分别为0.015 6、0.031 3 g/mL,说明飞机草总黄酮对金黄色葡萄球菌具有良好的体外抑菌效果(表2)。

表2 飞机草总黄酮对4种细菌MIC、MBC值Table 2 MIC and MBC of flavonoids from Eupatorium odoratum against four strains of bacteria g/mL
2.3飞机草总黄酮对小鼠腹泻率的影响
由图1可见,感染大肠埃希菌1 d,除空白对照组,其他各组供试小鼠的腹泻率均为100%;攻毒2、3、4 d时,高剂量组腹泻率均为最低,分别为58.33%、25%、8.33%;攻毒5 d后各组腹泻率为0。可见一定剂量的飞机草总黄酮可有效降低大肠埃希菌感染小鼠的腹泻率。
2.4飞机草总黄酮对小鼠粪便大肠埃希菌数的影响
由表3可知,攻毒1 d后,各处理组粪便大肠埃希菌数高于对照组,高剂量组低于中、低剂量组及自愈组,差异均有统计学意义(P < 0.01)。攻毒4 d时,各处理组大肠埃希菌数高于对照组,差异有统计学意义(P < 0.05),高剂量组低于中、低剂量组及自愈组,差异有统计学意义(P < 0.01)。攻毒7 d后,高剂量组与对照组差异无统计学意义(P > 0.05),中、低剂量组及自愈组与对照组差异有统计学意义(P < 0.01)。由此可见,飞机草总黄酮对小鼠肠道内大肠埃希菌具有一定的抑菌作用,高剂量总黄酮抑菌效果最佳。
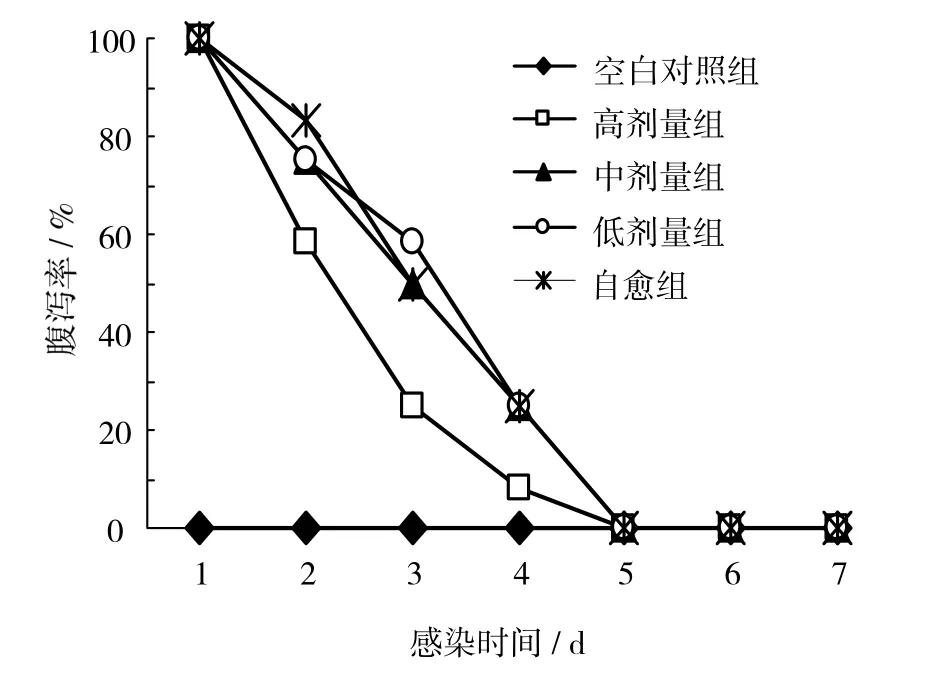
图1 飞机草总黄酮对小鼠腹泻率的影响Fig. 1 Effect of flavnoids from Eupatorium odoratum on ratio of diarrhea in rat
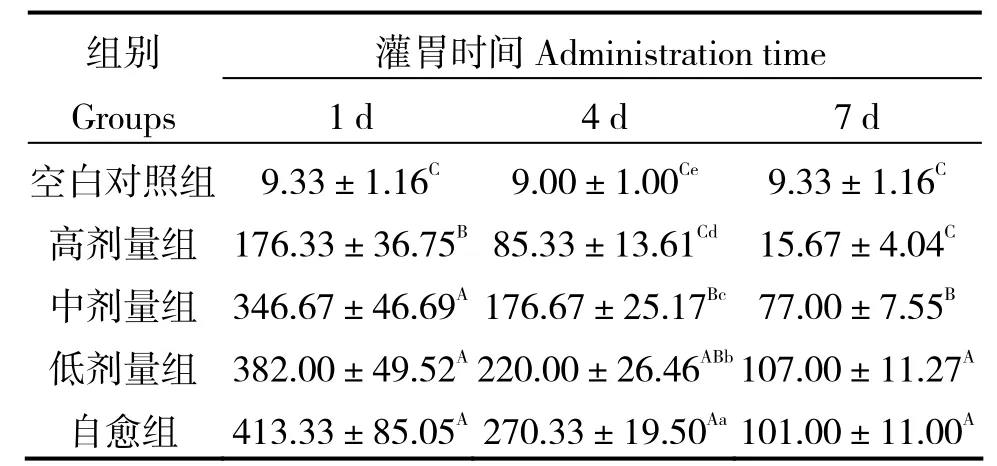
表3 飞机草总黄酮对小鼠粪便大肠埃希菌数的影响Table 3 Effect of flavonoids from Eupatorium odoratum on number of Escherichia coli 107cfu/g
2.5飞机草总黄酮对小鼠血清抗体水平的影响
由表4可知,攻毒1 d时,各组间IgM含量差异无统计学意义(P > 0.05)。攻毒4 d时,各处理组IgM含量高于对照组,差异有统计学意义(P < 0.05),但处理组间差异无统计学意义(P > 0.05)。攻毒7 d后,各组间IgM含量差异无统计学意义(P > 0.05)。由此可见,一定剂量的飞机草总黄酮可提升小鼠血清IgM水平,但持续时间小于7 d。
由表4可知,攻毒1 d,各组间IgA含量与对照组差异无统计学意义(P > 0.05)。攻毒4 d,与对照组相比,处理组IgA含量升高,差异有统计学意义(P < 0.01),但处理组间差异无统计学意义(P > 0.05)。攻毒7 d后,处理组IgA含量稍有下降,但仍高于对照组,差异有统计学意义(P < 0.01),高剂量组高于中、低剂量组及自愈组,差异有统计学意义(P < 0.01)。由此可见,一定剂量的飞机草总黄酮可提升小鼠血清IgA水平,持续时间大于7 d,高剂量组效果更佳。
由表4可知,攻毒1 d后,处理组IgG含量与对照组差异无统计学意义(P > 0.05)。攻毒4 d后,各处理组IgG含量升高,高、中剂量组与对照组差异有统计学意义(P < 0.01),低剂量组及自愈组与对照组差异有统计学意义(P < 0.05),高剂量组高于低剂量组及自愈组,差异有统计学意义(P < 0.05)。攻毒7 d后,各处理组IgG含量升高,高剂量组与对照组差异有统计学意义(P < 0.01),中、低剂量组与对照组差异有统计学意义(P < 0.05);高剂量组IgG含量高于其他处理组,与中、低剂量组差异有统计学意义(P < 0.05),与自愈组差异有统计学意义(P < 0.01)。由此可见,一定剂量的飞机草总黄酮可提升小鼠血清IgG水平,持续时间大于7 d,高剂量组效果最佳。

表4 飞机草总黄酮对小鼠血清IgM、IgA和IgG的影响Table 4 Effect of flavonoids from Eupatorium odoratum on number of IgM, IgA and IgG in serum of mice ng/mL
3 讨 论
3.1飞机草总黄酮的体外抑菌作用
本研究发现,飞机草总黄酮对4种供试细菌的体外抑菌效果均达中度敏感以上。其中,金黄色葡萄球菌对飞机草总黄酮的敏感性明显高于鸡白痢沙门氏菌和大肠埃希菌。文献[10-11]表明,黄酮类化合物可破坏细胞膜的功能,抑制细菌的核酸合成及能量代谢。何梦影[12]通过蛋白渗漏和透射电镜试验认为,损伤细菌细胞膜是黄酮的主要抑菌机制之一。Yao等[13]发现,黄酮类化合物川陈皮素和橘皮素处理铜绿假单胞菌(Pseudomonas aeruginosa)和荧光假单胞菌(P. fluoerncnet)后,在电镜下观察可发现细菌的质壁分离现象,细菌结构被破坏。因此推测,本研究的飞机草总黄酮可能具有损伤细菌细胞膜的作用。
3.2飞机草总黄酮的体内抗菌作用
已有研究表明,黄酮对非特异性及特异性免疫均有一定的调节作用。付明哲等[14]研究表明,泡桐(Paulownia)花黄酮可显著提高腹腔巨噬细胞吞噬指数和吞噬百分率,提高实验小鼠淋巴细胞转化率。张苏倩[15]通过小鼠脾淋巴细胞转化实验发现,泡桐花黄酮可促进小鼠脾淋巴细胞转化增殖,进而促进细胞免疫功能。郑艳[16]在日粮中添加青刺果(Prinsepia utilis)总黄酮,发现其可显著提高雏鸡(Gallus domestiaus)血清中IgG和lgM含量,对IgA的升高也有促进作用。IgM是机体初次体液免疫应答中最早出现的抗体,是机体抗感染的“先头部队”[17];IgA可在机体黏膜局部抗感染免疫中发挥重要作用[18-19];IgG则是血清中主要的抗体成分,具有抗菌抗病毒的作用,可在机体免疫中起保护作用[20]。本研究发现,飞机草总黄酮对IgM的影响无统计学意义(P > 0.05),但是高剂量飞机草总黄酮可提高IgA(P < 0.01)和IgG含量(P < 0.05)。小鼠腹腔注射大肠杆菌可造成肠道屏障功能的损伤,肠道微生物平衡紊乱,致病菌在肠道大量增生。高水平的IgA和IgG可有效抵抗细菌感染。本研究中,高剂量总黄酮可有效降低小鼠腹泻率及粪便大肠杆菌数,说明飞机草总黄酮通过提升机体体液免疫能力而控制腹泻的发生,而小鼠粪便大肠杆菌数的减少可能还与飞机草总黄酮在肠道内直接抑制致病菌的增值有关。
4 结 论
飞机草总黄酮对受试的4种细菌均有良好的抑菌活性,小鼠通过灌胃黄酮可提高体液免疫。可见飞机草总黄酮具有体内、外抗菌作用,可降低大肠杆菌性腹泻率,将飞机草作为抗腹泻中草药开发利用具有良好的应用前景和环保价值。
[1]杨逢建, 杨磊, 张衷华, 等. 高效液相色谱—二极管阵列检测法测定飞机草总黄酮的质量分数[J]. 东北林业大学学报, 2008, 36(10):43-45.
[2] 刘晓妹, 蒲金基, 蒙美英. 飞机草不同溶剂粗提液抑菌活性的测定[J]. 广西热带农业, 2004, 27(6): 1-3.
[3] THANG P T, PATRICK S, TEIK L S, et al. Anti-oxidant effects of the extracts from the leaves of Chromolaena odorata on human dermal fibroblasts and epidermal keratinocytes against hydrogen peroxide and hypoxanthine-xanthine oxidase induced damage[J]. Burns, 2001, 27(4): 319-327.
[4] PHAN T T, HUGHES M A, CHERRY G W. Effects of an aqueous extract from the leaves of Chromolaena odorata (Eupolin) on the proliferation of human keratinocytes and on their migration in an in vitro model of reepithelialization [J]. Wound Repair & Regeneration, 2001, 9(4): 305-313.
[5] 袁经权, 杨峻山, 缪剑华. 泽兰属植物中黄酮类化学成分与药理作用[J]. 现代药物与临床, 2007, 22(6): 238-243.
[6] 陈进军, 黎秋旋, 肖俊梅. 飞机草在广东的分布、危害及化学成分预试[J]. 生态环境, 2005, 14(5): 686-689.
[7] 吴杰, 翁涛, 薛巧星. 仙人掌中槲皮素提取条件的正交设计优选[J]. 武汉生物工程学院学报, 2006, 2(2): 95-97.
[8] 巩健. 马齿苋内生菌分离及其抑菌效果研究[J]. 食品工业, 2014, 35(7):144-147.
[9] 彭金菊, 马驿, 梁淑鋆, 等. 30种中药及其复方对温和气单胞菌的抗菌作用[J]. 广东海洋大学学报, 2009, 29(6): 42-45.
[10]CUSHNIE T P, LAMB A L. Antimicrobial activity of flavonoids [J]. International Journal of Antimicrobial Agents, 2005, 26(5):343-356.
[11] CUSHNIE T P. Detection of galangin-induced cytoplasmic membrane damage in Staphylococcus aureus by measuring potassium loss [J]. Journal of Ethnopharmacology, 2005, 101(1-3): 243-248.
[12] 何梦影. 基于脂质体模型对黄酮类化合物抑菌机理的研究[D]. 武汉: 华中农业大学, 2014.
[13] YAO X Y, ZHU X R, PAN S Y, et al. Antimicrobial activity of nobiletin and tangeretin against Pseudomonas [J]. Food Chemistry, 2012, 132(4): 1883-1890.
[14] 付明哲, 陆刚. 泡桐花黄酮抗菌作用及对免疫机能的影响[J]. 中国兽医杂志, 1999, 25(5): 46-47.
[15] 张苏倩. 泡桐花黄酮对小鼠免疫功能的影响[D]. 杨凌: 西北农林科技大学, 2014.
[16] 郑艳. 青刺果总黄酮的提取工艺及其对肉鸡的免疫调节作用[D]. 重庆: 西南大学, 2008.
[17] EHRENSTEIN M R, NOTLEY C A. The importance of natural IgM: scavenger, protector and regulator [J]. Nature Reviews Immunology, 2010, 10(11): 778-786.
[18]吕天星, 于晨龙, 陈光明, 等. 2株乳酸菌对小鼠血清中IgG及IgA含量影响的研究[J]. 中国畜牧兽医, 2014, 41(6): 117-120.
[19]龙珍. 玉郎伞多糖对免疫抑制小鼠免疫功能的影响[D]. 南宁: 广西医科大学, 2014.
[20]林伯全, 廖惠珍, 杜海江, 等. 免疫鸡毒支原体F弱毒株对SPF鸡Bu-1a+B、TCRγδ+CD3+T细胞及血清IgM、IgG、IgA的影响[J]. 中国兽医学报, 2015, 35(4): 549-552.
(责任编辑:刘庆颖)
In vitro Antibacterial Activity and in vivo Fighting Escherichia coli Infection of Total Flavonoids from Eupatorium odoratum Linn.
ZHENG Jin-qing, WANG Xiao-ning, YUE Jie, MA Yi, JU Xiang-hong, LIN Hong-ying, CHEN Jin-jun
(Agricultural College, Guangdong Ocean University, Zhanjiang 524088, China)
The flavonoids were extracted from Eupatorium odoratum Linn. and the in vitro antibacterial activities of the flavonoids extract were examined by examining the zone of inhibition, minimal inhibition concentration (MIC) and minimal bactericidal concentration (MBC) against Staphylococcus aureus, Salmonella pullorum, Bacillus subtilis and Escherichia coli. A range of mice were intraperitoneally infected with Escherichia coli and were orally given the flavonoids extract to evaluate the in vivo anti-infection to diarrhea, the number of E. coli in feces and IgM, IgA and IgG in serum of the mice. The results showed that the Staphylococcus aureus responsed most sensitively to the flavonoids, with in vitro inhibition zone diameter of 19.50 mm, along with the MIC of 0.015 6 g/mL and the MBC of 0.031 3 g/mL. It was also found that 160 mg/kg of the flavonoids extract reduced the rate of diarrhea and the fecal coliform count (P < 0.01) and enhanced serum IgA (P < 0.01) and IgG (P < 0.05) in the mice. It was concluded that Eupatorium odoratum flavonoids really had antibacterial effects both in vitro and in vivo.
Eupatorium odoratum Linn.; total flavonoids; antibacterial effect in vitro; anti-infection in vivo
S853.74
A
1673-9159(2015)06-0053-05
10.3969/j.issn.1673-9159.2015.06.010
2015-06-30
广东省湛江市财政资金科技专项竞争性分配项目“飞机草作为抗菌饲料添加剂资源的开发利用研究”(2013A302-7)
郑锦庆(1988-),男,在读硕士生,主要从事动物健康养殖研究,E-mail:417979942@qq.com
林红英(1965-),女,高级实验师,主要从事动物药理和毒理学研究,E-mail:gdoulinhongying@sina.com;陈进军(1967-),男,博士,教授,主要从事动物药理和毒理学研究,E-mail:jjchen777@aliyun.com

