鱼类类立克次氏体PCR检测方法的建立及初步应用
雷 燕,张会军,王 娟,张文文,唐绍林,肖 洋,王雪鹏
(1. 广州利洋水产科技股份有限公司,广东 广州 510515;2. 广州金水动物保健品有限公司,广东 广州 510515;3. 山东农业大学动物科技学院,山东 泰安 271018)
鱼类类立克次氏体PCR检测方法的建立及初步应用
雷燕1,2,张会军1,2,王娟1,2,张文文1,2,唐绍林1,2,肖洋1,2,王雪鹏3
(1. 广州利洋水产科技股份有限公司,广东广州510515;2. 广州金水动物保健品有限公司,广东广州510515;3. 山东农业大学动物科技学院,山东泰安271018)
根据GenBank中类立克次氏体基因的保守序列,设计一对针对鱼类类立克次氏体PCR检测的特异性通用引物,通过对PCR扩增条件的优化,建立快速检测鱼类类立克次氏体的PCR方法,并用该方法对类立克次氏体阳性罗非鱼(Oreochromis nilotica)进行PCR扩增,结果得到与实验设计相符的390 bp的特异性扩增条带,而对健康罗非鱼、乌鳢(Ophiocephalus argus)、海鲈(Dicentrarchus labrax)、中华绒螯蟹(Eriocheir sinensis)及其他对照组的扩增结果为阴性。测序比对结果证实,该PCR方法检测结果准确,最低可检测出约1 pg的类立克次氏体质粒DNA;利用建立的PCR方法,对来自广东、云南、海南、天津、江苏、安徽、湖北等地的252份临床样品进行检测,共检出阳性样品30份,提示该PCR方法可用于类立克次氏体的临床快速检测。
鱼类类立克次氏体;PCR检测;临床应用
对于水产养殖动物,已明确立克次氏体具有病原学意义,目前,鲑的立克次氏体已明确记述,称为鲑鱼立克次氏体(Piscirickettsia salmonis)[1],而其他水产动物的立克次氏体未明确记述,称为类立克次氏体。类立克次氏体为一类严格细胞内寄生的原核细胞型微生物,一旦感染,致死率较高。类立克次氏体在体外对链霉素、庆大霉素、四环素、氯霉素、红霉素、土霉素、氟甲喹、恶喹酸、沙拉沙星和克拉霉素敏感,对青霉素、林可霉素、呋喃唑酮、磺胺甲氧苄啶耐受,但临床口服抗生素疗效不一致,可能是由于在宿主细胞内达不到有效的药物浓度[19]。
自鲑鱼立克次氏体首次被确定为鱼类病原以来,已报道大西洋鲑(Salmo salar)[2]、大鳞大麻哈(Oncorhynchus tshawytscha)[3]、石斑鱼(Epinephelus melanostigma)[4]、罗非鱼(Oreochromis nilotica)[5]、海鲈(Dicentrarchus labrax)[6]、真鲷(Pagrosomus major)[7]、银鲑(Oncorhynchus kisutch)[8]、蓝眼隆头鲶(Panaque suttoni)[8]、虹鳟(Oncorhynchus mykiss)[9]、乌鳢(Ophiocephalus argus)[11]等十多种经济鱼种感染类立克次氏体而发病。类立克次氏体也感染其他水生生物,如中华绒螯蟹(Eriocheir sinensis)[10]、砂海螂(Mya arenaria)[12]、紫贻贝(Mytilus Edulis)[13]、砗磲(Tridacna gigas)[14]、栉孔扇贝(Chlamys farreri)[15]等。鱼类感染类立克次氏体的病理解剖学特征是肝脏、脾脏、肾脏等内脏器官出现白色结节[4,16-18],可发生水平传播[16, 20],皮肤和鳃可能是入侵途径。
由类立克次氏体引起的多种经济鱼类和贝类流行性病害已严重威胁水产养殖业,并造成巨大的经济损失。目前尚缺乏控制此类病害的有效药物和方法,因此,建立一种快速、准确、灵敏的检测方法极为重要。本研究拟建立鱼类类立克次氏体的PCR检测方法,为其临床快速准确诊断检测提供一种快速、敏感、准确的技术手段,以便在养殖过程中尽早检测,及时预防,减少损失。
1 材料和方法
1.1材料
类立克次氏体阳性材料分别为患类结节病的罗非鱼、乌鳢、海鲈,分别采自云南一罗非鱼养殖场、广东佛山一乌鳢养殖场、广东珠海一海鲈养殖场,由广州利洋水产科技股份有限公司研究所病原分子实验室(下称“本实验室”)收集、鉴定并保存。健康罗非鱼、乌鳢、海鲈、中华绒螯蟹分别采自广东珠海、广东佛山、广东珠海、江苏南京。弹状病毒(Siniperca chuatsi rhabdovirus,SCRV)、真鲷虹彩病毒(Red sea bream iridovirus,RSIV)、螺原体(Spiroplasma)阳性材料由本实验室鉴定并保存,pMD19-PLO质粒由本实验室构建保存。临床样品由本实验室人员分别采自广东、江苏等地养殖场。
1.2主要试剂
大肠杆菌DH5α购自北京天根生化科技有限公司,由本实验室繁殖保存;pMD19-T载体、DNA分子质量标准DL2000购自大连宝生物工程有限公司;2×Taq PCR MasterMix、高纯度质粒小量抽提试盒、普通琼脂糖凝胶DNA回收试剂盒等购自北京天根生化科技有限公司。其他试剂均为国产分析纯。
1.3引物设计与合成
根据GenBank中发布的类立克次氏体16S rRNA基因的保守序列(GenBank登录号:CP012508),设计一对针对鱼类类立克次氏体PCR检测的特异性通用引物。上游引物:5′-CTAGGA GATGAGCCCGCGTTG-3′;下游引物:5′ -ATTTCA CATCCAACTTAATCT-3′,预扩增片段长390 bp,引物由华大基因有限公司合成。
1.4DNA的提取
取类立克次氏体阳性罗非鱼的肝脏、脾脏、肾脏组织,加500 μL TN缓冲液(20 mmol /L Tris /HCl,0.4 mol /L NaCl,pH 7.4),用玻璃匀浆器匀浆,于-20 ℃反复冻融3次,低速离心,取上层清液,采用酚-氯仿法提取DNA,保存于-80 ℃下备用。待检鱼类样品也按照上述方法取样处理并提取DNA。
1.5PCR检测及其产物测序验证
取一PCR反应管,加入2×Taq PCR MasterMix 10 μL,灭菌双蒸水6 μL,DNA模板3 μL,上下游引物(10 μmol/L)各0.5 μL,共20 μL,涡旋振荡器上混匀,置于Bio-Rad S1000型PCR仪上扩增,扩增条件:95 ℃下预变性5 min;95℃ 35 s,56 ℃ 40 s,72℃ 40 s,共30个循环数,最后72 ℃下末延伸10 min,4 ℃条件下保存,反应结束用10 g/L琼脂糖凝胶电泳,紫外凝胶成像系统观察结果。切取阳性目的片段,用普通琼脂糖凝胶DNA回收试剂盒纯化回收,并与pMD19-T 载体于16 ℃条件下连接12 h,产物转化DH5α感受态细胞,在含氨苄青霉素的LB培养板上,37 ℃培养12~14 h后,挑取单个菌落,用LB肉汤扩大培养后,用高纯度质粒小量抽提试盒提取质粒并进行PCR鉴定,筛选出含目的片段的阳性重组质粒,送华大基因公司测序,测序结果提交NCBI 中的BLAST进行比对,并利用生物软件进行序列分析。
1.6PCR反应条件的优化
分别取3、2、1 μL抽提的阳性DNA作为模板进行PCR,对模板量进行优化;分别取上下游引物各0.25、0.50、1.00 μL进行PCR,对所需引物量进行优化。PCR反应程序:95 ℃下预变性5 min;然后95 ℃下变性40 s,分别以51、53、55、57、59 ℃的温度退火30 s,比较反应产物,获得最优反应程序。
1.7PCR特异性试验
分别提取健康罗非鱼、乌鳢、海鲈、中华绒螯蟹、类立克次氏体阳性罗非鱼、SCRV阳性材料、RSIV阳性材料、Spiroplasma阳性材料的核酸,作为模板,按照1.6中优化的组分浓度和反应程序进行PCR反应,观察反应的特异性。
1.8PCR敏感性试验
测定pMD19-PLO质粒的含量,按10倍递增稀释成10 ng/mL、1 ng/mL、100 pg/mL、10 pg/mL、1 pg/mL、100 fg/mL、10 fg/mL、1 fg/mL,分别以各浓度梯度的质粒作为模板,根据1.6中已获得的最佳反应体系和反应程序进行PCR,经10 g/L琼脂糖凝胶电泳后观察结果,检测模板的最低检测量。
1.9临床样品检测试验
应用本研究建立的PCR检测方法,对来自广东、云南、海南、天津、江苏、安徽、湖北等地的252例罗非鱼、乌鳢、海鲈、中华绒螯蟹临床样品进行检测,检验其准确性及临床实用性。
2 结 果
2.1PCR检测方法的建立
利用设计的特异性引物,对类立克次氏体阳性罗非鱼、乌鳢、海鲈样品进行PCR检测,均可扩增出与目的条带大小相符的特异性片段(图2)。将PCR阳性产物分别回收、克隆并测序,得到一条长390 bp的序列,其与GenBank中发布的类立克次氏体的基因序列相比,同源性为99.5%。
2.2PCR反应条件的优化
通过对不同反应条件下的扩增,以及PCR产物电泳结果的比较,确定优化的反应体系为:2×Taq PCR MasterMix 10 μL,灭菌双蒸水6 μL,DNA模板 3 μL,上下游引物(10 μmol/L)各0.50 μL。优化的反应条件为:95 ℃预变性5 min;95 ℃下循环变性40 s,57 ℃下退火复性40 s,72℃下延伸40 s,30循环;72 ℃下末延伸10 min,4 ℃条件下保存。
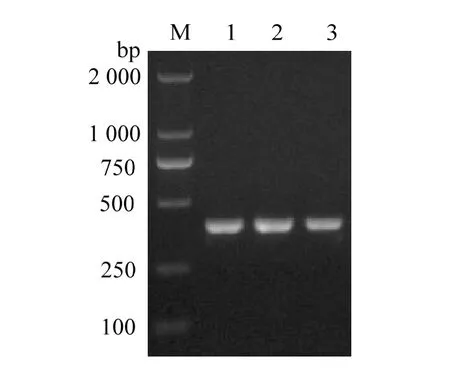
图2 类立克次氏体阳性样品PCR检测结果Fig. 2 Results of PCR detection of Rickettsia-like organisms positive samples
2.3PCR特异性扩增结果
分别以健康罗非鱼、乌鳢、海鲈、中华绒螯蟹,类立克次氏体阳性罗非鱼、乌鳢、海鲈,SCRV阳性材料,RSIV阳性材料,Spiroplasma阳性材料的核酸为模板进行PCR,结果仅类立克次氏体阳性罗非鱼、乌鳢和海鲈可扩增出与预期大小相符的目的条带,而健康罗非鱼、乌鳢、海鲈、中华绒螯蟹及其他对照组均未扩增出任何条带(图3)。

图3 特异性扩增结果Fig.3 The result of specifical amplification
2.4PCR敏感性扩增结果
经过敏感性测定,该PCR检测方法最低能检出1 pg的pMD19-PLO质粒模板(图4)。

图4 敏感性试验结果Fig. 4 Result of sensitivity detect
2.5临床检测结果
用建立的类立克次氏体的PCR检测方法,对252份来自广东、云南、海南、天津、江苏、安徽、湖北等地鱼类的临床样品进行检测,结果见表1。

表1 应用建立的PCR检测方法对不同地区临床样品类立克次氏体的检测结果Table 1 Detection results of piscirickettsia-like organisms in different areas clinical samples using PCR
3 讨 论
PCR检测技术具有快速、准确、灵敏的特点,已广泛应用于水产生物疾病的研究及病原体检测。本研究参照GenBank中公布的基因序列,在类立克次氏体基因的保守序列中设计一对通用特异性检测引物,建立鱼类类立克次氏体的PCR检测方法,在PCR检测过程中,所选择的反应体系和反应程序对结果均有影响,通过优化对PCR反应体系和反应程序进行筛选,得出最适反应体系和反应程序。特异性试验表明,分别以健康罗非鱼、乌鳢、海鲈、中华绒螯蟹,类立克次氏体阳性罗非鱼、乌鳢、海鲈,SCRV阳性材料,RSIV阳性材料,Spiroplasma阳性材料提取的DNA为模板,结果仅类立克次氏体阳性材料有特异条带,这说明所设计的该对引物特异性很好。敏感性试验表明,以所构建的按10n倍稀释的pMD19-PLO质粒为模板,当稀释至1 pg时,PCR结果还为阳性,说明敏感性较好。针对鱼类类立克次氏体进行检测,最快可以在4 h内完成实验,从发病鱼样品中确诊鱼类类立克次氏体病原。利用所建立的PCR检测方法,共检测了252份疑似样品,结果有30份为阳性,为了进一步验证该方法的准确性,本研究对PCR阳性目的条带分别送3家不同的测序公司进行测序,目的片段经比对均为类立克次氏体的基因片段。
综上所述,本研究建立了一种快速、简便、灵敏的检测鱼类类立克次氏体的PCR的方法,研究表明,与传统的方法相比,该方法具有灵敏性和特异性好、且耗时少的特点,与以往的类立克次氏体PCR检测方法比较,具有较好的广谱性。因此,该方法的建立为鱼类类立克次氏体的快速诊断、病原调查及常规检测提供了技术支撑。
[1]FRYER J L,MAUEL M J.The rickettsia:an emerging group of pathogens in fish[J]. Emerg Infect Dis,1997,3(2):137- 144.
[2]BROCKLEBANK J R,SPEARE D J,ARMSTRONG R D, et al. Septicemia suspected to be caused by a rickettsia-like agent in farmed Atlantic salmon[J]. Can Vet J, 1992, 33(6): 407- 408.
[3]EVELYN T P T. Salmonid rickettsial septicemia. Diseases of seawaternet pen-reared salmonid fishes in the Pacific Northwest[J]. Can Spec Pub Fish Aquat Sci, 1992, 116:18-19.
[4]CHEN S C, WANG P C. A Piscirickettsia salmonis-like organism in grouper, Epinephelus melanostigma, in Taiwan[J]. J Fish Dis, 2000, 23(6): 415- 418.
[5]CHERN R S,CHAO C B.Outbreaks of a disease caused by a rickettsia-like organism in cultured tilapias in Taiwan[J].Fish Pathol,1994,29(2):61- 71.
[6]COMPS M,RAYMOND J C,PLASSIART G N. Rickettsia-like organism infecting juvenile sea-bass Dicentrarchus labrax[J]. Bull Eur Assoc Fish Pathol,1996,16(1):30- 33.
[7]姜 明,范瑞青.真鲷肠上皮组织中类立克次氏体的超微形态与细胞病理学的初步研究[J].青岛海洋大学学报,2000,30(2)II:129- 134.
[8]BOONE D R, CASTENHOLZ R W. Taxonomic outline of the archaea and bacteria, Bergey’s manual of systematic bacteriology,Vol. 1 [M]. 2nd edition. New York: Springer, 2001: 155- 166.
[9]GAGGERO A,CASTRO H,SANDINO A M.First isolation of Piscirickettsia salmonis from coho salmon, Oncorhynchus kisutch (Walbaum), and rainbow trout, Oncorhynchus mykiss (Walbaum), during the freshwater stage of their life cycle[J]. J Fish Dis, 1995, 18(3): 277-279.
[10]顾志峰,王文,杜开和,等.患“颤抖病”中华绒螯蟹体内类立克次氏体生物的寄生[J].湖泊科学,2000,12(3):289-290.
[11]贾伟章,孙晓凤,郭琼林.养殖乌鳢类立克次体分离纯化的初步研究[J].水生生物学报,2004,28(4):448-449.
[12]HARSHBARGER J, CHANG S C, OTTO S V. Chlamydiae (with phage), mycoplasma and rickettsiae in Chesapeake Bay bivalves[J].Science,1977,196(4290):666-668.
[13]GULKA,CHANG P W.Host response to rickettsial infection in blue mussel,Mytiltas edulis L [J].J Fish Dis,1984,8(3):319- 323.
[14]NORTON J H,SHEPHERD M A,PRIOR H C. Intracellular bacteria associated with winter mortality in juvenile giant clams, Tridacna gigus[J].J Invertebr Pathol,1993,62(2):204-206.
[15]贺桂珍.栉孔扇贝病原感染与病害发生关系探讨[J].水产学报,2003,27(3):273-277.
[16]CVITANICH J D,GARATE N O,SMITH C E.The isolation of a rickettsia-like organism causing disease and mortality in Chilean salmonids and its confirmation by Koch’s postulate[J].J Fish Dis,1991,14(2):121-145.
[17]OLSEN A B, MELBY H P, SPEILBERG L, et al. Piscirickettsia salmonis infection in Atlantic salmon Salmo salarin Norway-epidemiological, pathological and microbiological findings[J].Dis Aquat Org,1997,31(1):35-48.
[18]CHEN S D,TUNG M C,CHEN S P,et al.Systematic granulomas caused by a rickettsia-like organism in Nile tilapia, Oreochronuis niloticus (L), from southern Taiwan [J].J Fish Dis,1994,17(6):591-599.
[19]徐晔,段宏安,周毅,等.鱼立克次氏体病研究进展[J].安徽农业科学,2013,41(23): 9662-9666.
[20]ALMENDRAS F E, FUENTEALBA I C, JONES S R M, et al. Experimental infection and horizontal transmission of Piscirickettsia salmonis in freshwater-raised Atlantic salmon, Salmo salar L [J].Journal of Fish Diseases,1997,20(6):409-418.
(责任编辑:刘庆颖)
Development and Primary Application of a PCR Assay for Detection of Piscirickettsia-like Organisms
LEI Yan1,2, ZHANG Hui-jun1,2, WANG Juan1,2, ZHANG Wen-wen1,2, TANG Shao-lin1,2, XIAO Yang1,2, WANG Xue-peng3
(1. Guangzhou Liyang Aqua-Technology Co. Ltd, Guangzhou 510515, China; 2. Guangzhou Jinshui Animal Health Products Co. Ltd, Guangzhou 510515, China; 3. College of Animal Science and Technology, Shandong Agricultural University, Tai’an 271018, China)
According to the published gene sequences of the piscirickettsia-like organisms in GenBank, a pair of specific primers was designed, and a rapid PCR method was established for detecting fish piscirickettsia-like organisms. The reaction parameters were optimized to develop the PCR method for detecting fish piscirickettsia-like organisms. The specific band of 390 bp were amplified from the positive samples, but no specific band was amplified from healthy Oreochromis nilotica, Ophiocephalus argus, Dicentrarchus labrax, Eriocheir sinensis and other control group. Sequencing analysis indicated that this method was accurate, and the minimal amount of DNA plasmid of piscirickettsia-like organisms that could be detected was 1 pg. 252 clinical fish samples from Guangdong, Yunnan, Hainan, Tianjin, Jiangsu, Anhui, Hubei were tested by the PCR, and 30 of which were positive. The results indicated that the PCR assay could be used for the detection of clinical fish samples.
piscirickettsia-like organisms; PCR detection; clinical application
S941.4
A
1673-9159(2015)06-0030-05
10.3969/j.issn.1673-9159.2015.06.006
2015-08-28
山东省现代农业产业技术体系(SDAIT-19);泰安市科技发展计划项目(201440774);浙江省近岸水域生物资源开发与保护重点实验室开放基金项目(J2013006)
雷燕(1983—), 男,硕士,研究方向为养殖水产动物病害防治。E-mail: leikunnuy@163.com
王雪鹏(1980—)男,博士,副教授,研究方向为水生动物病原分子生物学、水产动物病害。Email: xpwang@sdau.edu.cn

