乳牙高毒力变异链球菌HtrA缺陷株的构建及转化力的研究
张宏柱,黄 萍,刘兴容
(1.泸州医学院附属口腔医院预防保健/儿童口腔科,四川泸州646000;2.泸州医学院口腔颌面修复重建和再生实验室,四川泸州646000;3.绵阳市中心医院口腔科,四川绵阳621000)
毒力因子目前被认为是变异链球菌致龋的主要因素,不同的毒力因子决定不同的致龋机理。Gasc首次在肺炎链球菌(S.pn)中发现并检测到HtrA,它是一种存在于S.pn表面的热休克诱导的丝氨酸蛋白酶,也可称为DO或 De蛋白酶[1-2]。HtrA可存在于许多生物体中,如植物、细菌、人类等,其作用在于帮助躲避高温、高浓度、高氧等环境[3-4],可通过抑制HtrA的活性减低细菌毒性。HtrA还有水解蛋白的特性,当温度升高时,蛋白酶活性增强[5]。有研究表明,细菌的致病过程可能有HtrA的参与,在应激条件下,有助于细菌在高温、高氧和高渗透压环境中生存[6]。对于错构蛋白的降解,此因子也参与其中,并促使蛋白成熟和正常处理功能的发挥[7-8]。许多细菌表面都存在HtrA,变异链球菌也如此。前期实验已筛选出儿童口腔变异链球菌HtrA高毒力株,发现其致龋性高于其他临床分离株[9],因此可以推测,细菌表面的毒力因子HtrA,对其他毒力因子有调控作用,是细菌致病的重要毒力因子之一,对细菌的致病起决定性作用。本实验旨在利用分子微生物学技术构建变异链球菌高毒力HtrA缺陷株,分析其转化力的变化,探讨HtrA与儿童口腔变异链球菌致龋性的关系,为乳牙龋的预防提供实验依据。
1 材料和方法
1.1 主要材料、试剂和仪器
变异链球菌HtrA标准株(四川大学口腔疾病研究国家重点实验室提供);变异链球菌HtrA高毒力株(前期课题组筛选完成);变异链球菌HtrA高毒力株同源重组质粒载体pUChtrKO(由前期课题组构建完成);TPY液体培养基、TSA固体培养基、LB-Eymr液体培养基(由本实验室按照配方自行配制)、红霉素,氨苄青霉素粉剂(上海恒远生物科技有限公司);PCR试剂盒、质粒小量提取试剂盒、DNA分子量Marker DL2100、MarkerDL1600、PstI、KpnI、BamhI、EcoRI 限制性内切酶、Tenar细菌DNA提取试剂盒(北京鼎国生物有限责任公司);引物 HtrAUR(Bam)、HtrAUF(pst)、HtrADF(KPn)、HtrADR(Eeo)、红霉素基因抗性引物P1/P2(北京博奥森生物技术公司);电泳仪及水平电泳槽(郑州博邦科贸有限公司);PCR扩增仪、凝胶成像分析系统(Labnet公司,美国);光学显微镜(Olympus,日本)。
1.2 高毒力变异链球菌HtrA缺陷株的构建
1.2.1 感受态变异链球菌细胞的制备
从-70℃冰箱中取出乳牙变异链球菌HtrA高毒力株,复苏,接种于TSA固体培养基中,厌氧培养48 h,经形态学和生化鉴定为变异链球菌后转接到TPY液体培养基中;厌氧培养增菌24 h,取0.5 mL菌液加入到10 mL液体培养基中继续培养至OD650nm=0.65时,将液体培养基移入离心管内置于冰上15 min,4℃ 3 500 r/min离心15 min,弃上清;15 mL 0.06 mol/L CaCl2溶液轻轻冲洗使菌细胞悬浮后,置于冰上20 min,4℃ 3 500 r/min离心15 min,弃上清;加入6 mL含200 g/L甘油的0.06 mol/L CaCl2溶液使菌细胞上浮,置冰上10 min即成为感受态细胞悬液,分装成200 μL/份,-70 ℃保存备用。
1.2.2 重组质粒载体转化入变异链球菌细胞
从-70℃冰箱中取出感受态细胞悬液200 μL,室温下解冻后置于冰上;加入含有重组质粒 DNA 的PBS溶液(重量 <60 ng,体积 <15 μL),缓慢摇匀后将其置于冰上40 min;37℃的水浴中迅速升温5 min后置于冰上5~10 min,向试剂管中加入TPY液体培养基1.0 mL,充分混匀后37℃振荡培养1.5 h,使细菌恢复到正常的生长状态;充分混匀菌液后,取 100 μL涂布在固体培养基TSA-Eymr的平板上,平板的正面朝上放置30 min,待培养基把菌液完全吸收,倒置培养皿37℃厌氧培养48 h,即为已转化的变异链球菌HtrA高毒力株。
1.2.3 已转化变异链球菌的鉴定
将已转化的高毒力变异链球菌菌株划线接种于含20 μg/mL红霉素的TSA平板上,37℃厌氧培养48 h;取单个菌落接种至10 mL含20 μg/mL Eymr的TPY液体培养基中,37℃厌氧培养,待OD650nm=0.65后取l.0 mL再次接种到10 mL含20 μg/mL Eymr的TPY液体培养基中,37℃厌氧培养 48 h;取20 μL 转种到10 mL 含20 μg/mL Eymr的TPY液体培养基中,37℃厌氧培养24 h,重复此步骤1次;使用TPY液体培养基倍比稀释上述培养物至 10-6,取 100 μL稀释液均匀涂布在含20 μg/mL红霉素的TSA平板上,37℃厌氧培养48 h;取菌落涂片革兰氏染色后在光学显微镜下观察细菌形态,筛选出符合标准的变异链球菌。
1.3 高毒力变异链球菌HtrA缺陷株的鉴定
将HtrA缺陷株接种于TPY Eymr液体培养基中,37℃厌氧培养48 h,革兰氏染色涂片行形态学鉴定。使用BiosPin细菌基因DNA提取试剂盒将缺陷株基因组DNA提取出来,以高毒力株HtrA基因序列设计引物:HtrF5-AGCGTCAAGTTGGAC-3和HtrR5-CCGAAGTCCAATTAGC-3,应用PCR技术扩增片段大小为500 bp的HtrA基因。以HtrA缺陷株基因组DNA为模板,分别对红霉素基因抗性引物Pl、HtrA基因编码序列引物HtrF/HtrR、红霉素基因抗性引物合并HtrA基因上游序列P1/HtrSUF及红霉素基因抗性引物合并HtrA基因下游序列P2/HtrSDR、含有HtrA基因片段的变异链球菌标准株基因组DNA片段进行PCR扩增,并以含有HtrA基因片段的变异链球菌标准株DNA作为对照。以上基因序列的PCR反应条件均为:93℃变性5 min,经过93℃ 60 s、54℃ 60 s、72℃ 60 s,30个往复循环后,72℃延伸7 min。将PCR反应产物置于10 g/L的琼脂糖凝胶内电泳,在凝胶成像分析系统下成像并观察结果。
1.4 高毒力变异链球菌HtrA缺陷株转化力的研究
分别将HtrA高毒力株和缺陷株从-70℃冰箱中取出、复苏,接种至含20 μg/mL红霉素的TSA平板上;37℃厌氧培养48 h后,取单个菌落将其接种于10 mL含20 μg/mL Eymr的TPY液体培养基中;37℃厌氧培养至OD650=0.65后,吸取l.0 mL菌液转种到10 mL含20 μg/mL Eymr的TPY液体培养基中,37℃厌氧培养48 h;吸取20 μL菌液转移接种到10 mL含20 μg/mL Eymr的TPY液体培养基中,37℃厌氧培养24 h,重复此步骤1次,通过TPY培养基倍比稀释使培养物达到10-6。将100 μL菌液稀释液均匀涂布在含20 ng/mL红霉素的TSA平板上,37℃厌氧培养48 h,菌落计数,以5次实验结果的均值来表示二者的转化力。
1.5 统计学分析
采用SPSS 17.0统计软件中的独立样本t检验方法对同一时间段变异链球菌HtrA高毒力株和HtrA缺陷株转化力的差异进行统计学分析,检验水准α=0.05。
2 结果
2.1 高毒力变异链球菌HtrA缺陷株的形态学和生化鉴定结果
涂片、革兰氏染色后,光学显微镜下观察菌株为革兰氏染色阳性,高毒力株的菌体呈长链状排列且相互缠绕,局部呈团块状,而缺陷株菌体多呈短链状排列,可见游离的单个菌体(图1~2)。常规生化鉴定,可发酵甘露醇、山梨醇、棉子糖、密二糖,水解七叶苷,但不水解精氨酸,证实该菌株为变异链球菌血清C型(图3)。
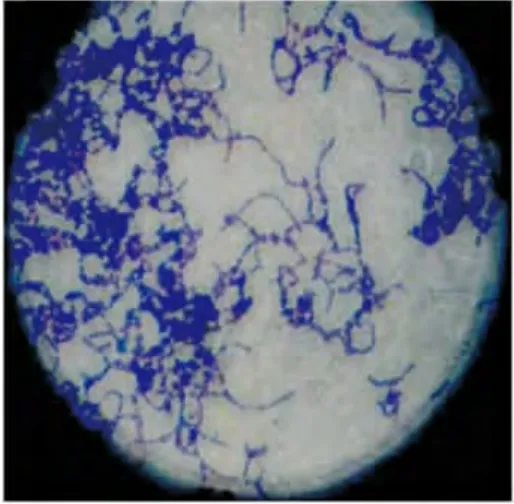
图1 变异链球菌HtrA高毒力株(×100)
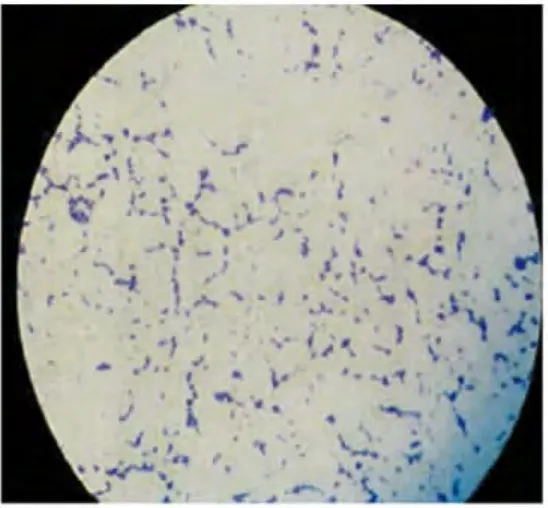
图2 高毒力变异链球菌HtrA缺陷株(×100)

图3 变异链球菌的生化鉴定结果
2.2 高毒力变异链球菌HtrA缺陷株的PCR鉴定结果
经过10 g/L琼脂糖凝胶电泳后,应用凝胶自动成像分析仪分析图像(图4)。其中1~4组为HtrA缺陷株,5~8组为HtrA高毒力株,以分子量为DL2100的变异链球菌HtrA标准株DNA作为Marker,图像显示第1组在DNA分子量为500 bp处未出现特异性的电泳条带,而第5组在此处却出现了一条较明亮的特异性条带,500 bp为HtrA基因片段的DNA分子量。第2组在DNA分子量为710 bp处出现一条明显的亮条带,而第6组在此处却未出现特异性条带,710 bp为红霉素抗性基因片段的DNA分子量。第3、4组分别在DNA分子量为1 200 bp、1 100 bp处各出现一条明亮的条带。而第7、8组均未出现特异性条带,1 200 bp和1 100 bp又分别为HtrA基因上游引物序列合并红霉素抗性基因引物HtrAUF/P1和HtrA基因下游引物序列合并红霉素抗性基因引物HtrAUR/P2的DNA分子量。由此可见,高毒力变异链球菌HtrA缺陷株已检测不到HtrA的基因片段,相反却能够检测到红霉素抗性基因片段,说明两者已发生同源重组的互换,高毒力变异链球菌HtrA缺陷株构建成功。
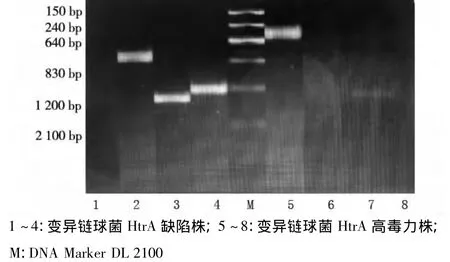
图4 变异链球菌HtrA高毒力株和缺陷株各基因的表达
2.3 变异链球菌HtrA高毒力株与HtrA缺陷株转化力的比较
从表1可以看出,第6、9 h,HtrA高毒力株的菌落数明显多于HtrA基因缺陷株(P<0.05);12、24、48 h,HtrA高毒力株菌落数亦明显多于HtrA基因缺陷株(P<0.05)。
表1 不同时间点变异链球菌HtrA高毒力株与缺陷株菌落生长数目的比较(n=5,s)
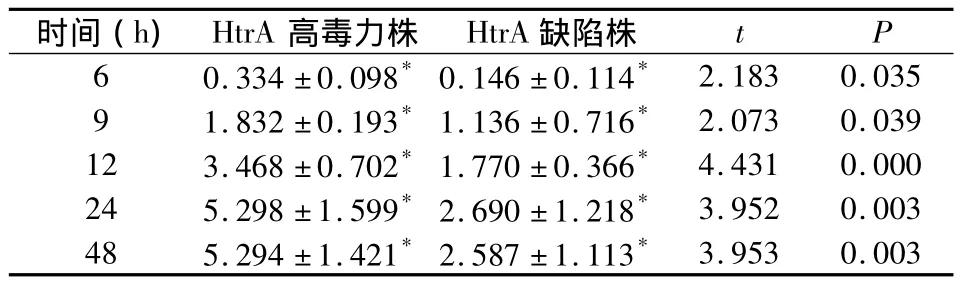
表1 不同时间点变异链球菌HtrA高毒力株与缺陷株菌落生长数目的比较(n=5,s)
*同一时间组间比较P<0.05
时间(h)HtrA高毒力株 HtrA缺陷株2.183 0.035 9 1.832±0.193*1.136±0.716* 2.073 0.039 12 3.468±0.702*1.770±0.366* 4.431 0.000 24 5.298±1.599*2.690±1.218* 3.952 0.003 48 5.294±1.421*2.587±1.113*t P 6 0.334±0.098*0.146±0.114*3.953 0.003
3 讨论
3.1 高毒力变异链球菌HtrA缺陷株的构建和鉴定
变异链球菌是主要的致龋菌,长久以来一直是国内外龋病病因及防治研究的热点。随着分子生物学技术的发展,为了更好地研究某个龋病相关酶或者基因,学者们通常采用生物学手段突变该基因,构建出基因缺陷株,从而精确地分析该基因在致病方面的作用,同源重组技术是其应用的主要手段。同源重组[10](homologous recombination)即重组发生在减数分裂期同源染色体的非姊妹染色单体间,细菌可发生在转化或转导过程中,只要两条DNA序列相同或接近,重组可在此序列的任何一点发生。本实验在HtrA缺陷株的构建时,应用基本原理为同源重组的基因敲除技术对变异链球菌HtrA高毒力株的HtrA基因敲除,在前期实验构建完成的同源重组质粒载体pUChtrKO的基础上,采用嵌套式PCR对HtrA基因上下游序列进行克隆,通过插入红霉素抗性基因的表达对突变株进行筛选。应用PCR技术对构建的HtrA缺陷株进行鉴定,经过10 g/L琼脂糖凝胶电泳后,应用凝胶自动成像分析仪分析图像,结果表明所出现的条带较明亮清晰并未出现涂抹带或特异性条带,HtrA缺陷株已检测不到HtrA的基因片段,却能够检测到红霉素抗性基因片段,说明高毒力变异链球菌HtrA缺陷株构建成功。
3.2 高毒力变异链球菌HtrA基因缺陷株转化力的研究
HtrA是细菌体内一种重要的热休克蛋白分子,也是一种多功能的伴侣分子和丝氨酸蛋白酶,已证明其在很大程度上有助于折叠错误的蛋白分子重新折叠或发生降解。有研究发现,敲除HtrA基因后的变异链球菌,对异常温度、低pH值、氧化剂和DNA损坏剂的耐受能力降低,且降低了生物膜的形成能力[11-12]。HtrA能够保护变异链球菌适应复杂的环境变化,在口腔内的生长和致龋中起重要作用。本实验将变异链球菌HtrA高毒力株和HtrA缺陷株,在TPY液体培养基中增菌,并在含20 ng/mL红霉素的TSA固体培养基中培养48 h,培养皿中高毒力株组的菌落数量显著多于HtrA缺陷株组,表明二者的转化力有明显的差异。究其原因,可能是HtrA中含有与染色体复制和细菌分化有关的DnaA结合位点,它与复制起始点相邻,其下游基因高度保守并与染色体分隔作用的spoOJ相关,其编码的HtrA可以调节糖酵解过程中稀醇酶、3-磷酸甘油酸脱氧酶的加工与成熟,因此HtrA缺失影响了变异链球菌DNA复制及代谢过程从而影响了它的生长过程,与国外HtrA对变异链球菌生长影响的研究结果一致[8,12-13]。通过本实验显示,高毒力变异链球菌HtrA基因的缺失,造成了HtrA缺陷株较高毒力株转化力上的减弱,进而使其毒力出现了下降。但HtrA基因缺失对细菌生长影响的具体机制目前还不清楚,有待进一步研究。
[1]Gasc AM,Giammarinaro P,Richter S,et al.Organization around the dnaA gene of Streptococcus pneumoniae[J].Microbiol,1998,144:433-439.
[2]Seol JH,Woo SK,Jung EM,et al.Protease Do is essential for survival of Escherichia coli at high temperature:Its identity with the htrA gene product[J].Biochem Biophys Res Commun,1991,176:730-736.
[3]Ponting CP.Evidence for PDZ domains in bacteria,yeast,and plants[J].Protein Sci,1997,6(2):464-468.
[4]Gray CW,Ward RV,Karran E,et al.Characterization of human HtrA2,a novel serine protease involved in the nlanlnlalian cellular stress response[J].Eur J Biochem,2000,267(18):5699-57l0.
[5]Spiess C,Beil A,Ehrmann M,et al.A temperature-dependent switch from chaperone to protease in a widely conserved heat shock protein[J].Cell,1999,97(3):339-347.
[6]Wonderling LD,Wilkinson BJ,Bayles DO.The htrA(degP)gene of Listeria monocytogenes 10403S is essential for optimal growth understress conditions [J].Appl Environ Microbiol,2004,70(4):1935-1943.
[7]Poquet IV,Saint E,Seznec N,et al.HtrA is the unique surface housekeeping protease in Lactococcus lactis and is required for natural protein processing[J].Mol Microbiol,2000,35(5):1042-1051.
[8]Diaz ML,Russell RR.HtrA protease and processing of extracellular proteins of Streptococcus mutans[J].FEMS Microbiol Lett,2001,204(1):23-28.
[9]杨江华,郭夕源,王光平,等.不同龋敏感儿童口腔变异链球菌临床分离株与HtrA关系的研究[J].重庆医学,2013,42(24):2834-2836.
[10]Robinson WG,Old LA,Shah DS,et al.Chromosomal insertions and deletions in Streptococcus mutans [J].Caries Res,2003,37(2):148-156.
[11]Radford JR,Ballantyne HM,Nugent Z,et al.Caries-associated micro-organisms in infants from different socio-economic backgrounds in Scotland [J].J Dent,2008,31(6):457-462.
[12]Ahn SJ,Lemos JA,Burne RA.Role of HtrA in growth and competence of streptococcus mutans UA159 [J].J Bacteriol,2005,187(9):3028-3038.
[13]Biswas S,Biswas I.Role of HtrA in surface protein expression and biofilm formation by streptococcus mutans[J].Infect Immun,2005,73(10):6923-6934.

