雌激素对模拟航天环境听觉器官的保护作用
张驰 吴玮, 韩浩伦 王刚 周丽斌 王鸿南 李保卫 丁瑞英北京大学解放军306医院教学医院(北京000)解放军306医院耳鼻咽喉头颈外科(北京000)
·基础研究·
雌激素对模拟航天环境听觉器官的保护作用
张驰1吴玮1,2韩浩伦2王刚2周丽斌2王鸿南2李保卫2丁瑞英2
1北京大学解放军306医院教学医院(北京100101)
2解放军306医院耳鼻咽喉头颈外科(北京100101)
目的探讨模拟失重及飞船舱内噪声复合因素对大鼠听觉电生理与超微结构的影响,及雌激素对上述复合因素损伤的保护作用。方法32只SD大鼠随机分为A、B、C3组,其中A组(失重+噪声组)12只,B组(雌激素+失重+噪声组)12只,C组(对照组)8只。A组、B组动物均粘尾悬吊模拟失重,同时模拟飞船舱内噪声暴露8周,B组动物在此基础上每周两次肌注苯甲酸雌二醇0.02mg/只,首剂加倍,至暴露结束。分别于暴露前、暴露后3天、1周、2周、4周、8周检测其双耳听性脑干反应阈值(ABR)。并于暴露结束后取耳蜗标本进行电镜扫描。结果组内对照,A组SD大鼠在暴露3天直至暴露8周后ABR阈值均较暴露前明显增高(P<0.01);B组SD大鼠在暴露3天直至暴露8周后ABR阈值均较暴露前亦有所增高(P<0.05);C组SD大鼠在暴露2周较暴露1周ABR阈值有所提高(P<0.05),其他时间点增高不显著。组间对照,A组大鼠在暴露3天至暴露8周均较C组大鼠听力显著提高(P<0.01);B组大鼠在暴露3天至暴露8周较C组听力无明显提高(P>0.05);A组大鼠至暴露1周时较B组大鼠听力升高不明显,在以后时间点均较B组大鼠听力明显升高(P<0.05)。扫描电镜显示A组损伤最重,B组损伤次之,C组未见异常。结论失重和噪声复合因素可造成SD大鼠听觉电生理及内耳毛细胞的损伤,雌激素对失重和噪声复合因素下的听功能损伤具有一定保护作用。
模拟失重;噪声;听性脑干反应;雌激素
宇航员在太空中执行任务时,面临许多与地面不同的情况。如失重状态,稳态噪声的持续暴露等等。稳态噪声和失重状态对宇航员来说是持续存在。它会对人体造成耳鸣、听力下降的不良影响[1],一旦发生,会大大影响宇航员以后的工作效率及生活质量。雌激素是一种由内分泌系统产生的类固醇性激素,它在多个系统中发挥着重要作用[2]。在听力损伤的保护作用方面也逐渐被重视。既往本课题组发现大鼠处于模拟载人航天环境5天后会对听功能造成损伤,雌激素对造成的损伤具有一定的保护作用[3],但随着载人航天事业的发展以及人类在宇宙中停留时间的延长,关于中长期载人航天环境对人类听力学影响的研究仍是空缺,本文主要观察中长期飞船舱内噪声和失重复合环境下大鼠听性脑干反应和扫描电镜内外毛细胞的变化以及雌激素对噪声暴露后大鼠听力损伤的保护作用。
1 材料和方法
1.1实验动物及分组
健康SD大鼠32只(北京海淀区兴隆实验动物养殖场提供),均为雄性,体重180~220g,耳廓反应灵敏,鼓膜标志清晰,无强噪声暴露及耳毒性药物使用史,随机分为正常对照组及实验组。正常对照组8只(C组),实验组24只。其中实验组又分为A、B两组,每组12只。均于暴露八周后取材。A组(噪声+失重组)同时给予噪声暴露和模拟失重处理,B组(雌激素+噪声+失重组)在给予噪声暴露和模拟失重处理的情况下,同时给予雌激素腹腔注射,C组(对照组)未给予任何处理。实验前所有动物进行听性脑干反应(ABR)阈值测试,对照组和两实验组动物ABR阈值未见明显差异。
1.2雌激素给药方法
苯甲酸雌二醇注射液由天津金耀氨基酸有限公司生产。B组于噪声暴露和模拟失重处理当天给予雌激素注射,首次注射剂量0.04mg/只,以后每周注射两次,剂量为0.02mg/只。
1.3模拟失重方法
参考大鼠粘尾悬吊法[4],采用头低位模拟失重法。悬吊大鼠尾部使其后肢离地,胶布固定于尾部,留出活结,用铁丝悬吊,前肢承受部分重量,头低位身体纵轴与水平线呈-30°,悬吊中大鼠可以自由进食水,头部活动自由,持续时间较长,总计悬吊8周。
1.4噪声暴露方法
稳态噪声由白噪声信号发生器(UZ-3型),经均衡器(MEQ),功率放大器(PA-1000)传到扬声器(YZ20-7),并将扬声器放置于大鼠笼前部。噪声声级用BK2250手持式分析仪测量,测得其声压级为(72±2)dB SPL,每天持续给予9小时稳态噪声暴露。
1.5听性脑干反应(ABR)阈值测试
实验SD大鼠用咪唑安定(80mg/kg)和盐酸赛拉嗪注射液(200mg/kg)进行肌肉注射麻醉(麻醉深度达角膜反射消失)。实验前对A、B、C三组应用听性脑干反应仪(MEDSEN丹麦)检测短声诱发的双侧听性脑干反应阈值,并分别于暴露后3天、1周、2周、4周、8周再次进行检测。记录电极置于前额正中皮下,参考电极置于对侧耳后乳突区皮下,接地电极置于鼻尖。从高声强开始,依次以20、10、5dB SPL逐渐衰减,以能诱发出可辨认波Ⅲ的最低强度为反应阈,在阈值强度重复检测1次。
1.6扫描电镜检查
扫描电镜(Scanning Electron Microscopy,SEM)检查:A、B、C三组SD大鼠在暴露8周后,快速断头处死并迅速取出耳蜗,2.5%戊二醛固定液进行离体耳蜗灌注。固定4h后,采用硬剥法暴露出基底膜。处理后的内耳标本进行脱水、干燥、镀金等处理。扫描电镜(Hitachi S4800)下观察,拍照。
1.7统计学分析
数据采用SPSS19.0统计学软件处理数据,各组各实验点ABR阈值采用方差分析。
2 结果

表1 实验动物不同时间点ABR阈值的变化
2.1实验组动物不同时间点ABR阈值的变化(见表1)
2.1.1三组大鼠各个时间点ABR阈值变化:A组(噪声+失重组)SD大鼠暴露3天直至8周ABR阈值均较暴露前有统计学差异(P<0.01)。B组(雌激素+噪声+失重组)SD大鼠暴露3天直至8周ABR阈值均较暴露前有统计学差异(P<0.05)。C组(对照组)SD大鼠暴露3天、1周较暴露之前无统计学差异(P>0.05),暴露2周较暴露1周有统计学差异(P<0.05),暴露4周较暴露2周、暴露8周较暴露4周无统计学差异(P>0.05)。
2.1.2实验开始之前,三组之间ABR阈值无统计学差异(P=0.614)。A组在暴露3天至暴露8周较C组有统计学差异(P<0.01),B组在暴露3天至暴露8周较C组无统计学差异(P>0.05),A组至暴露1周时与B组无统计学差异(P>0.05),余各时间均有统计学差异(P<0.01)。
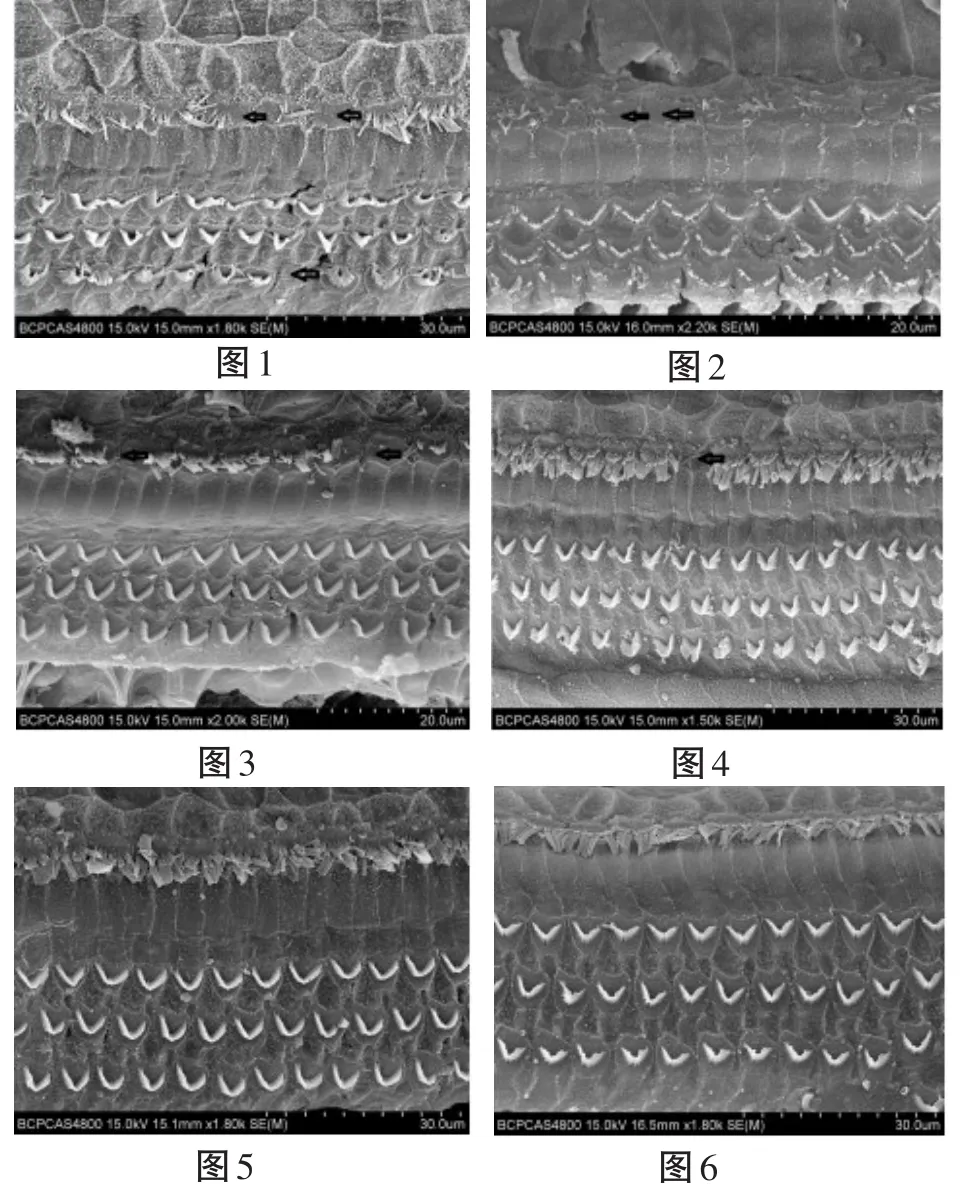
图1 、2为A组,图3、4为B组,图5、6为C组
2.2扫描电镜检查结果
2.2.1A组(噪声+失重组):1图示内毛细胞静纤毛缺失、倒伏、融合。外毛细胞可见缺失。2图示内、外毛细胞静纤毛可见片状缺失。
2.2.2B组(雌激素+噪声+失重组):3、4图示内毛细胞静纤毛部分缺失、倒伏、融合,较A组损伤轻。外毛细胞大致正常。
2.2.3C组(对照组):5、6图示内外毛细胞静纤毛未见明显异常。
2.2.4各组之间比较:扫描电镜显示A组损伤最重,B组损伤次之,C组未见明显损伤。
3 讨论
在载人航天过程中,稳态噪声和失重是持续存在的。研究表明[5]噪声是最主要的损害人类听觉系统的因素,可造成永久性听力损失,一旦发生,将缩短宇航员的职业寿命,因此研究航天性听损伤对现实有重要意义。失重,作为宇航员在宇宙中的一种长期持续状态,亦可对身体的各个器官产生不同的影响,包括人的听觉器官[6-7]。故为更好的服务于载人航天事业,遂模拟飞船舱内稳态噪声及失重状态进行本实验。
既往本课题组曾短期模拟飞船舱内失重及噪声复合因素并研究其对豚鼠听力的影响,发现短期模拟飞船舱内复合因素会对大鼠听力造成损伤。本实验对ABR阈值进行观测,3天时A组大鼠听力较暴露前有统计学差异,与既往研究相符。此外,A组大鼠ABR阈值随着暴露时间的延长显著增高。A组大鼠较C组大鼠ABR阈值显著增高。可知长期模拟复合因素对大鼠听力造成损伤,且随时间延长损伤加重。而C组大鼠ABR阈值随着时间延长亦在增加。考虑可能与反复麻醉测听有关,亦考虑可能与鼠龄增长的影响,这方面有待进一步研究。但各组间干扰因素均相一致,故对研究结果无影响。Chen等[8]研究指出,噪声性听功能损失与毛细胞缺失密切相关,这种关联可能提示实验中受损的毛细胞死亡。过度的噪声刺激将导致耳蜗外毛细胞(OHC)和内毛细胞(IHC)的损伤或丢失,造成暂时性阈移或永久性阈移。既往有研究发现失重状态与稳态噪声复合因素对内耳内外毛细胞会造成严重损伤[9]。从本实验扫描电镜结果中可看出A组大鼠较C组大鼠耳蜗毛细胞损伤严重,而C组大鼠未见明显异常。均证实模拟飞船舱内失重及稳态噪声会对听力系统造成损害。
雌激素是一种由内分泌系统产生的类固醇性激素,它在多个系统如心血管系统、免疫系统及内分泌系统中发挥着重要作用[2]。雌激素能影响神经系统的发育,并具有重要的神经保护作用,对听觉器官亦有非常重要的保护作用[10]。有研究发现雌激素促进风洞致使的噪声性聋的恢复[11]。此外,耳蜗内也发现了雌激素受体的存在[12-13],提示其可能对听功能损伤具有一定的防护作用。曾经有调查发现,老年男性(70-75岁)比同龄女性高频听力降低约10dB-25dB[14]。绝经期后女性更容易出现听力下降,而男性出现听力下降的时间较女性早[15],考虑这些差异与内源性雌激素水平有关。本课题组既往研究也发现雌激素对豚鼠听力损伤有预防和治疗作用。本实验中A组大鼠较C组大鼠ABR阈值均增高显著,B组大鼠较C组大鼠ABR阈值增高不显著,A、B两组大鼠在1周后有统计学差异,均可证明雌激素对豚鼠听力有保护作用,符合既往研究。而在3天、1周时,A、B两组大鼠之间无明显差异,考虑可能与雌激素起效时间及血药浓度有关,具体机制尚不完全明确,有待进一步研究。扫描电镜检查示复合因素暴露8周后,A、B组大鼠内毛、细胞静纤毛均可见损伤,A组损伤较重,且A组大鼠外毛细胞亦有损伤。而C组大鼠内毛细胞静纤毛、外毛细胞静纤毛无明显损伤。电镜结果与听力测试结果基本相符。说明雌激素确实有保护听力损伤作用。
综上所述,本实验成功模拟飞船舱内的失重及噪声复合因素,从听觉电生理学及电镜改变两方面证实了失重及噪声复合因素对SD大鼠听器官有明确损伤作用;并通过给予雌激素注射使听力得以保护,为雌激素对噪声性耳聋的保护提供了理论依据。但雌激素保护听觉系统的具体机制,目前尚不明确,需要我们今后进一步研究。
1杨卫平,于黎明,胡吟燕,等.脉冲噪声暴露后早期大鼠耳蜗外毛细胞死亡时程观察.解放军医学杂志,2006,31(6):543-544.
2韩浩伦,吴玮,余萌,等.雌激素对模拟失重及飞船舱内噪声下豚鼠内耳Caspase-3表达的影响.听力学及言语疾病杂志,2013,21(5):509.
3王刚,吴玮,韩浩伦,等.雌激素对模拟失重及噪声条件下豚鼠听功能的影响.中华耳科学杂志,2013,11(2):293-295.
4韩浩伦,吴玮,王鸿南,等.头低位模拟失重状态对豚鼠耳蜗听功能与超微结构的影响.听力学及言语疾病杂志,2012,20(3):269.
5曲雁,李云,丁大连,等.噪声性耳聋的研究进展.河北医科大学学报,2008,4(30):360.
6阎露,钱维权,李道德.噪声、模拟失重复合作用对豚鼠脑干听觉诱发电位的影响.航天医学与医学工程,1994,7(增刊):s52-s60.
7杨剑,刘博,韩德民.航天性听损伤及其机制探讨.国外医学耳鼻咽喉科学分册,2004,11(28):374-379.
8Chen GD,Fechter LD.The relationship between noise-induced hearing loss and hair cell loss in rats.Hear Res,2003,177(1-2):81-90.
9吴玮,韩浩伦,王鸿南,等.模拟失重条件下飞船内噪声对豚鼠耳蜗形态与功能的影响.中华耳科学杂志,2010,8(1):95-99.
10Vegeto E,Belcredito S,Ghisletti S,et al.The endogenous estrogen status regulates microglia reactivity in animal models of neuroinflammation.Endocrinology,2006,147(5):2663.
11薄少军,吴玮,等.雌激素对小鼠风洞噪声性听力损伤的保护作用.中华耳科学杂志,2011,9(3):323-326.
12Stenberg A,Wang H,Fish J,et al.Estrogen receptors in the normal adult and developing human inner ear and in Turner's syndrome. Hear Res,2001,157(1-2):87-92.
13王刚,吴玮,韩浩伦,等.雌激素对模拟失重及噪声条件下豚鼠听功能的影响.中华耳科学杂志,2013,11(2):293-295.
14Jönsson R,Rosenhall U,Gause-Nilsson I,et al.Auditory function in 70-and 75-year-olds of four age cohorts.Scand Audiol,1998,27 (2):81-93.
15Hederstierna C,Hultcrantz M,Collins A,et al.The menopause triggers hearing decline in healthy women.Hear Res,2010,259(1-2):31-35.
接760页1651-1659.
29Mira E.Improving the quality of life in patients with vestibular disorders:the role of medical treatments and physical rehabilitation.Int J Clin Pract.2008,62(1):109-114.
30Horii A,Takeda N,Matsunaga T,et al.Effect of unilateral vestibular stimulation on histamine release from hypothalamus of rats in vivo.J Neurophysiol.1993,70(5):1822-1826.
31Adrian FL,Antti AA,Kaj K,et al.Plasticity of histamine H3 receptor expression and binding in the vestibular nuclei after labyrinthectomy in rat.BMC Neuroscience.2004,5:32.
32Takeshita Y,Watanabe T,Sakata T,et al.Histamine modulates high-voltage-activated clacium channels in neurons dissociated from the rat tuberomammillary nucleus.Neuroscience.1998,87(4):797-805.
33Redon C,Lopez C,Bernard-Demanze L,et al.Betahistine treatment improves the recovery of static symptoms in patients with unilateral vestibular loss.Journal of Clinical Pharmacology.2011,51(4):538-548.
34Tighilet B,Trottier S,Mourre C,et al.Betahistine dihydrochloride interaction with the histaminergic system in the cat:Neurochemical and molecular mechanisms.European Journal of Pharmacology 2002,446(1-3):63-73.
35Botta L,Mira E,Valli S,et al.Effects of betahistine on vestibular receptors of the frog.Acta Oto-Laryngol.1998,118(4):519-523.
36Darlington CL,Dutia MB,Smith PF.The contribution of the intrinsic excitability of vestibular nucleus neurons to recovery from vestibular damage.Eur J Neurosci.2002,15(11):1719-1727.
37Filip B,Alasdair R,Mike L,et al.Histaminergic and glycinergic modulation of GABA release in the vestibular nuclei of normal and labyrinthectomised rats.J Physiol.2006,577(Pt 3):857-68.
38 Albert ES,Bec JM,Desmadryl G,et al.TRPV4 channels mediate the infrared laser-evoked response in sensory neurons.Journal of Neurophysiology.2012,107(12):3227-3234.
39Kalluri R,Xue J,Eatock RA.Ionchannels set spike timing regularity of mammalian vestibular afferent neurons.Journal of Neurophysiology 2010,104(4):2034-2051.
40Vignaux G,Chabbert C,Gaboyard-Niay S,et al.Evaluation of the chemical model of vestibular lesions induced by arsanilate in rats. Toxicology and Applied Pharmacology.2012,258(1):61-71.
41 Ihler F,Bertlich M,Sharaf K,et al.Betahistine exerts a dose-dependent effect on cochlear stria vascularis blood flow in guinea pigs in vivo.PloS One.2012,7(6):e39086.
Protective Effects of Estrogen on Cochlea during Mid-Long Term Simulated Manned Spacecraft Environment
ZHANG Chi1,WU Wei1.2,HAN Haolun2,WANG Gang2,ZHOU Libin2,WANG Hongnan2,LI Baowei2,DING Ruiying2
1 PLA 306th Hospital/Peking University Teaching Hospital,Beijing 100101.
2 Department of Otolaryngology-Head and Neck Surgery,PLA 306th Hospital,Beijing 100101 Corresponding author:WU WeiEmail:entwuwei@126.com
Objective To study the effects of compound factors of weightlessness and noise in spaceship on rat hearing and cochlear morphology,as well as protection against auditory damage by estrogen.Methods Thirty two SD rats were randomly divided into groups A and B(n=12 each)and group C(n=8)Animals in groups A and B were subjected to glued tail suspension to simulate weightlessness,and exposed to simulated spaceship noise for 8 weeks.Additionally,animals in group B were injected with 0.02 mg benzoate twice a week(first dose=0.04 mg)until the end of the experiment.Auditory brainstem response(ABR)thresholds were tested bilaterally before and at 3 days,1 week,2 weeks,4 weeks and 8 weeks after noise exposure.The cochlea was harvested and processed for scanning electron microscopy(SEM)studies at the end.Results ABR thresholds were significantly higher in group A than other groups(P<0.01).The longer the exposure,the higher the thresholds.ABR thresholds in group B were also increased along with noise exposure(P<0.05).ABR thresholds in group C increased along with noise exposure from week 1 to week 2(P<0.05),but not significantly at other time points (P>0.05).ABR thresholds in group A were higher than in group C at all times(P<0.01).ABR thresholds in group B were not significantly different than in group C from day 3 to 8 weeks.(P>0.05).ABR thresholds in groupAwere not significantly different from group B during the 1st week,but higher than group B at other time points(P<0.05).SEM showed the most severe cochlear damage in group A,followed by group B.Only mild cochlear change was observed in group C.Conclusions Simulated weightlessness and noise exposure can cause damage to hearing and changes of cochlear morphology in SD rats.Estrogen appears to protect against such damages.
Simulated weightlessness;Noise;Auditory brainstem response;Estrogen
R764.433
A
1672-2922(2015)04-746-4
2015-10-27审核人:郭维维)
10.3969/j.issn.1672-2922.2015.04.044
全军十二五重大课题子课题(AWS11J003)
张驰,研究生在读,住院医师,研究方向:特种耳科学及临床
吴玮,Email:entwuwei@126.com

