栅藻Scenedesmus sp.蛋白质提取方法优化及氨氮与硝态氮处理下蛋白质组表达差异
贾其坤 梁青 吴后波 王广华 吴华莲 李涛 王兵 向文洲
由于存在基因转录调控和转录后修饰,单纯基因层面研究细胞代谢调控具有很大的限制性[1],如高估实际的细胞调控过程[2]。而通过蛋白质组表达分析则可以将静态的细胞基因组信息与特定环境下动态的细胞代谢调控联系起来[2],因此,双向电泳技术是在蛋白质水平研究基因表达和代谢调控最有效的手段之一[3,4]。但如何快速高效地提取细胞内全部蛋白,蛋白沉淀后如何保证其复溶性,如何提高双向电泳图谱分辨率等问题依然限制着这一技术的发展[5]。虽然目前有很多方法可以使哺乳动物和组织的蛋白样品达到3 000-10 000个蛋白点,但当应用到微藻时,结果往往很不理想,出现诸如细胞破裂不完全、蛋白复溶度低等问题。如研究者对Synechocystis sp. Strain PCC 6803进行实验时,仅得到不足400个蛋白点[6]。另外,由于不同种的微藻其细胞生化成分不同(尤其是微藻内含有的大量的叶绿素和类胡萝卜素),而这些成分的差异可能会影响到蛋白的溶解性及提取率[5],因此双向电泳蛋白样品的制备方法因不同的种属而异。
无论陆生环境还是水生环境,对于其中的生物来说,氮都是一个重要的限制条件[7]。与硝态氮和尿素中的氮元素相比,大多数微藻更倾向于利用氨态氮,因为这种形式的氮可以在不需要还原的情况下直接参与细胞内各种代谢途径[8]。在栅藻中也发现同样的现象,氨态氮培养的微藻的生长速率显著高于硝态氮和尿素等其他形式[9]。但高浓度的氨态氮却会严重抑制微藻的生长和油脂含量[10,11],更高浓度的氨态氮甚至会产生严重的毒害作用[12]。不同种属的微藻对氨氮的耐受能力差别很大[7],研究表明,在pH>8.0的情况下,当氨态氮浓度大于2.0mmol/L时可以显著抑制栅藻Scenedesmus obliquus的光合速率和生长速率[13]。
本实验初步探究栅藻Scenedesmus sp.双向电泳蛋白样品的制备方法及氨氮毒害作用下该藻蛋白差异表达情况,为研究氨氮对其的毒害机制提供参考。
1 材料与方法
1.1 材料
1.1.1 样品来源 栅藻Scenedesmus sp.为实验室自行分离保种,经18S rRNA和ITS鉴定,为栅藻科栅藻属的微藻。微藻正常培养使用改进的土壤浸出液培养基(Modified soil extract medium,MSE),培养基配方,见表1。
1.1.2 主要仪器 紫外分光光度计(Ultrospec 6300 pro,General Electric)、台式微量离心机(5415D、Eppendorf)、光学显微镜(Olympus BX53)、恒温培养箱(SHP-250)、水浴培养箱(OLS 200)、超声细胞破碎仪Sonics VCX 130-PB、琼脂糖凝胶电泳仪Bio-Rad JUNYITM、2-DE电泳仪GE Healthcare Ettan DALT six。
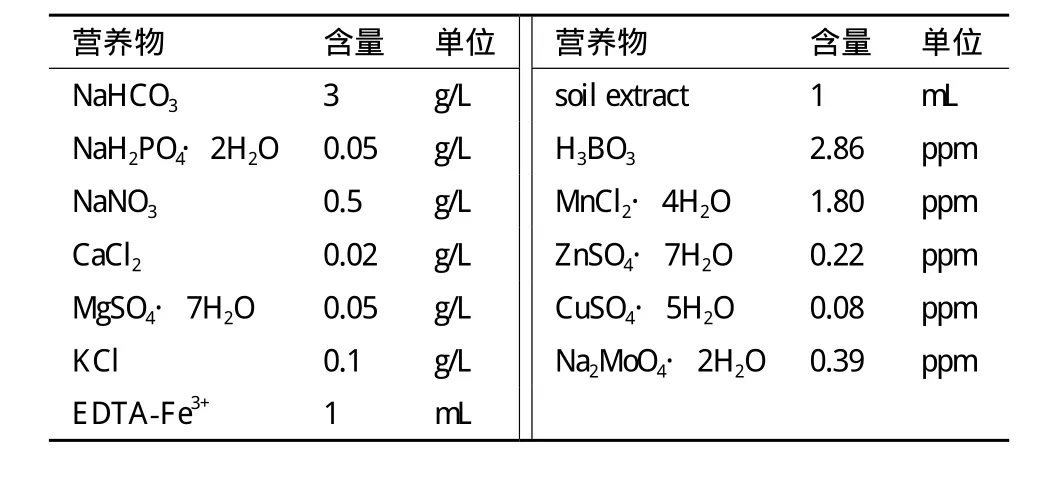
表1 MSE微藻培养基配方
1.1.3 主要试剂 丙酮、甲醇、乙醇、磷酸、硫酸铵、冰醋酸和超纯水,购自广州化学试剂厂;30%的丙烯酰胺、TEMED、SDS、pH6.8/8.8的1.5mol/L Tris-HCl、CHAPS、DTT、APS、TCA、矿物油、考马斯亮蓝G-250(电泳纯)、低熔点琼脂糖、蛋白酶抑制剂,购自生工生物工程(上海)股份有限公司。
1.2 方法
1.2.1 培养方法 微藻藻种首先在正常培养基上进行活化,取活化后处于对数期的微藻藻种以10%的比例接种到正常培养基和氨态氮培养基上。氨氮培养基的配方与上述MSE培养基一致,但以0.315g/L的NH4Cl代替MSE培养基中的0.5g/L的NaNO3,两种培养基中的N元素含量一致,为5.88mmol。此浓度的氨态氮对栅藻可产生严重的毒害作用。培养条件为24h光照,光照强度为100mmol photon/(m·s),培养温度控制在(24±1)℃。
1.2.2 细胞破碎方法 目前常用的细胞破碎提取全细胞蛋白质的方法主要有两种,超声细胞破碎法和液氮研磨破碎法。本实验使用两种方法进行细胞破碎并通过显微镜观察细胞破碎情况。
液氮研磨时首先将研钵用液氮预冷,然后取适量-80℃冻存的藻泥,加入液氮充分研磨15min,研磨后的藻粉加入1.5mL裂解液,裂解液配方如下:8mol尿素,4% CHAPS,65mmol DTT和蛋白酶抑制剂。涡旋震荡20-30min使其充分裂解。超声细胞破碎时为防止超声过程中起热,操作需在冰上进行,藻泥中加入1.5mL裂解液,超声震荡10min,每超声5 s停止10 s以防止起热和起泡。
细胞破碎后,12000 ×g 4℃离心10min将未破碎的细胞和破碎细胞的残渣去除,蛋白质与细胞内多糖、脂质、细胞器,细胞质等其他细胞内容物共同存在于上清中,主要通过两种方法进行蛋白纯化:TCA丙酮沉淀法和丙酮沉淀法。其中TCA丙酮沉淀法的主要步骤如下:
(1)向上清液中加入4倍体积预冷的10% TCA-丙酮溶液(20mmol DTT),于-20℃自然沉淀30min,8 000×g -4℃离心 10min。
(2)去上清,加入30mL预冷的80%丙酮(水)溶液(20mmol DTT),用枪吹打沉淀,尽量分散,-20℃沉淀30min后同样条件离心10min。
(3)依次用90%丙酮(20mmol DTT)和纯丙酮(20mmol DTT)重复步骤(2)。
(4)去上清,沉淀在冰上沥干,用滤纸擦拭试管内壁,尽量擦去残留的丙酮溶液。
(5)加入1.5-2mL复溶液,震荡器上充分震荡溶解20min,-20℃备用。复溶液配方与裂解液相同。
丙酮沉淀法步骤(1)中使用的为纯丙酮溶液(20mmol DTT)而非10%的TCA-丙酮,其他步骤与上述TCA-丙酮沉淀法一致。
1.2.3 蛋白浓度及纯度测定 提取的蛋白质样品在双向电泳开始前需要对其进行蛋白定量和蛋白丰度检验。蛋白质定量使用非干扰型蛋白质定量试剂盒,一般认为当蛋白质浓度介于4-10mg/mL时较适合进行双向电泳实验。同时SDS-PAGE胶可以初步检测所提蛋白的丰度,一般提取成功的蛋白样品条带清晰丰富;而蛋白种类较少则会导致SDS-PAGE胶条带较少,多是由于提取方法不当、细胞破碎不够完全或提取过程中蛋白降解等原因造成的。因此,在双向电泳前进行SDS-PAGE胶检验是非常必要的。电泳结束后拆除电泳装置,将胶块放在方盒中,加入考马斯亮蓝进行染色1h,加入双蒸水进行摇床震荡脱色。在Image Scanner III扫描仪上扫描观察。1.2.4 双向电泳及差异蛋白点的检测分析 取出蛋白样品,加入水化液至350mL,蛋白样品与上样缓冲液的比例以蛋白样品的含量而定。本实验使用的是pH4-7,17cm的胶条,一般要求蛋白总量在800-1000mg之间。在水化槽中加入适量的矿物油以覆盖胶条防止水分挥发。被动水化16h后进行等电聚焦电泳,等点聚焦结束后,取出胶条,依次在DTT-平衡缓冲液和碘乙酰胺-平衡缓冲液中分别平衡15min,然后进行SDS-PAGE凝胶电泳。电泳结束后取出凝胶,用超纯水清洗后经固定液固定1h,然后考马斯亮蓝G-250染色1h,最后超纯水脱色,在Image Scanner III扫描仪上扫描观察。
应用Melanie version 7.0 software(Swiss Institute of Bioinformatics)对凝胶进行分析,对差异蛋白进行挖取,应用MALDI-TOF-MS/MS进行检测,检测结果在NCBI蛋白数据库进行比对,得到其蛋白种类和功能及其他信息。
2 结果
2.1 细胞破碎方法的比较
经液氮研磨,藻细胞破碎较完全(图1-A),完整细胞较少,细胞内容物外泄,视野中充斥大量的细胞碎片和残渣;而经超声细胞破碎仪处理的样品(图1-B),细胞破碎率明显较低,大量细胞保持原有的圆球形结构,细胞颜色鲜艳,几乎没有内容物外泄,仅有少量空壳细胞及碎片。
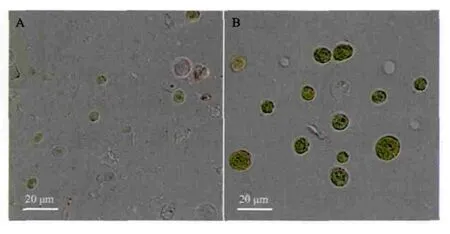
图1 Scenedesmus sp.经液氮研磨(A)与超声破碎(B)处理后显微照片
2.2 蛋白提取方法的比较
经丙酮沉淀和TCA-丙酮沉淀两种方法纯化后的蛋白样品复溶效果略有差异,对其进行蛋白定量。结果显示,丙酮沉淀法得到的蛋白样品浓度为5mg/mL,而TCA-丙酮沉淀法得到的蛋白样品浓度略低,为3.5mg/mL。但PAGE胶检验蛋白丰度时发现:丙酮沉淀法制备的蛋白样品条带较少且不清晰,样品中的蛋白种类单一(图2-A)。TCA-丙酮法纯化蛋白获得的蛋白样品种类多,条带丰富清晰(图 2-B)。
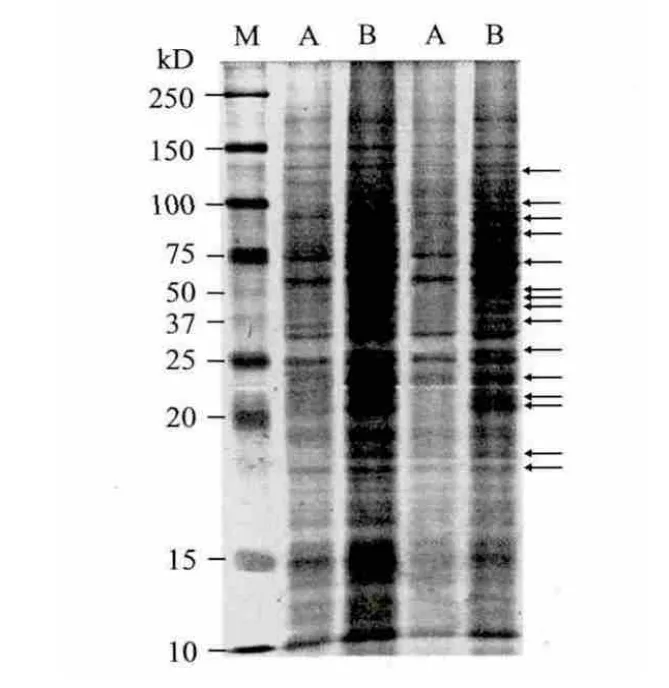
图2 丙酮沉淀法(A)与TCA-丙酮沉淀法(B)提取微藻Scenedesmus sp.蛋白SDS-PAGE电泳图
2.3 不同氮源培养微藻蛋白表达差异
比较正常培养基(硝态氮)与氨态氮培养基培养的微藻其蛋白表达的差异发现,两种培养模式的微藻蛋白表达发生了很大的变化(图3-A和3-B)。和正常培养基相比,氨氮培养的微藻表达蛋白谱中有85个表达量降低的蛋白(图3-C),25个表达升高的蛋白(图3-D)。根据pH和MW选择了26个表达量降低的蛋白和6个表达量升高的蛋白进行飞行质谱MALDI-TOF-MS/MS检测(图4)。检测结果与NCBI数据库比对发现,这些蛋白涉及光合作用、二氧化碳固定、糖酵解、蛋白质合成及非正常折叠蛋白降解、细胞分裂和物质运输,以及自由基清除等途径(表2)。由于微藻相关蛋白数据库目前尚不完备,因此飞行质谱结果在数据库上检索匹配率较低,仅检测到9个蛋白,其中6个表达量降低的蛋白分别为:甘油醛 -3-磷酸脱氢酶(A24)、烯醇化酶(A28)、肌动蛋白(A50)、核酮糖-1,5-二磷酸羧化酶(A70和A82)和细胞分裂相关蛋白(A83)。3个表达含量增高的蛋白分别是:50S核糖体蛋白(B05)、Fe-氢化酶(B15)和30S 核糖体蛋白(B17)。
3 讨论
栅藻Scenedesmus sp.细胞体积较大,细胞壁的三层结构提供坚固的保护壁,因此超声细胞破碎法无法有效地破碎细胞,而液氮研磨作为最剧烈的破细胞方法,同时加入裂解液和反复冻融的协同作用,样品破碎较完全,可作为一种有效快速的破碎细胞提取蛋白的方法使用。
藻类细胞中含有大量的盐、核酸、多糖和脂质等物质,尤其是盐离子,对双向电泳的结果影响极大。盐离子浓度过高通常会导致聚焦电流过大,聚焦时间过长或最终达不到设定电压等问题,严重的会导致IPG胶条拱起或烧坏。双向电泳蛋白样品不仅要求纯度高,蛋白丰度也有很高的要求。如果在蛋白提取或纯化过程中损失大量的蛋白,就失去了差异蛋白分析的意义。本实验通过丙酮沉淀和TCA-丙酮沉淀两种方法纯化蛋白发现:丙酮沉淀法制备的蛋白样品条带较少且不清晰,样品中的蛋白种类单一,说明在提取过程中有大量的蛋白损失。此法不可作为一种有效的蛋白纯化手段用于双向电泳。TCA-丙酮法纯化法获得的蛋白样品种类多,表现为条带丰富清晰,说明TCA-丙酮法较之丙酮法,在蛋白纯度和丰度上具有显著的优势,用此法纯化的蛋白适于双向电泳实验。
对不同氮源培养的微藻进行蛋白提取发现,氨氮培养的微藻在同样提取条件下得到的蛋白样品浓度始终低于MSE培养的微藻蛋白样品。说明氨氮培养条件下细胞内可溶性蛋白含量降低,这一结果与之前的报道一致[14]。如前所述,低浓度的氨态氮可以更容易被微藻吸收利用,但高浓度的氨态氮却可以抑制微藻的生长。而更高浓度的氨态氮则会对微藻产生严重的毒害作用。这些毒害作用包括较低的生物量合成速率、油脂含量以及细胞代谢速率。显然,这些宏观的表征的变化是由细胞内部代谢调控的变化引起的,甚至可能在基因表达调控的层面。比较正常培养基(硝态氮)与氨态氮培养的微藻蛋白表达差异发现,氨氮毒害下微藻蛋白表达确实发生了很大的变化。相比于正常状态,氨氮培养的微藻表达蛋白谱中有85个表达量降低的蛋白,25个表达升高的蛋白。值得注意的是,有些蛋白点虽然具有不同的相对分子量和pH(A70和A82),但其飞行质谱检测结果却是同样的蛋白。其他的研究也曾报道过类似的现象并推测它们是同一个基因的表达产物,只是表达后修饰不同而引起的,或者也可能是隶属于同一个蛋白家族[15]。飞行质谱检测和数据库检索发现,这些蛋白涉及光合作用、二氧化碳固定、糖酵解、蛋白质合成及非正常折叠蛋白降解,细胞分裂和物质运输,以及自由基清除等途径。以上结果为后续深入的氨氮毒性机理研究奠定了基础。

图3 硝态氮(A和C)与氨态氮(B和D)培养的微藻Scenedesmus sp.蛋白表达差异
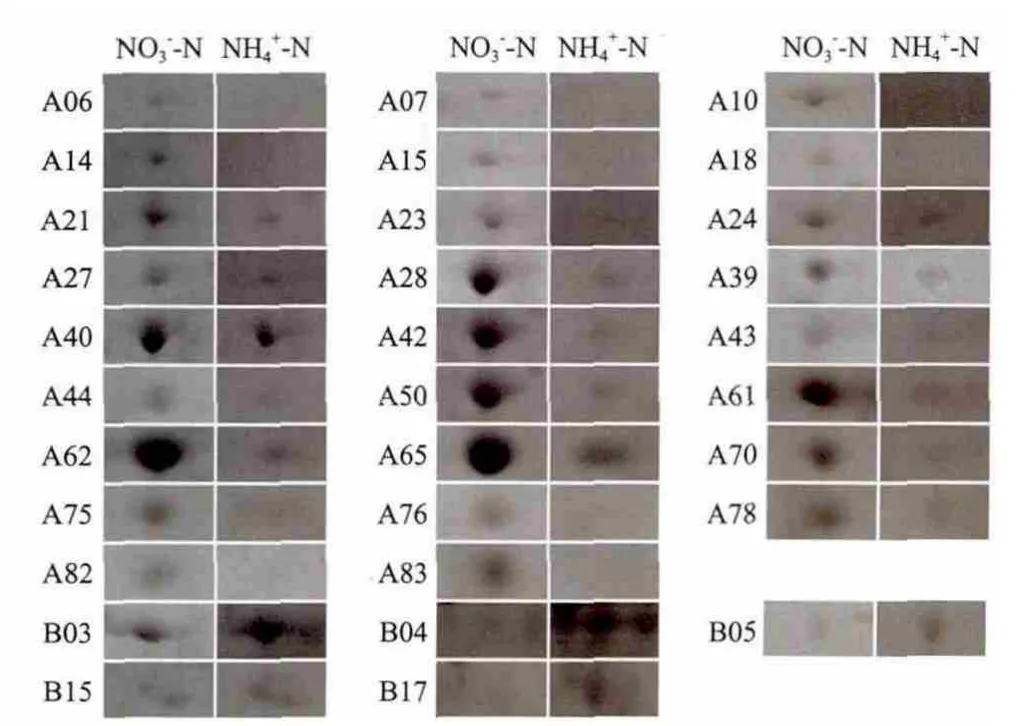
图4 检测的26个表达量降低的蛋白和5个表达量升高的蛋白局部放大图
4 结论
本实验通过比较两种微藻细胞破碎方法和两种微藻细胞蛋白纯化方法,确定了通过液氮研磨破碎细胞和TCA-丙酮沉淀提纯蛋白质的双向电泳蛋白样品提取方法,用此方法不仅细胞破碎完全,且提取的蛋白溶解性好、纯度高、丰度高。运用这种提取工艺初步探究了氨氮毒害作用下栅藻Scenedesmus sp.蛋白表达差异,检测到的差异单白涉及光合作用,二氧化碳固定、糖酵解、蛋白质合成及非正常折叠蛋白降解、细胞分裂和物质运输,以及自由基清除等途径等代谢通路。
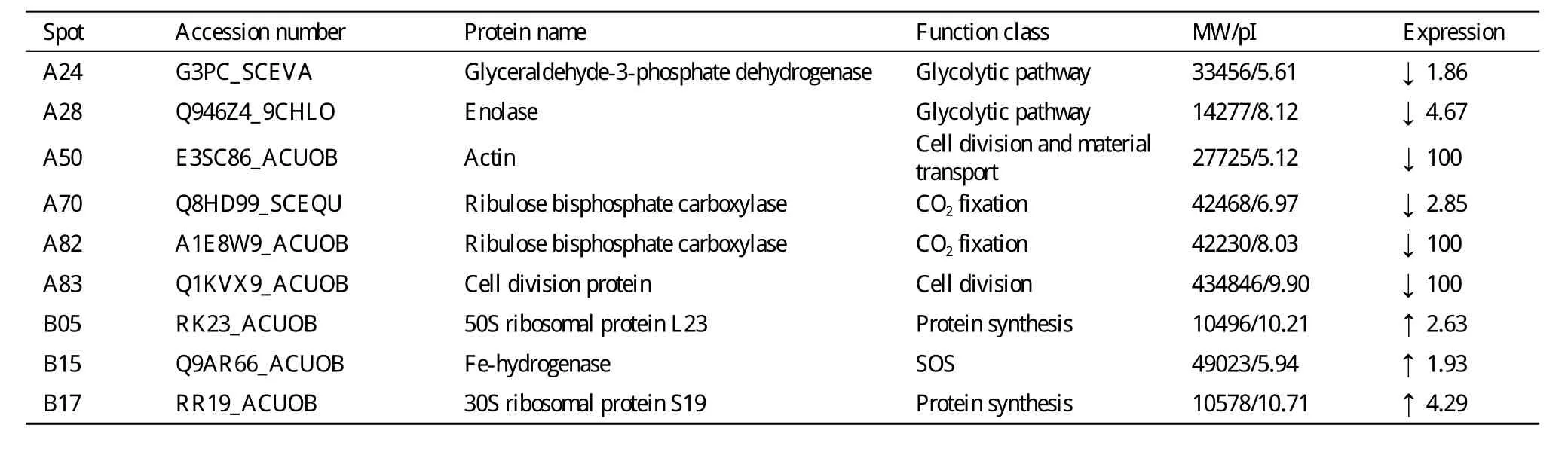
表2 MALDI-TOF-MS/MS检测到的栅藻Scenedesmus sp.在氨态氮与硝态氮作用下差异表达的蛋白
[1]Birney E, Stamatoyannopoulos J, Dutta A, et al. Consortium,identification and analysis of functional elements in 1% of the human genome by the ENCODE pilot project[J]. Nature, 2007, 447:799-816.
[2]Nunn B, Aker J, Shaffer S, et al. Deciphering diatom biochemical pathways via whole-cell proteomics[J]. Aquatic Microbial Ecology, 2009, 55:241-253.
[3]Celis J, Ostergaard M, Jensen N, et al. Human and mouse proteomic databases:novel resources in the protein universe[J]. FEBS Lett, 1998, 430:64-72.
[4]Gygi S, Corthals G, Zhang Y, et al. Evaluation of two-dimensional gel electrophoresis-based prote ome analysis technology[J].Proceedings of the National Academy of Sciences of theUnited States of America, 2000, 97:9390-9395.
[5]Wang S, Hu Q, Sommerfeld M, et al. An optimized protocol for isolat ion of soluble proteins from microalgae for two-dimensional gel electrophoresis analysis[J]. J Appl Phycol, 2003, 15:485-496.
[6]Simon W, Hall J, Suzuki I, et al. Proteomic study of the soluble proteins from the unicellular cyanobacterium Synechocystis sp PCC6803 using automated matrix-assisted laser desor ption/ionization-time of flight peptide mass fingerprinting[J].Proteomics, 2002, 2:1735-1742.
[7]Collos Y, Harrison P. Acclimation and toxicity of high ammonium concentrations to unicellular algae[J]. Mar Pollut Bull, 2014,80:8-23.
[8]Barsanti L, Gualtieri P. Algae:anatomy, biochemistry, and biotechnology[M]. 2nd ed. Boca Raton:CRC press, 2014.
[9]Li X, Hu H, Gan K, et al. Growth and nutrient removal properties of a freshwater microalga Scenedesmus sp. LX1 under different kinds of nitrogen sources[J]. Ecological Engineering, 2010, 36:379-381.[10]Chen M, Tang H, Ma H, et al. Effect of nutrients on growth and lipid accumulation in the green algae Dunaliella tertiolecta[J].Bioresource T echnol, 2011, 102:1649-1655.
[11]Eustance E, Gardner R, Moll K, et al. Growth, nitrogen utilization and biodiesel potential for two chloroph ytes grown on ammonium,nitrate or urea[J]. J Appl Phycol, 2013, 25:1663-1677.
[12]Dai G, Shang J, Qiu B. Ammonia ma y play an important role in the succession of cyanobacterial blooms and the distribution of common algal species in shallow freshwater lakes[J]. Global Change Biology, 2012, 18:1571-1581.
[13]Abeliovich A, Azov Y. Toxicity of ammonia to algae in sewage oxidation ponds[J]. Appl Environ Microbiol, 1976, 31:801-806.
[14]Villazan B, Pedersen M, Brun F, et al. Elevated ammonium concentrations and low light form a dangerous synergy for eelgrass Zostera marina[J]. Marine Ecology Progress Series, 2013, 493:141-154.
[15]Li Q, Mu J, Chen D, et al. Production of biomass and lipid by the microalgae Chlorella protothecoides with heterotrophic-Cu(II)stressed(HCuS)coupling cultivation[J]. Bioresource Technol,2013, 148:283-292.

