中老年食管癌与体质指数及腰臀比的关系研究
闫立辉,陕忠远,孙 颖,阎 英,卢智泉
中老年食管癌与体质指数及腰臀比的关系研究
闫立辉,陕忠远,孙 颖,阎 英,卢智泉
目的 探讨中老年人体质指数(BMI)、腰臀比 (WHR)与食管癌的关系。方法 采用以医院为基础的病例对照研究。选取2012年9月—2013年3月入住辽宁医学院附属第一医院、附属第三医院和锦州市中心医院肿瘤科和胸外科病房,经临床组织病理学诊断为食管癌,年龄≥40岁的 282例食管癌患者为病例组;选取与病例同期入住相同医院,未患食管及其他消化系统癌症,罹患其他疾病的282例患者为对照组。采用标准调查表对患者进行面对面调查,同时对身高、体质量、腰围、臀围进行测量,并计算BMI及WHR。结果 两组患者的年龄、性别、职业、文化程度、居住地及高血压史间差异均无统计学意义 (P>0.05);家庭人均月收入、吸烟、饮酒及糖尿病史间差异均有统计学意义 (P<0.05)。病例组的 BMI为 (24.43±3.40)kg/m2,对照组为 (22.79±3.30)kg/m2;病例组男性的WHR为 (0.96±0.05),对照组男性为 (0.91±0.05);病例组女性的WHR为 (0.95±0.05),对照组女性为 (0.90 ±0.07),两组间差异均有统计学意义 (P<0.05)。单因素 Logistic回归分析结果显示,病例组BMI为24.00~27.99 kg/m2、≥28.00 kg/m2患者发生食管癌的危险性分别为对照组 BMI为 18.50~23.99 kg/m2患者的1.526倍和1.817倍;WHR>0.95患者发生食管癌的危险性是对照组WHR<0.83患者的1.854倍。在调整了性别、年龄等多种混杂因素后,多因素 Logistic回归分析结果显示,与对照组 BMI为 18.50~23.99 kg/m2患者比较,病例组 BMI为 24.00~27.99 kg/m2、≥28.00 kg/m2患者发生食管癌的危险性分别升高59.4%和78.2%;与 WHR<0.83的患者比较,WHR 为0.83~0.89、0.90~0.94、>0.94患者发生食管癌的危险性分别升高4.8%、32.6%和36.5%。结论 BMI、WHR是发生食管癌的重要危险因素,超重和肥胖的人群发生食管癌的危险性明显增加,维持正常体质量可能是食管癌发病的保护因素。
食管肿瘤;体质指数;腰臀比;病例对照研究
闫立辉,陕忠远,孙颖,等.中老年食管癌与体质指数及腰臀比的关系研究 [J].中国全科医学,2015,18 (1):41-46.[www.chinagp.net]
Yan LH,Shan ZY,Sun Y,et al.Association of body mass index,waist-hip ratio with the risk of esophageal cancer in middle-aged and elderly people[J].Chinese General Practice,2015,18(1):41-46.
食管癌系指由食管鳞状上皮或腺上皮的异常增生所形成的恶性病变,是世界上一些国家和地区常见的恶性肿瘤。我国是世界上食管癌的高发国家,也是世界上食管癌高死亡率的国家之一。根据国际癌症研究署(IARC)2014年公布的2012年世界癌症发病与死亡报告 (Globocan 2012)估计,全球食管癌发病455 784例,中国 223 306例,占全球的48.99%;同期全球死亡400 156例,中国 197 472例,占 49.35%[1]。国家癌症中心 “我国肿瘤登记地区恶性肿瘤发病和死亡分析”公布的结果显示,2010年食管癌发病率 (21.88/10万)继肺癌、乳腺癌、胃癌、肝癌之后列第5位;死亡率(15.85/10万)列第 4位。我国城市食管癌发病率(16.55/10万)列第6位;死亡率 (12.19/10万)列第5位;农村地区食管癌发病率 (27.29/10万)继肺癌、胃癌、肝癌之后列第4位;死亡率 (19.58/10万)同样继肺癌、肝癌、胃癌之后列第4位[2]。随着社会经济的发展,我国居民的生活习惯及饮食结构发生改变,我国食管癌的发病率和死亡率在城市地区呈现下降趋势。在食管癌高发地区,经过30多年的防治努力,食管癌发病率和死亡率已经呈现下降趋势,但仍处于相当高的水平,给社会经济造成沉重的负担,严重地影响当地社会经济的健康发展[3]。尽管该病的患病率较高,给患者身心健康带来了极大的痛苦和负担,但其病因学及自然史仍然不十分清楚。有研究表明,食管癌的发生可能是亚硝胺类化合物、霉菌及其毒素污染、营养不平衡、不良生活方式、饮食习惯及遗传易患性等多种因素综合作用的结果[4-5]。此外,国内外病 因流行 病学研究 还认为,食管癌的发病主要与环境和膳食因素有关,包括食用新鲜水果和蔬菜较少、多种微量营养素摄入状况较差等原因[6-7]。但是肥 胖 〔体质指数 (BMI)和腰臀比(WHR)增加〕与食管癌之间关系的报道较少,报道的结果也不一致[8-9]。为此,本研究采用以医院为基础的病例对照研究方法,选择一组食管癌患者,匹配一组非食管癌患者为对照组,调查并比较两组患者的一般人口学特征、生活方式及身体测量值 (身高、体质量、腰围及臀围)的差异,确定食管癌与BMI及WHR之间的关联,为食管癌的人群防治及干预措施的实施提供科学依据。
1 对象与方法
1.1 研究对象 选取于2012年9月—2013年3月入住辽宁医学院附属第一医院、附属第三医院和锦州市中心医院肿瘤科和胸外科病房,经临床组织病理学诊断为食管癌,由专职医生确诊及分类,年龄≥40岁的282例食管癌患者为病例组。病例组的纳入标准:(1)年龄≥40岁的男性和女性;(2)锦州地区常住居民;(3)经临床内镜、X线或组织病理学检查,诊断为食管癌≥3个月,以前未经治疗者;(4)在上述3所医院因食管癌而施行手术者;(5)经临床组织病理学确诊为食管癌,并实施化疗者;(6)愿意配合完成调查问卷者[7]。病例组的排除标准:(1)罹患食管疾患,如食管炎、食管憩室及食管静脉曲张的患者;(2)罹患食管良性肿瘤、贲门失弛症及食管良性狭窄者;(3)罹患胃食管反流疾病 (gastroesophageal reflux disease,GERD)患者;(4)曾因非食管癌而施行了食管手术者;(5)近3个月来服用任何治疗食管疾患药物的患者;(6)不愿或不能完成调查问卷者。为增加两组间的可比性,控制混杂因素对结果的影响,按照年龄(±5岁)、性别和居住地为每个病例匹配1例对照。选取与病例同期入住相同医院,未患食管及其他消化系统癌症,罹患其他疾病的282例患者为对照组。对照组的纳入标准:(1)与病例的性别相同;(2)年龄相差±5岁;(3)未患食管及其他影响消化道系统的疾病;(4)3个月来未服用任何治疗食管及其他消化系统疾病的药物;(5)未患消化系统的肿瘤;(6)愿意配合完成调查问卷者。对照组的排除标准:(1)经临床内镜、X线或组织病理学检查,被诊断为食管癌≥3个月者;(2)在上述3所医院因患食管癌而施行手术者;(3)经病理组织学确诊为食管癌,并实施化疗者;(4)罹患GERD患者;(5)近3个月来服用任何治疗食管疾患药物的患者;(6)不愿或不能完成调查问卷者。所有患者均对本调查知情并同意。
1.2 方法 采用自行设计的标准调查表对患者进行面对面调查,收集人口学 (年龄、性别等)、生活方式(吸烟、饮酒、体育锻炼等)、社会经济状况 (文化水平、职业及家庭经济收入等)、个体疾病史 (高血压、糖尿病、心血管疾病等)、食管癌家族遗传史等资料。经专业训练的调查员采用标准化设计方案进行身高、体质量的测量。受检者赤足和着单衣测量身高和体质量。身高的测量值四舍五入到最接近的cm,体质量值取最接近的100 g。腰围测定:受检者直立,双足分开25~35 cm,用软皮尺在受检者腰部肋骨下缘和髂嵴连线中点处紧贴而不压迫皮肤,沿水平方向围绕腹部1周,读数精确到0.1 cm。臀围测定:测量时,受检者两腿并拢直立,两臂自然下垂,将皮尺水平放在前面的耻骨联合和背后臀大肌最凸处,测量臀部最大周径,读数精确到0.1 cm。血压测定:在受检者坐下≥5 min后进行3次血压测量,最后两次读数的均值用于数据分析。
1.3 判断标准 根据我国成人BMI标准,体质量过低:BMI<18.50 kg/m2;一般体质量:BMI为18.50~23.99 kg/m2;超重:BMI为24.00~27.99 kg/m2;肥胖:BMI ≥28.00 kg/m2[10]。WHR=腰围 (cm)/臀围 (cm),男性WHR≤0.90和女性≤0.88为正常;男性WHR>0.90和女性 >0.88为肥胖[11]。对BMI和WHR的评估采用四分位数,作为连续变量。为降低极端值 (过高或过低)对研究结果的影响,采用BMI和WHR四分位数的中位数值,以表示在同样的四分位数中,对所有研究对象的暴露情况进行线性趋势性检验。目前流行病学调查常采用BMI作为全身性肥胖的界定指标,将腰围或WHR作为向心性肥胖或腹型肥胖的界定指标[12]。
1.4 潜在性混杂因素的测量与控制 有研究报道,GERD是食管癌发病的一个重要危险因素,而与BMI无关[7,13]。为进一步控制混杂因素对研究结果的影响,对照组额外完成了一份有关许多潜在性混杂因素,包括GERD型症状的综合性问卷。GERD问题针对:(1)对过去6个月内的症状进行评估,包括是否存在“胃灼热、消化不良或腹部疼痛”;(2)中腹部或上腹部是否经常存在不适感;(3)摄入食物时是否服用抗酸剂来缓解症状;(4)腹部不适或疼痛是否与体位有关(如卧位或弯腰);(5)是否经常服用抗酸剂药物;(6)有无食管裂孔疝的诊断史等。经初步分析,GERD型症状被定义为对下列所有3个组分回答为“是”:(1)是否存在 “胃灼热、消化不良或腹部疼痛”;(2)位置在上腹部;(3)服用抗酸剂药物症状缓解。如果存在GERD型症状,这样的对照则将被排除[7,13]。
1.5 统计学方法 采用SPSS 16.0统计软件进行统计学分析。计量资料以 (±s)表示,采用t检验,计数资料采用χ2检验,采用多因素 Logistic回归模型估计BMI、WHR与发生食管癌危险性的比值比 (odds ratio,OR)及其95%可信区间 (confidence interval,CI)。以P<0.05为差异有统计学意义。
2 结果
2.1 病例组与对照组一般特征的比较 病例组 282例患者,年龄42~76岁,平均 (55±10)岁;对照组282例患者,年龄42~76岁,平均 (55±10)岁。两组患者的年龄、性别、职业、文化程度、居住地及高血压史间差异均无统计学意义 (P>0.05);家庭人均月收入、吸烟、饮酒及糖尿病史间差异均有统计学意义 (P<0.05,见表1)。
2.2 病例组与对照组 BMI、WHR的比较 病例组的BMI为 (24.43±3.40)kg/m2,对照 组 为 (22.79 ±3.30)kg/m2,两组间差异有统计学意义 (t=3.52,P=0.002)。将患者按照年龄进行分层后,45~、50~、65~、76岁年龄段两组BMI间差异有统计学意义 (P<0.05)。病例组男性的WHR为 (0.96±0.05),对照组男性为 (0.91±0.05),两组间差异有统计学意义 (t= 4.68,P=0.001);病例组女性的 WHR为 (0.95 ±0.05),对照组女性为 (0.90±0.07),两组间差异有统计学意义 (t=4.47,P=0.002)。将患者按照年龄进行分层后,50~、55~、65~、70~年龄段两组男性患者WHR间差异有统计学意义 (P<0.05);42~、45~、50~、55~、65~、76岁年龄段两组女性患者WHR间差异有统计学意义 (P<0.05,见表2)。
2.3 BMI、WHR与食管癌的关系 单因素Logistic回归分析结果显示,病例组BMI为24.00~27.99 kg/m2、≥28.00 kg/m2患者发生食管癌的危险性分别为对照组BMI为18.50~23.99 kg/m2患者的1.526倍 〔95%CI (1.032,2.524)〕和 1.817倍 〔95%CI(1.163,2.857)〕;WHR>0.95患者发生食管癌的危险性是对照组 WHR<0.83患者的 1.854倍 〔95%CI(1.165,2.941)〕。在调整了性别、年龄等多种混杂因素后,多因素 Logistic回归分析结果显示,与对照组 BMI为18.50~23.99 kg/m2患者比较,病例组BMI为24.00~27.99 kg/m2、≥28.00 kg/m2患者发生食管癌的危险性分别升高 59.4% 〔OR=1.594;95%CI(1.058,2.587)〕和 78.2% 〔OR=1.782;95%CI(1.101,2.786)〕;与WHR<0.83的患者比较,WHR为0.83~0.89、0.90~0.94、>0.94患者发生食管癌的危险性分别升高 4.8% 〔OR=1.048;95%CI(1.012,1.532)〕、32.6% 〔OR=1.326;95%CI(1.023,1.741)〕和36.5% 〔OR=1.365;95%CI(1.148,1.865),见表3〕。
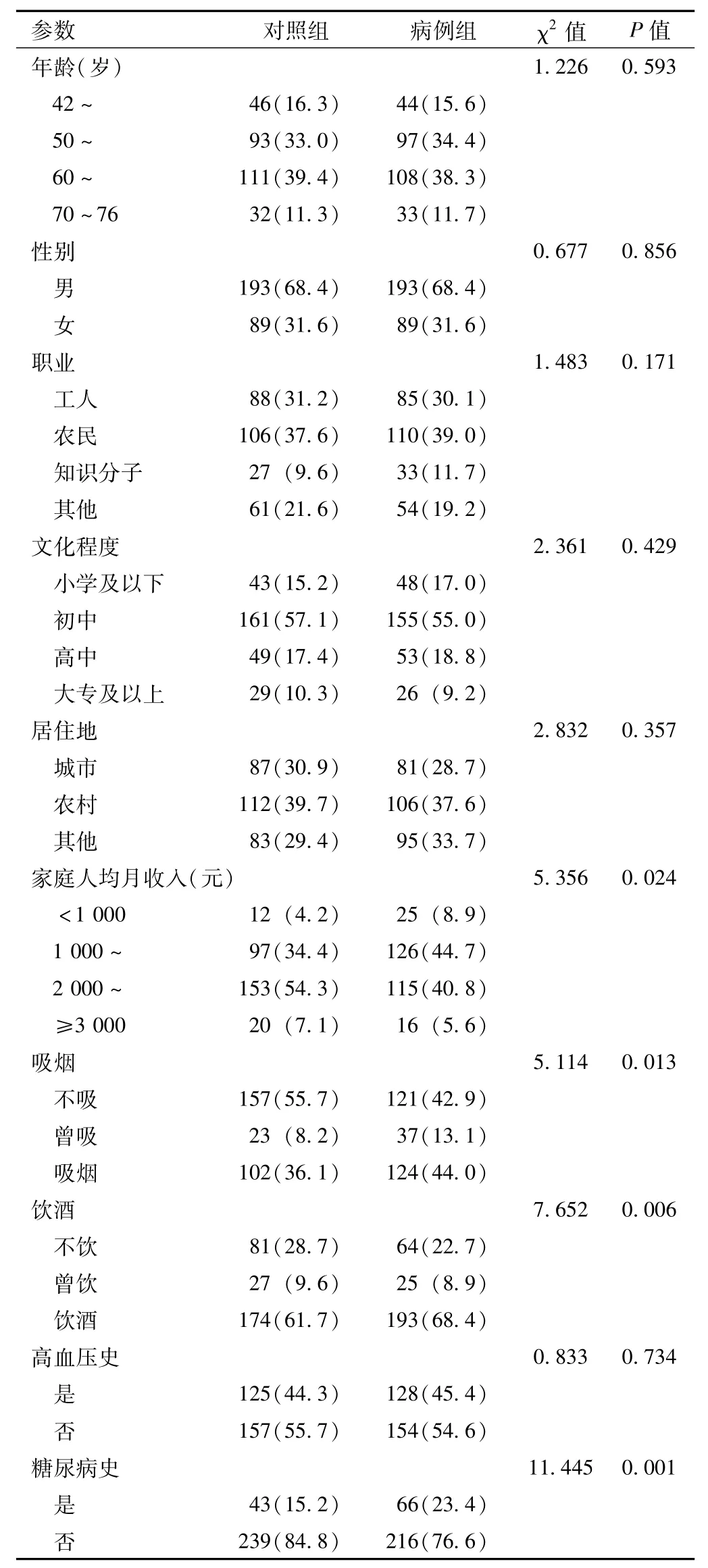
表1 病例组与对照组一般特征的比较 〔n(%)〕Table 1 Comparison of general characteristics between case group and control group
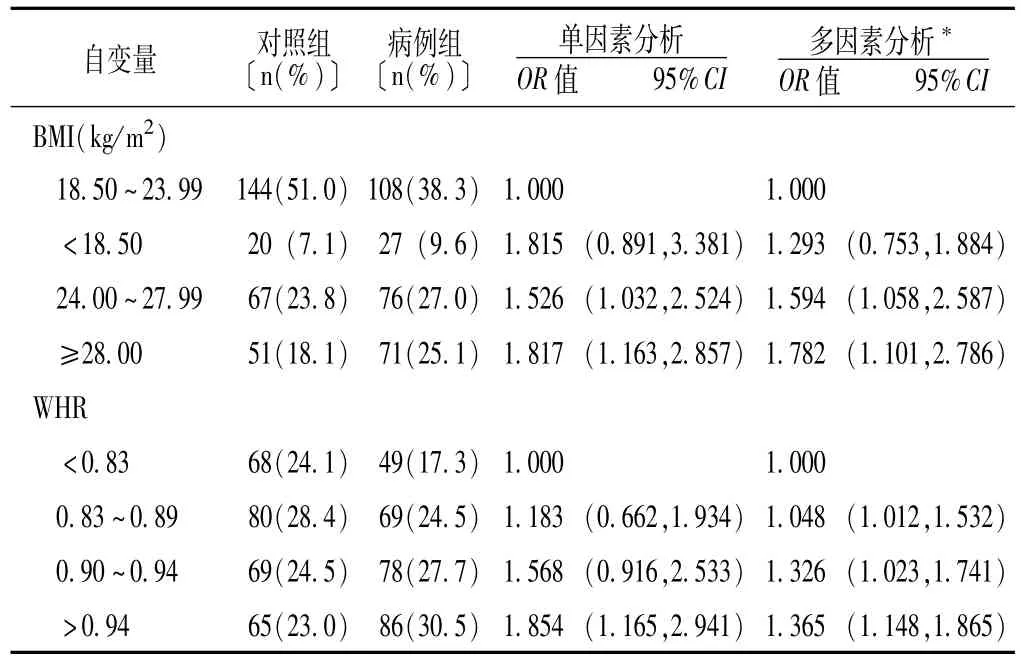
表3 BMI、WHR与食管癌的关系Table 3 Association of body mass index and waist-hip ratio with the risk of esophageal cancer
3 讨论
本研究结果显示,两组患者的年龄、性别、职业、文化程度、居住地以及高血压史间差异均无统计学意义,这与报道的结果基本一致[5,7]。有研究者对吸烟、饮酒与食管癌之间的关联进行了Meta分析(纳入14篇文献),结果显示:吸烟与食管癌p53蛋白高表达、p53基因改变 (p53蛋白高表达+p53基因突变)的合并OR值分别为1.99〔95%CI(1.30,3.06)〕、1.64〔95% CI(1.13,2.37)〕(P<0.05)[14]。无论是吸烟及饮酒的时间,还是消耗的数量,均与食管癌的危险性之间呈现明显的剂量-反应关系,国内外研究者对这一结果的报道基本一致[15-17]。本研究 还观察到,病例组糖 尿病史发生率高于对照组,与其他研究者的结果基本一致。研究者对糖尿病与食管癌之间的关联进行了Meta分析(纳入6篇文献),结果显示:无论男性还是女性,病例组的糖尿病比例均高于对照组,且女性较男性糖尿病人群的OR值更高 〔女性:OR=1.58,95%CI(1.14,2.18);男性:OR=1.41,95%CI(1.07,1.86)〕。其结论是糖尿病与食管癌存在关联,可能是食管癌的一个独 立危 险因素[18]。
本研究结果显示,病例组各年龄段的BMI均高于对照组,其中 45~、50~、65~、76岁年龄段两组间有差异;病例组男性 WHR均高于对照组,病例组女性WHR亦高于对照组,其中50~、55~岁男性两组间WHR差异明显,42~、45~岁女性两组间差异明显。经单因素Logistic回归分析结果显示,病例组超重、肥胖患者发生食管癌的危险性分别为对照组正常体质量者的1.526和1.817倍;WHR>0.95患者发生食管癌的危险性是对照组WHR<0.83患者的1.854倍。在调整了多种潜在性混杂因素,经多因素 Logistic回归分析结果显示,与对照组体质量正常者相比较,病例组超重和肥胖者发生食管癌的危险性分别升高59.4% (OR= 1.594)和78.2% (OR=1.782);与WHR<0.83的患者比较,WHR为0.83~0.89、0.90~0.94、>0.94患者发生食管癌的危险性分别升高 4.8%、32.6%和36.5%。Steffen等[18]对参 加欧洲 癌 症与 营 养调查 的346 554例研究对象进行了一项前瞻性研究,在8.9年的随访期间,共观察了198例食管癌新发病例。调查的结果显示,BMI、腰围、WHR均与发生食管癌的危险性呈正相关 〔最高与最低的五分位数相比较,RR=2.60,95%CI(1.23,5.51),P<0.01〕。
目前认为,超重和肥胖者体内脂肪代谢活跃,并可产生多种化合物,通过血液循环流遍全身,并且腹内脂肪的代谢活动与周围的脂肪不同[19]。其中的一些代谢产物,如胰岛素样生长因子 (IGF)和瘦素,已证明与恶性肿瘤有关,可能通过在细胞周期的促生长变化的诱导作用,减少细胞死亡,并在细胞水平上产生相似的促肿瘤变化[20-21],这些化合物可直接影响肿瘤的发生与发展。
综上所述,BMI、WHR增加与食管癌发病的危险性增加有关,是食管癌重要的危险因素,这与国外的研究报道基本相符。无论是超重还是肥胖的人群,发生食管癌的危险性明显增高。保持正常体质量、合理膳食、参加适当的体力活动发生食管癌的危险性可能较低。因此,应该倡导正确的膳食习惯,如合理膳食、均衡营养、适量摄取蛋白质、减少高热能食物的摄入,以及采取有益健康的生活方式,如参加更多的体力活动或体育锻炼,维持正常的BMI和WHR,以有效预防食管癌的发生。
表2 病例组与对照组不同年龄患者 BMI和 WHR的比较 (±s)Table 2 Comparison of body mass index and waist to hip ratio in different ages patients between case group and control group
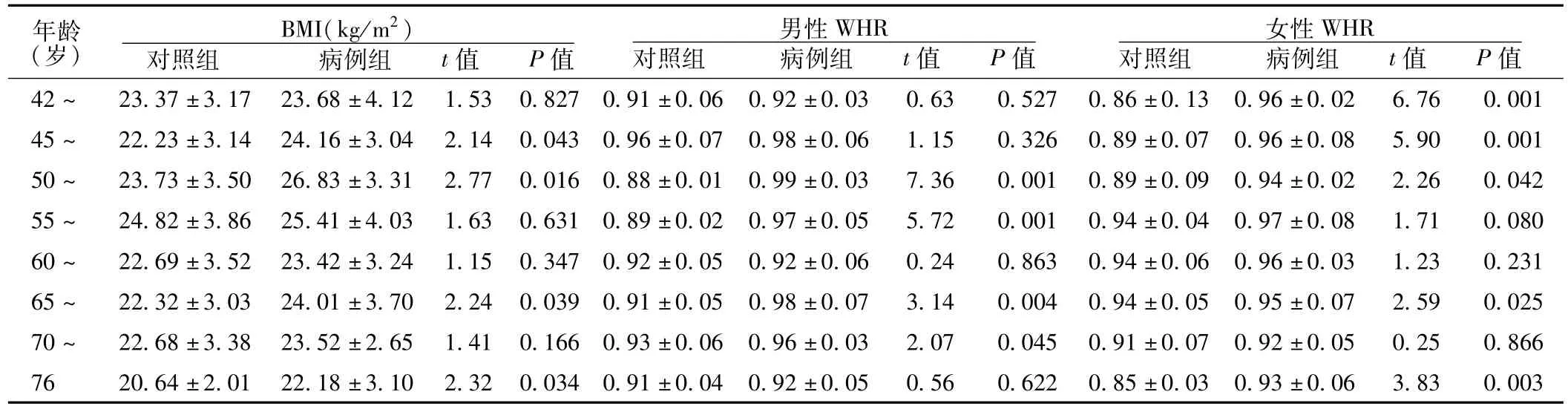
表2 病例组与对照组不同年龄患者 BMI和 WHR的比较 (±s)Table 2 Comparison of body mass index and waist to hip ratio in different ages patients between case group and control group
注:BMI=体质指数,WHR=腰臀比
年龄(岁)BMI(kg/m2)对照组 病例组 t值 P值男性WHR对照组 病例组 t值 P值 女性WHR对照组 病例组 t值 P值42~ 23.37±3.17 23.68±4.12 1.53 0.827 0.91±0.06 0.92±0.03 0.63 0.527 0.86±0.13 0.96±0.02 6.76 0.001 45~ 22.23±3.14 24.16±3.04 2.14 0.043 0.96±0.07 0.98±0.06 1.15 0.326 0.89±0.07 0.96±0.08 5.90 0.001 50~ 23.73±3.50 26.83±3.31 2.77 0.016 0.88±0.01 0.99±0.03 7.36 0.001 0.89±0.09 0.94±0.02 2.26 0.042 55~ 24.82±3.86 25.41±4.03 1.63 0.631 0.89±0.02 0.97±0.05 5.72 0.001 0.94±0.04 0.97±0.08 1.71 0.080 60~ 22.69±3.52 23.42±3.24 1.15 0.347 0.92±0.05 0.92±0.06 0.24 0.863 0.94±0.06 0.96±0.03 1.23 0.231 65~ 22.32±3.03 24.01±3.70 2.24 0.039 0.91±0.05 0.98±0.07 3.14 0.004 0.94±0.05 0.95±0.07 2.59 0.025 70~ 22.68±3.38 23.52±2.65 1.41 0.166 0.93±0.06 0.96±0.03 2.07 0.045 0.91±0.07 0.92±0.05 0.25 0.866 76 20.64±2.01 22.18±3.10 2.32 0.034 0.91±0.04 0.92±0.05 0.56 0.622 0.85±0.03 0.93±0.06 3.83 0.003
[1]IARC.Estimated cancer incidence,mortality and prevalence worldwide in 2012[EB/OL].http://globocan.iarc.fr/Pages/fact_sheets_ population.aspx.
[2]Chen WQ,Zhang SW,Zeng HM,et al.Report of cancer incidence and mortality in China,2010[J].China Cancer,2014,23(1):1-10.(in Chinese)陈万青,张思维,曾红梅,等.中国2010年恶性肿瘤发病与死亡 [J].中国肿瘤,2014,23(1):1-10.
[3]Zhang SW,Zhang M,Li GL,et al.An analysis of incidence and mortality of esophageal cancer in China,2003~2007[J].China Cancer,2012,21(4):1-12.(in Chinese)张思维,张敏,李光琳,等.2003~2007年中国食管癌发病与死亡分析 [J].中国肿瘤,2012,21(4):1-12.
[4]Ji AF,Wang JS,Yang JZ,et al.A case-control study on the risk factors of esophageal cancer in southeast of Shanxi Province[J]. Modern Preventive Medicine,2012,39(12):2929-2931. (in Chinese)纪爱芳,王金胜,杨建洲,等.山西省东南部地区居民食管癌危险因素的病例对照研究 [J].现代预防医学,2012,39(12):2929-2931.
[5]Xu JC,Liu GH,Zhou FJ,et al.A case-control study on the risk factors of esophageal cancer in Xuzhou of Jiangsu[J].Modern Preventive Medicine,2010,37(10):1812-1814.(in Chinese)徐继承,刘桂红,周凤娟,等.江苏省徐州地区居民食管癌危险因素的病例对照研究 [J].现代预防医学,2010,37(10):1812-1814.
[6]Freedman ND,Park Y,Subar AF,et al.Fruit and vegetable intake and esophageal cancer in a large prospective cohort study[J].Int J Cancer,2007,121(12):2753-2760.
[7]苏乃伟.基质金属蛋白酶与食管癌侵袭转移关系的研究进展[J].实用心脑肺血管病杂志,2012,20(1):182.
[8]Steffen A,Schulze MB,Pischon T,et al.Anthropometry and esophageal cancer risk in the European prospective investigation into cancer and nutrition[J].Cancer Epidemiol Biomarkers Prev,2009,18(7):2079-2089.
[9]Corley DA,Kubo A,Zhao W.Abdominal obesity and the risk of esophageal and gastric cardia carcinomas[J].Cancer Epidemiol Biomarkers Prev,2008,17(2):352-358.
[10]中国肥胖问题工作组数据汇总分析协作组.我国成人体质量指数和腰围对相关疾病危险因素异常的预测价值:适宜体质量指数和腰围切点的研究[J].中华流行病学杂志,2002,23 (1):5-10.
[11]付鹏钰.中国成人肥胖的患病率、危险因素及适宜腰臀比切点的探讨 [D].郑州:郑州大学,2007:13-18.
[12]Dirani M,Xie J,Fenwick E,et al.Are obesity and anthropometry risk factors for diabetic retinopathy?The diabetes management project [J].Invest Ophthalmol Vis Sci,2011,52(7):4416-4421.
[13] Lagergren J,Bergstrom R,Lindgren A,et al.Symptomatic gastroesophageal reflux as a risk factor for esophageal adenocarcinoma [J].N Engl J Med,1999,340(11):825-831.
[14]Wang B,Zhang Y,Xu DZ,et al.Meta-analysis on the relationship between tobacco smoking,alcohol drinking and p53 alteration in cases with esophageal carcinoma[J].Chinese Journal of Epidemiology,2004,25(9):775-778.(in Chinese)王波,张艳,徐德忠,等.吸烟、饮酒与食管癌 p53基因改变的Meta分析 [J].中华流行病学杂志,2004,25(9):775-778.
[15]Hardikar S,Onstad L,Blount PL,et al.The role of tobacco,alcohol,and obesity in neoplastic progression to esophageal adenocarcinoma:a prospective study of Barrett′s esophagus[J]. PLoS One,2013,8(1):e52192.
[16]Kimm H,Kim S,Jee SH.The independent effects of cigarette smoking, alcohol consumption, and serum aspartate aminotransferase on the alanine aminotransferase ratio in korean men for the risk for esophageal cancer[J].Yonsei Med J,2010,51(3):310-317.
[17]Wu M,Zhao JK,Zhang ZF,et al.Smoking and alcohol drinking increased the risk of esophageal cancer among Chinese men but not women in a high-risk population[J].Cancer Causes&Control,2011,22(4):649-657.
[18]Shi YH,Hou LY,Qiu JL.Association between diabetes mellitus and esophageal cancer:a meta-analysis of case-control studies [J].Chinese General Practice,2013,16(1):289-291,297. (in Chinese)石益海,侯丽英,裘炯良.糖尿病与食管癌病例对照研究的Meta分析 [J].中国全科医学,2013,16(1):289-291,297.
[19]El-Serag HB,Tran T,Richardson P,et al.Anthropometric correlates of intragastric pressure[J].Scand J Gastroenterol,2006,41(8):887-891.
[20]Renehan AG,Zwahlen M,Minder C,et al.Insulin-like growth factor(IGF) -I,IGF binding protein-3,and cancer risk:systematic review and meta-regression analysis[J].Lancet,2004,363(9418):1346-1353.
[21]Attoub S,Noe V,Pirola L,et al.Leptin promotes invasiveness of kidney and colonic epithelial cells via phosphoinositide 3-kinase-,rho-,and rac-dependent signaling pathways[J].FASEB J,2000,14(14):2329-2338.
Association of Body Mass Index,Waist-hip Ratio with the Risk of Esophageal Cancer in Middle-aged and Elderly People
YAN Li-hui,SHAN Zhong-yuan,SUN Ying,et al.Postgraduate Training Base of General Hospital of Shenyang Military Command,Liaoning Medical University,Shenyang 110016,China
Objective To explore the association between body mass index(BMI),waist to hip ratio(WHR)and esophageal cancer risk in middle aged and elderly people.Methods A hospital-based case-control study was conducted.Cases (n=282)were esophageal cancer patients who were hospitalized in department of oncology and chest surgery,the First Affiliated Hospital and the Third Affiliated Hospital,Liaoning Medical University and Central Hospital,Jinzhou from September,2012 to March,2013 and confirmed by clinical histopathological examination,and controls(n=282)were patients admitted to the same hospital for different diseases.All of them received face-to-face investigation with a standardized questionnaire.Their height and weight,waist circumference and hip circumference were measured and BMI and WHR were calculated.Results There was no statistically significant difference between two groups about age,gender,occupation,education background,and place of residence,as well as the history of hypertension(P>0.05);but the differences in monthly family income per person,drinking,smoking and diabetic history were significant(P<0.05).BMI was(24.43±3.40)kg/m2in case group and (22.79±3.30)kg/m2in control group;WHR was(0.96±0.05)in male cases,(0.91±0.05)in male controls,(0.95±0.05)in female cases,and(0.90±0.07)in female controls and the differences between the two groups were significant(P <0.05).Univariate Logistic regression showed the danger of occurrence of esophageal cancer in case patients whose BMI was 24.00~27.99 kg/m2,≥28.00 kg/m2was 1.526 times and 1.817 times respectively that in control patients whose BMI was 18.50~23.99 kg/m2;the danger in case groups whose WHR was>0.95 was 1.854 times that in control group whose WHR was <0.83.After adjusting many confounding factors such as age and gender,etc.,multiple logistic regression analysis showed that compared with that in the patients in control whose BMI was 18.50~23.99 kg/m2,the danger of the occurrence in case group patients whose BMI was 24.00~27.99 kg/m2,≥28.00 kg/m2was increased by 59.4%and 78.2%respectively;compared with that in the patients in control whose WHR was<0.83,the danger of the occurrence in case group patients whose WHR was 0.83~0.89,0.90~0.94,>0.94 was increased by 4.8%,32.6%and 36.5%respectively.Conclusion BMI and WHR are important risk factors for esophageal cancer.Overweight or obesity is associated with a significantly increased risk of esophageal cancer.So keeping normal weight may be a protective factor.
Esophageal neoplasms;Body mass index;Waist to hip ratio;Case-control study
R 735.1
A
10.3969/j.issn.1007-9572.2015.01.012
2014-10-08;
2014-12-01)
(本文编辑:闫行敏)
110016辽宁省沈阳市,辽宁医学院沈阳军区总医院研究生培养基地 (闫立辉);沈阳军区总医院放射治疗科 (陕忠远,孙颖,阎英);辽宁医学院流行病学教研室 (卢智泉)
阎英,110016辽宁省沈阳市,沈阳军区总医院放射治疗科;E-mail:yanyingdoctor@sina.com

