咪唑类离子液体在纤维素酶降解纤维素体系中的作用
范琳,王少君,李坤兰
咪唑类离子液体在纤维素酶降解纤维素体系中的作用
范琳,王少君,李坤兰
(大连工业大学轻工与化学工程学院,辽宁 大连 116034)
以1-乙基-3-甲基咪唑磷酸二乙酯([Emim]DEP)、1-乙基-3-甲基咪唑醋酸([Emim]Ac)为研究对象,考察两种离子液体(IL)对酶法降解纤维素过程的影响。采用超声辅助离子液体溶解纤维素,[Emim]DEP和[Emim]Ac分别使纤维素的结晶度降为53.6%和62.3%。在纤维素酶降解再生纤维素的过程中,当IL的加入量小于2.0%时,对酶解过程起促进作用,其中加入量为0.5%时,促进作用最强,酶解率分别提高了11.4%和17.5%。在最优条件下(加入0.5%IL),测量纤维素酶系中各个酶的酶活,结果表明离子液体对β-葡萄糖苷酶起到了明显的促进作用,分别使该酶酶活提高了120%和87%。离子液体降低了纤维二糖对葡聚糖外切酶的抑制作用,提高了酶解效率。
离子液体;纤维素;纤维素酶;溶解;降解
引 言
纤维素的绿色降解工艺是在纤维素酶作用下的酶解反应,但是由于纤维素分子间与分子内氢键的大量存在,结晶度较高,不溶于水和普通有机溶剂,限制了纤维素的基础研究和工业应用。研究表明,离子液体可以溶解纤维素,降低其结晶度,进而实现高效酶解反应得到葡萄糖[1]。葡萄糖可以转化成乙醇、丙酮、丁醇等燃料和化工原料,这对于解决目前的能源危机问题具有重要意义[2-3]。本研究应用1-乙基-3-甲基咪唑磷酸二乙酯([Emim]DEP)、1-乙基-3-甲基咪唑醋酸([Emim]Ac)两种离子液体,借助超声辅助分别将纤维素溶解,用纤维素酶降解再生后的纤维素,采用DNS比色法,通过测量在降解体系中加入不同量的离子液体时体系中还原糖的浓度来反映离子液体对降解体系的影响,归纳总结出离子液体对纤维素酶混合酶系中各个酶的影响。
1 实验部分
1.1 实验材料
微晶纤维素(结晶度为80.6%),美国FMC。纤维素酶,国药集团化学试剂有限公司。[Emim]Ac[4]、[Emim]DEP[4]、DNS[5]等试剂均为实验室自制。
1.2 实验仪器
D/Max-3B型X射线衍射仪,日立Hitachi公司;JEOL JSM-6460LV型扫描电子显微镜,日本电子株式会社;ACE超声化学反应系统,美国Sonics公司;12-POLS型偏光显微镜,日本Olympus公司等。
1.3 实验方法
1.3.1 纤维素的溶解及再生 将微晶纤维素和离子液体以1:20的比例置于超声瓶中混合,在超声辅助条件下(探头温度90℃,功率40%,循环水温度70℃)充分溶解3 h[6]。溶解完全后,加入适量去离子水,反复冲洗沉降后得到再生纤维素,冷冻干燥24h,待用[7]。以偏光显微镜、X射线衍射仪(XRD)等仪器,从形貌、晶型状态等方面描述纤维素溶解变化过程。
1.3.2 纤维素的酶解 配制100ml HAc-NaAc缓冲溶液[8],加入1 g纤维素酶制成酶液待用。取40 ml酶液,先后加入0.1 g纤维素和不同浓度的离子液体。在50℃、120 r·min-1条件下反应8 h后离心得上清液。采用DNS法测定上清液中还原糖含量[9],进而计算出酶解率。
1.3.3 酶活的测定 按照国际理论应用化学协会(IUPAC)推荐的国际标准方法分别测定纤维素总酶活(滤纸酶活)、葡聚糖内切酶酶活、葡聚糖外切酶酶活、β-葡萄糖苷酶酶活[10]。在4个100ml锥形瓶中分别加入40 ml纤维素酶液、底物(1 cm× 6 cm whatman No.1滤纸条,1%羧甲基纤维素钠,1%微晶纤维素,1%水杨苷)、0.5%离子液体([Emim]Ac、[Emim]DEP)。置于50℃的恒温水浴振荡反应器中,120 r·min-1恒温反应60 min。用20 ml灭活的纤维素酶液作空白,采用DNS法测定体系中还原糖的含量,进而计算出酶活。
1.4 计算公式
结晶指数[11]计算公式为
式中,200为222.7°处的峰值;AM为218°处的峰值。
酶解率[12]计算公式为
式中,为还原糖的质量,g;为纤维素的质量,g;为纤维素的含水率,%。
纤维素酶活的定义:在特定条件下,单位质量的酶每分钟催化相应的底物纤维素水解成l μmol葡萄糖,称为一个酶活单位即1 U·g-1[12]。计算公 式为
酶活(U·g-1)(3)
2 结果与讨论
2.1 纤维素的溶解
2.1.1 偏光显微镜分析 由图1、图2可知,在超声辅助条件下,随着时间的延长,纤维素在两种离子液体中逐渐溶解,3 h后,纤维素完全溶解。在相同时间,[Emim]Ac体系在偏光镜下更明亮,说明未溶解的部分更多,因此,[Emim]DEP比[Emim]Ac溶解纤维素的能力更强。
2.1.2 XRD分析 由图3可知,对于未处理纤维素,其结晶程度大,衍射峰尖锐,属于典型的纤维素Ⅰ型[13]。经两种离子液体处理后,峰形不再尖锐明显,而是变成一组强度很低分布很宽的衍射峰,这与纤维素Ⅱ型相符,说明离子液体处理后纤维素的结构由Ⅰ型转变成了Ⅱ型[14-15]。并且,经[Emim]DEP处理后的纤维素衍射峰比[Emim]Ac更平滑、分布更宽,进一步说明[Emim]DEP溶解纤维素的能力更强。
2.1.3 结晶指数分析 由表1可知,经两种离子液体处理后,纤维素的结晶指数大大降低,为后来纤维素酶解提供更多更好的作用位点,有利于下一步酶解反应的进行。
2.1.4 再生率分析 分别用[Emim]DEP和[Emim]Ac两种离子液体溶解1 g微晶纤维素,经反复冲洗、沉降、过滤、干燥后可以得到0.88 g和0.93 g的再
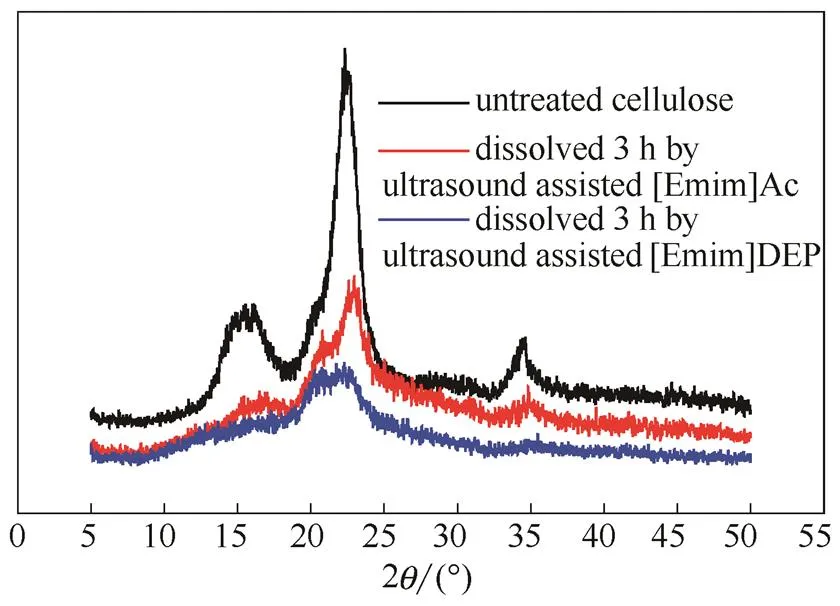
图3 [Emim]Ac和[Emim]DEP处理前后纤维素的XRD谱图
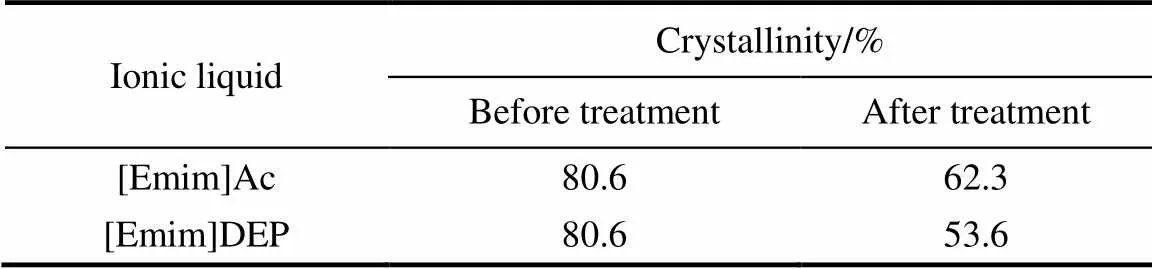
表1 不同离子液体处理前后纤维素结晶指数的变化
生纤维素,再生率分别为88%和93%。说明部分被溶解的纤维素无法全部再生,经[Emim]Ac处理的纤维素再生率比[Emim]DEP高,进一步说明[Emim]DEP溶解纤维素的能力比[Emim]Ac更强。
2.2 纤维素的酶解
利用溶解效果相对较好的[Emim]DEP处理微晶纤维素,反复冲洗沉降后得到结晶指数均为53.6%的再生纤维素,准确称取13份质量为0.1g的再生纤维素,加入酶液和不同质量分数的两种离子液体,结果如图4所示。随着两种离子液体加入量的增加,酶解率都呈现先上升后下降的趋势。加入量小于2.0%时,离子液体对酶解过程起促进作用。其中,加入量为0.5%时,对酶解过程的促进作用最强,[Emim]Ac和[Emim]DEP分别可以使酶解率提高11.4%和17.5%,且在相同加入量条件下,[Emim]DEP对酶解过程的促进作用强于[Emim]Ac。
2.3 离子液体对纤维素酶系中各个酶的作用与分析
由图5可以看出,当分别向纤维素的酶解体系中加入质量分数为0.5%的两种离子液体时,纤维素酶的总酶活都有所提高。[Emim]Ac和[Emim]DEP分别使β-葡萄糖苷酶的酶活提高了87%和120%,使葡聚糖外切酶的酶活提高了39%和51%,而加入离子液体对于葡聚糖内切酶的影响不大。其中,

图4 加入不同量的IL时纤维素的酶解情况
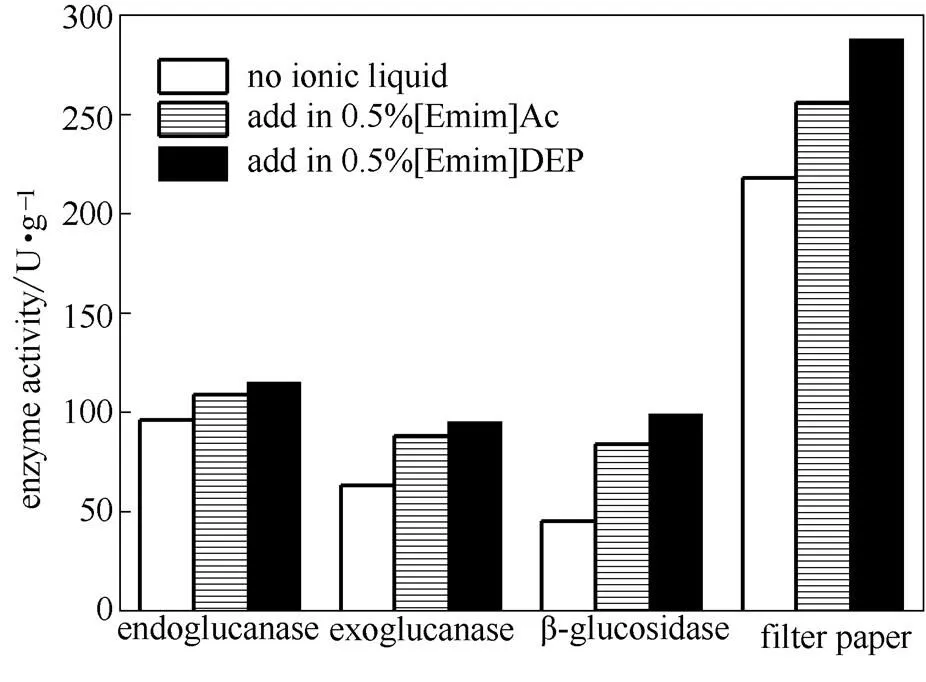
图5 加入0.5%IL时纤维素酶系中各个酶的酶活
[Emim]DEP对纤维素酶系中3种酶的促进作用强于[Emim]Ac。
纤维素酶是由多种酶混合组成的,具有协同作用的复杂酶系,根据酶功能的不同,纤维素酶主要分为3种组分:葡聚糖内切酶(EC)、葡聚糖外切酶(CBH)、β-葡萄糖苷酶(BG)[16]。其中,葡聚糖内切酶主要作用于纤维素内部的非结晶区,随机切断纤维素长链的β-1,4-糖苷键,生成纤维寡糖、纤维三糖或纤维二糖等长度不等的短链低聚糖。葡聚糖外切酶由催化域(CD)和吸附域(CBD)两部分构 成[17],主要作用于纤维素的结晶区,可破坏其结晶结构并从纤维素长链的非还原端逐一水解出纤维二糖。β-葡萄糖苷酶主要用于水解反应中生成的纤维二糖,使其最终变为葡萄糖[18]。
在整个降解的过程中,由于CBH的活性中心呈狭长的隧道状深陷于催化域的内部,只有单链纤维素分子能够进入。CBD具有吸附在纤维素表面并从结晶纤维素表面分离出纤维素单链的作用,所以CBD能否在酶解过程中高效地进行吸附分离作用是提高纤维素酶降解纤维素速率的决定因素[19]。然而,当生成的纤维二糖不能被及时分解时,大量的纤维素二糖会吸附在CBH上,使酶分子构像发生变化,CBD无法进行有效吸附,致使CD缺少底物而不能发生作用[20]。另外纤维二糖在活性中心附近与色氨酸结合产生空间位阻效应,阻塞了狭窄的活性中心隧道,使单根纤维素分子链难以进入发生水解作用[21]。有研究表明[22],当CBH吸附微晶纤维素时,表现为分子间氢键强度的减弱。CBH的吸附并未影响天然纤维素的指纹区各谱带形状、位置和强度的变化,表明吸附只涉及纤维的表面而未影响CC,CO等纤维素分子骨架的结构,但它可导致微纤维束和基元纤维的分离,这是分子链间氢键结合力减弱的结果,可为水解作用的进行提供条件。但是CBH与纤维二糖结合后,再吸附微晶纤维素时,却导致了与上述完全不同的变化,纤维素氢键区的吸收强度反而增强,微纤维束和基元纤维无法分离,而游离的基元纤维的存在是纤维素酶完成催化水解作用的必需条件,因此水解过程受到抑制。当在水解体系中加入一定浓度的离子液体时,离子液体中的阴离子充当电子给予体,阳离子充当电子接受体,与纤维素中H原子和O原子相互作用,降低纤维素分子间的氢键强度,减轻体系中纤维二糖对CBH的反馈抑制作用,提高β-葡萄糖苷酶的酶活,使吸附催化过程高效进行,进而提高了酶解效率。含有不同阴离子的咪唑类离子液体破坏纤维素中氢键的能力不同,提高酶解率的效果也就不同,实验结果表明,[Emim]DEP对纤维素酶解过程的促进作用强于[Emim]Ac。
3 结 论
(1)采用超声辅助方法,从形貌上(偏光显微镜)、晶型(XRD)上研究了两种离子液体[Emim]DEP和[Emim]A对纤维素溶解过程的影响,证明离子液体对溶解过程起到促进的作用,分别使纤维素的结晶度降为53.6%和62.3%。
(2)研究了IL加入量对纤维素酶降解再生纤维素过程的影响,发现随着IL加入量的增加,酶解率呈现先增加后降低的趋势,在加入量为0.5%时,促进作用最强,酶解率分别提高了11.4%和17.5%。且加入量小于2.0%时,IL对酶解过程起促进作用,加入量大于2.0%时,酶解率趋于平缓。
(3)在最优条件下(加入0.5%IL),测量纤维素酶系中各个酶的酶活,结果表明离子液体对β-葡萄糖苷酶起到了明显的促进作用,分别使该酶酶活提高了120%和87%。离子液体通过提高β-葡萄糖苷酶的酶活使过量的纤维二糖及时水解为葡萄糖,减轻体系中纤维二糖对CBH的反馈抑制作用,使吸附催化过程高效进行,进而提高了酶解效率。
References
[1] Lindman B, Karlstrom G L. On the mechanism of dissolution of cellulose [J]..., 2010, 156: 76-81
[2] Schurz J. Trends in polymer science: a bright future for cellulose [J]...., 1999, 24: 481-483
[3] Li Changzhi (李昌志), Wang Aiqin (王爱琴), Zhang Tao (张涛). Progress of conversion of cellulose resource in ionic liquids [J].(化工学报), 2013, 64 (1): 182-197
[4] Deng Youquan (邓友全). Ionic Liquid-Property Preparation and Application (离子液体——性质、制备与应用) [M]. Beijing: China Petrochemical Press, 2006: 47-55
[5] Liu Zhiguo (刘志国). Biochemistry Experiment (生物化学实验) [M]. Wuhan: Huazhong University of Science and Technology Press, 2004: 32-33
[6] Swatloski R P, Spear S K, Holbrey J D. Ionic liquids as green solvents for the dissolution and regeneration of cellulose [J]., 2003, 225: 288-295
[7] Liu Liyang (刘黎阳), Niu Kun (牛坤), Liu Chenguang (刘晨光), Bai Fengwu (白凤武). Effect of ionic liquid pretreatment on lignocellulosic biomass from oilseeds [J].(化工学报), 2013, 64 (S1): 104-110
[8] Kragl U, Eckstein M, Kaftzik N. Enzyme catalysis in ionic liquids [J]., 2002, 13 (6): 565-571
[9] Kamiya N, Matsushita Y C, Hanaki M. Enzymaticsaccharification of cellulose in aqueous ionic liquid media [J]..., 2008, 30 (6): 1037-1040
[10] Ghose T K. Measurement of cellulase activities [J]..., 1987, 59 (2): 257-268
[11] Segal L, Creely J J, Martin Jr A E. An empirical method for estimating the degree of crystallinity of native cellulose using the X-ray diffractometer [J]., 1959, 29: 786-794
[12] Chang V S, Holtzapple M T. Fundamental factors affecting biomass enzymatic reactivity [J]., 2000, 84 (10):5-37
[13] Fukaya Y, Hayashi K, Wada M. Cellulose dissolution with polar ionic liquids under mild conditions required factors for anions [J].., 2008, 10: 44-46
[14] Swatloski R P, Spear S K, Rogers R D. Dissolution of cellulose with ionic liquids [J]., 2002, 124: 4974 -4975
[15] Zhang Lina, Ruan Dong, Zhou Jinping. Structure and properties of regenerated cellulose films prepared from cotton linters in NaOH/ urea aqueous solution [J]., 2001, 40 (1): 5923- 5928
[16] Lius L, Wang H, Wang C Y. Progress of the molecular structure and mechanism about cellulase [J]., 2007, 7: 12-15
[17] Lee S B, Park K H, Robyt J F. Inhibition of β-glycosidases by a carbose analogues containing cellbiose and lactose structures [J]., 2001, 331 (1): 13-18
[18] Sinitsyn A P, Gusakov A V. Effect of structural and physicochemical features of cellulosic substrates on the efficiency of enzymatic hydrolysis [J]...., 1991, 30 (1): 43-59
[19] Duan Xinyuan (段新源), Xin Wei (辛玮), Zhang Weican (张为灿). The role of cellobiose in cellulose biological degradation [J].(微生物学通报), 2003, 30 (5): 94-98
[20] Wei Duo (魏夺), Dong Yuesheng (董悦生), Han Song (韩松), Xiu Zhilong (修志龙). Integrated bioprocess of cellulase-catalysed conversion of steroidal saponins and extration of diosgenin using a three-liquid-phase system [J].(化工学报), 2012, 63 (6): 1877-1882
[21] Gao Peiji (高培基). Developments of the mechanism of cellulase degradation and studies of the molecular structure and function of cellulase [J].(自然科学进展), 2003, 13 (1): 21-29
[22] Zhao Yue (赵越), Wu Bin (武彬), Yan Boxu (阎伯旭), Gao Peiji (高培基). Analyse of the mechanism of inhibition of CBH by cellobiose [J].(中国科学), 2003, 33 (5): 454-460
Function of imidazolium-based ionic liquids in system of enzymatic
degradation of cellulose
FAN Lin, WANG Shaojun, LI Kunlan
(School of Light Industry & Chemical Engineering, Dalian Polytechnic University, Dalian 116034, Liaoning, China)
Taking 1-ethyl-3-methylimidazolium diethyl phosphate ([Emim]DEP) and 1-ethyl-3-methylimidazolium acetate ([Emim]Ac) as research targets, the influence of the two ionic liquids (IL) on the process of enzymatic degradation of cellulose was investigated. By using ultrasound to assist ionic liquids in dissolving cellulose, [Emim]DEP and [Emim]Ac made the crystallinity of cellulose decrease to 53.6% and 62.3% respectively. In the process of enzymatic degradation of regenerated cellulose, when the dosage of IL was less than 2.0%, IL acted as promoter, and when the dosage of IL was 0.5%, the promoting effect of IL was the strongest. Enzymatic hydrolysis rate increased by 11.4% and 17.5% respectively. Under the optimal conditions (add in 0.5% IL), the enzyme activities of every enzyme in the cellulose system were measured. Ionic liquids had an obvious promoting effect on β-glucosidase, increasing enzyme activity by 120% and 87% respectively. Ionic liquids reduced inhibition of exoglucanase by cellubiose, and improved efficiency of enzymatic degradation of cellulose.
ionic liquids; cellulose; cellulase; dissolution; degradation
date: 2014-07-15.
Prof. WANG Shaojun, wgsoju@163.com
10.11949/j.issn.0438-1157.20141062
TQ 352.2
A
0438—1157(2015)01—0121—05
国家自然科学基金项目(21106011)。
2014-07-15收到初稿,2014-09-22收到修改稿。
联系人:王少君。第一作者:范琳(1989—),女,硕士研究生。
supported by the National Natural Science Foundation of China (21106011).

