棉杆活性炭负载Co-B催化剂催化硼氢化钠水解制氢的性能
曲健林,韩敏,张秀丽,徐秀峰,郭庆杰
棉杆活性炭负载Co-B催化剂催化硼氢化钠水解制氢的性能
曲健林1,韩敏1,张秀丽1,徐秀峰2,郭庆杰1
(1青岛科技大学化工学院,清洁化工过程山东省高校重点实验室,山东 青岛 266042;2烟台大学应用催化研究所,山东 烟台 264005)
采用棉杆生物质废弃物为原料、H3PO4为活化剂,在流化床中化学活化制备棉杆活性炭,并将其作为载体负载Co-B组分,制备了棉杆活性炭基Co-B催化剂(Co-B/C)。以该催化剂应用于硼氢化钠水解制氢,系统考察了活性炭活化条件(活化温度、活化时间、活化剂用量)、水解反应温度及催化剂循环使用次数对催化产氢性能的影响。同时,使用N2物理吸附、FTIR、XRD和SEM等技术对活性炭载体及催化剂进行了表征。结果表明:在活化温度500℃、活化时间1 h、为0.75条件下制得的活性炭载体,负载14.5%Co的催化剂表现出最佳催化性能:反应温度为25℃时,平均产氢速率可以达到12.06 L·min-1·(g Co)-1,催化剂表现了较高活性。催化产氢反应的活化能为44.61 kJ·mol-1。循环使用5次后,催化剂仍保持初次活性的54%。
活性炭;催化剂载体;活化条件;Co-B/C催化剂;硼氢化钠;制氢
引 言
随着化石能源的缺乏以及人们日益重视环境保护,可持续清洁能源越来越受到世界各国的高度重视。氢能因其来源多样性、清洁、可储存及可再生等优点,被认为是化石燃料的重要替代能源[1]。但如何实现氢气的高效、安全存储或在温和条件下快速制氢仍是制约氢能应用的关键。目前常用的储氢方法有液态储氢、炭材料储氢、化学氢化物储氢等[2]。其中硼氢化钠储氢技术具有理论储氢量高(10.8%,质量分数)、产氢纯度高、反应易控制等优点,受到研究者们的广泛关注[3-4]。
NaBH4水解制氢反应如下

(Δϴr,298-217 kJ·mol-1) (1)
硼氢化钠水解在室温下反应速度非常慢,通常采用加入催化剂来提高其反应速度。常用的催化剂有两类:一类是贵金属催化剂,如Pt、Ru、Pd等金属催化剂[5-6];另一类是Ni-B、Co-B等非贵金属催化剂[7]。贵金属催化剂虽然具有较高的活性,但其价格昂贵、储量有限,限制了其广泛的工业应用。非贵金属钴基催化剂因其成本低廉、催化活性高等优点,成为目前研究的热点[8]。
NaBH4水解反应过程中会放出大量热量,且在催化剂的表面会有大量氢气生成,会使未负载催化剂表面非常不稳定。因此,将活性组分负载在载体上使之保持特定的形状有利于催化剂稳定。催化剂载体可以提高活性组分分散性,增加催化剂活性组分与反应物接触机会,从而提高催化剂的反应活性。活性炭的比表面积大,稳定性高,是一种广泛应用的催化剂载体。蔡凡等[9]使用硝酸活化的商业活性炭负载Co-B催化剂,其反应速率是未负载Co-B催化剂的1.5倍。当前,商业活性炭的制备原料以煤和木材为主。然而煤属于不可再生资源,木材存在生长周期长、价格较高等缺点,使制备活性炭受到限制。农作物秸秆是一种储量丰富、价格低廉的可再生资源,具有固定碳含量高、灰分含量低等优点,是制备活性炭最有前景的原料之一。我国每年棉杆产量约为3000万吨,大部分棉杆被直接燃烧或者丢弃,造成了资源的极大浪费。棉杆活性炭呈蜂窝式结构,表面含有不同类型的含氧官能团,适合作为载体应用于液相反应[10]。迄今,有关生物质活性炭制备硼氢化钠水解制氢催化剂的研究报道较少,本文使用棉杆活性炭负载Co-B催化剂,在提高催化剂活性和稳定性的同时,实现了废弃棉杆的资源化利用。
本文利用磷酸活化法制备棉杆活性炭,作为载体负载Co-B催化剂。通过N2物理吸附、FTIR、XRD、SEM、ICP-AES表征以及催化产氢实验,对活性炭载体的活化条件、催化剂活性及稳定性进行研究。
1 实验部分
1.1 实验原料
实验所用原料:棉杆,取自山东滨州农村;硝酸钴(Co(NO3)2·6H2O,AR),天津市致远化学试剂有限公司;硼氢化钠(NaBH4,AR),国药集团化学试剂有限公司;磷酸(H3PO4,AR),烟台三和化学试剂有限公司;氢氧化钠(NaOH,AR),天津市博迪化工有限公司;商业活性炭(HC-GC,40-90目),上海熙碳环保科技有限公司。
棉杆经水洗、110℃烘干后,去皮、粉碎过80目筛(178 μm),得到的物料储存备用。棉杆生物质的工业分析和元素分析见表1。表1说明,棉杆的灰分含量较少,固定碳含量较高,适合作为制备活性炭的原料。
1.2 棉杆活性炭及负载型Co-B/C催化剂的制备
采用H3PO4为活化剂,化学活化法制备棉杆活性炭。制备过程如下:将棉杆与一定量的H3PO4溶液混合(其中活化剂用量以H3PO4与棉杆的质量比表示),超声处理2 h使其混合均匀,在110℃下烘干。将烘干后的原料放入自制微小流化床中进行活化,得到的样品经去离子水洗至pH为6~7,在110℃下干燥得到棉杆活性炭。
采用浸渍-化学还原法制备Co-B/C催化剂:配制一定浓度的硝酸钴溶液,等体积浸渍棉杆活性炭,超声处理1 h使其浸渍均匀。根据计算还原催化剂母体所需理论NaBH4的量,滴加稍过量的NaBH4溶液还原。抽滤、水洗后,在110℃下干燥8 h,在N2氛围下200℃焙烧2 h,得到Co-B/C催化剂。
经ICP-AES表征,以不同活化条件制备的棉杆活性炭为载体的Co-B催化剂中Co的负载量为14.3~14.6%(质量分数),B的负载量为1.02~1.11%(质量分数);其中,以500℃/1 h/0.75活化条件下的活性炭为载体的Co-B/C催化剂中Co的负载量为14.5%(质量分数),B的负载量为1.09%(质量分数)。
1.3 活性炭载体及其负载型Co-B/C催化剂表征
比表面积及孔容孔径分布测试:采用比表面积测定仪(ASAP 2020 V4.01型,美国Micromeritics公司)进行N2物理吸附实验。用BET方程计算活性炭的比表面积,孔容和孔径分布由NLDFT方法求得。
FT-IR表征:采用傅里叶变换红外光谱仪(TENSOR-27型,德国BRUKER公司)进行活性炭表面官能团分析。
物相分析:采用日本理学D/Max-3C型X射线衍射仪测试活性炭及催化剂物相。辐射源为CuKα射线,管压35 kV,管流25 mA,扫描范围为10°~70°,步长0.02°。
表面形貌分析:采用扫描电子显微镜(JSM-6700F型,日本JEOL公司)观察活性炭和催化剂的表面形貌。工作电压为0~25 kV,分辨率1.5 nm。
ICP-AES表征:采用电感耦合等离子体发射光谱仪(Prodigy XP型,美国leeman公司)测定活性组分中Co和B的含量。
1.4 硼氢化钠催化水解制氢反应
采用间歇式反应装置考察制氢催化剂的反应活性,反应装置如图1所示。以50 ml三口烧瓶作反应器,将烧瓶浸没在恒温水浴中以保持温度恒定,左瓶口插入温度计以检测反应温度,中间瓶口安装导气管,连接湿式气体流量计(精度:±1%)来测定生成氢气的积累量,从右瓶口先加入15 ml含5%(质量分数)NaBH4和2%(质量分数)NaOH
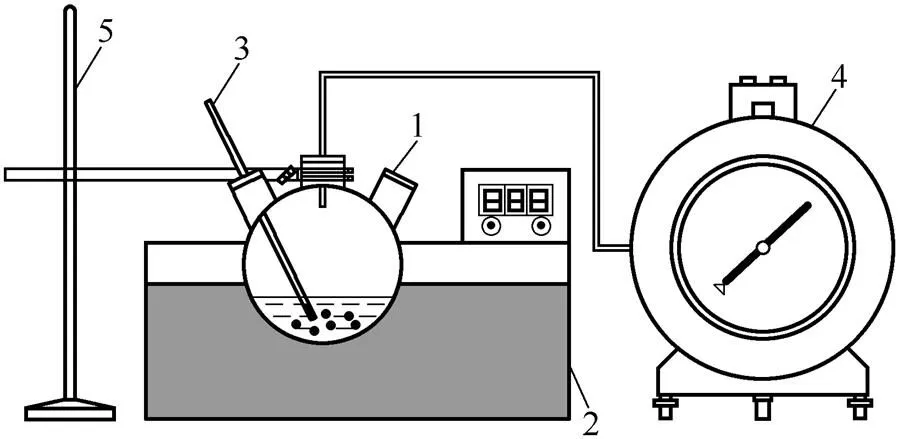
图1 制氢反应装置
的反应液,再快速加入一定量的催化剂,塞上软木塞,立即计时,每隔30 s记录一组温度和气体流量。反应温度由水浴温度控制。
在优化活性炭载体的活化条件及考察催化剂的循环使用性能时,催化剂加入量为0.5 g,反应温度为25℃;考察反应温度对氢气产率的影响时,催化剂加入量为0.2 g。
Co-B/C催化剂催化硼氢化钠水解的平均产氢速率计算公式为
式中,为平均产氢速率,L·min-1·(g Co)-1;为产氢量,L;为反应时间,min;Co为催化剂中Co的质量,g。
2 结果与讨论
2.1 活性炭载体及其负载型Co-B/C催化剂表征结果
2.1.1 活性炭载体的N2吸附-脱附表征结果 改变活化温度(500、800℃)、活化时间(1、2 h)和活化剂用量(0.75、3)等条件制备了几个活性炭样品。图2给出了500℃/1 h/0.75、800℃/1 h/0.75、500℃/1 h/3、500℃/2 h/0.75四种活化条件制得的活性炭和商业活性炭(CAC)的N2吸附-脱附等温线。根据国际纯粹与应用化学联合会(IUPAC)对吸附等温线的分类[11]可知,500℃/1 h/0.75、800℃/1 h/0.75、500℃/2 h/0.75条件下的活性炭吸附等温线在相对压力/00~0.1下吸附量

图2 棉杆活性炭和商业活性炭的N2吸-脱附等温线
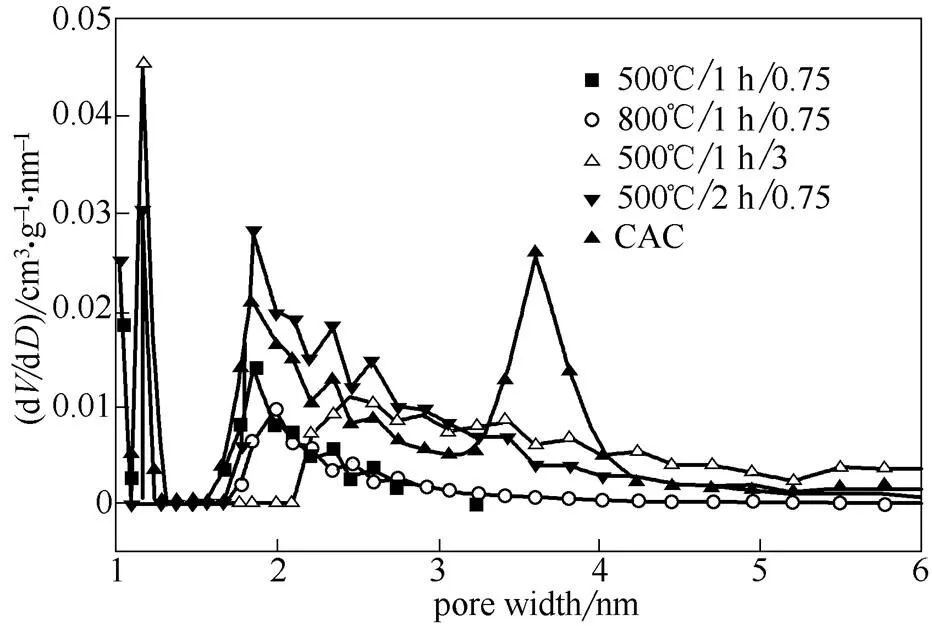
图3 棉杆活性炭和商业活性炭的孔分布曲线
迅速上升,达到一定相对压力(/00.4)后吸附出现饱和值,为典型的Ⅰ型吸附等温线,说明通过改变活化温度和活化时间制备的活性炭以微孔为主。而500℃/1 h/3条件下活性炭的吸附等温线为Ⅳ型吸附等温线,在/00.4~0.95之间出现了H3型滞后环,说明通过增大活化剂(H3PO4)的用量,可以制得介孔活性炭。
从图3的活性炭孔径分布及表2的活性炭孔结构参数可以看出,在500℃/1 h/0.75条件下制备的活性炭比表面积为875.2 m2·g-1,活化温度升高到800℃,活性炭的比表面积下降至794.4 m2·g-1。增加活化时间到2 h,活性炭微孔和中孔孔容略有提高,比表面积升高至1017.0 m2·g-1,和活化时间1 h相比,在1.8~4 nm处的孔含量明显增加。增大至3时,微孔孔容略有下降,但中孔孔容大幅增加,由0.08 cm3·g-1提高到1.18 cm3·g-1,产生大量2~6 nm的中孔。
本文亦对购买的商业负载型活性炭进行了N2吸附-脱附表征。结果表明,商业活性炭具有发达的微孔和介孔结构,活性炭的比表面积为1102.3 m2·g-1,总孔容为0.9 cm3·g-1。因此,废弃棉杆可以通过增加活化时间和增大活化剂用量,制备出同商业负载型活性炭一样具有发达孔径、高比表面积的活性炭,制备的棉杆活性炭适合作为催化剂的载体。
2.1.2 活性炭载体的FTIR表征结果 图4是不同活化条件下活性炭的FTIR谱图,可以看出,在3400 cm-1的吸收峰是OH(包括羧基化合物、醇类或者酚类中的羟基)伸缩振动的特征峰。在1700 cm-1处的吸收峰是CO(包括酯、醛、酮和羧基中的羰基等)的表现。在1550 cm-1处的吸收峰是由芳香
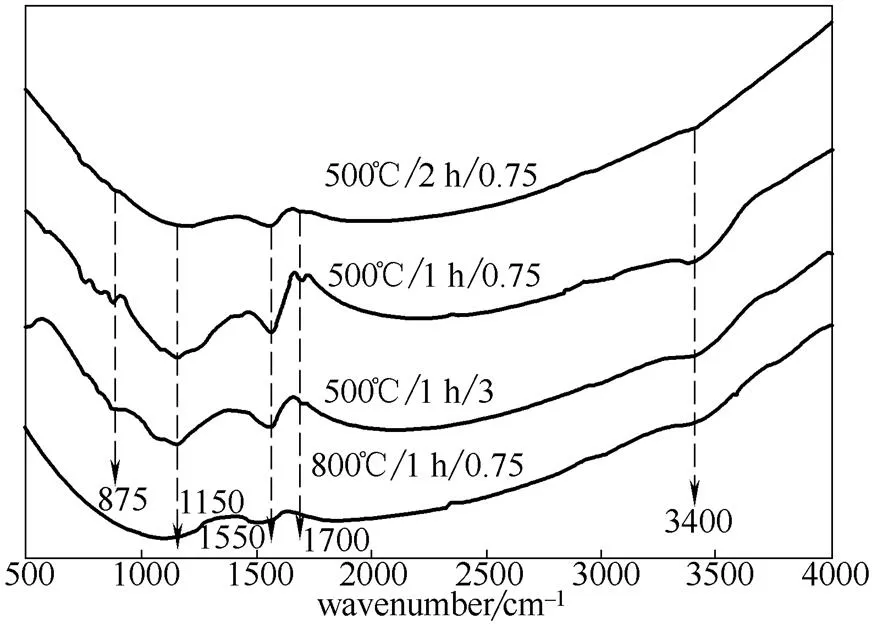
图4 不同活化条件下制备的活性炭的FTIR谱图
2.1.3 Co-B/C催化剂的XRD表征结果 图5是 500℃/1 h/0.75条件下制备的活性炭及Co-B/C催化剂的X射线衍射图。由图5可见,制备的棉杆活性炭是无定形炭,衍射角为26°、44°附近的衍射峰分别对应类石墨结构的(002)及(100)晶面,说明活性炭材料中存在乱层石墨结构的微晶。Co-B/C催化剂除了在26°附近有衍射峰以外,无其他衍射峰出现,说明催化剂中的Co-B组分以非晶态形式存在。
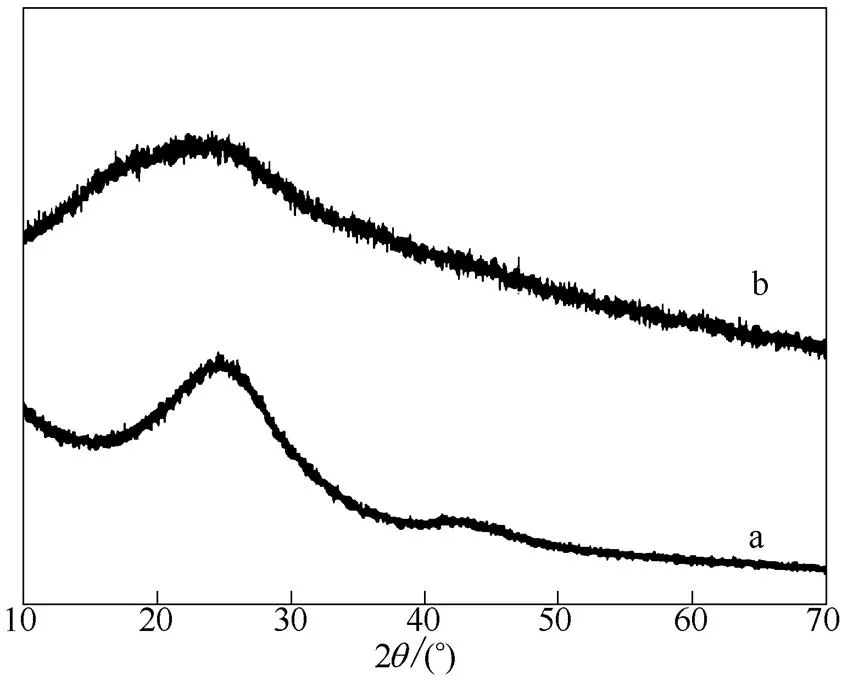
图5 棉杆活性炭(a)及Co-B/C催化剂(b)的XRD谱图
2.2 活性炭活化条件对其负载型Co-B/C催化剂催化性能的影响
2.2.1 不同活化温度制备的活性炭负载型Co-B/C催化剂的催化性能 固定活化时间1 h、为0.75,考察不同活化温度制备的活性炭对产氢速率的影响,如图6所示。当活化温度为500℃时,以棉杆活性炭为载体的催化剂呈现出最佳催化活性,平均产氢速率达到12.06 L·min-1·(g Co)-1。活性炭的活化温度为500~700℃时,Co-B/C催化剂上的产氢反应速率随活化温度升高而递减,但当反应温度达到800℃时,产氢速率发生变化,提高至9.84 L·min-1·(g Co)-1。这是因为在活化过程中,磷酸及其衍生物聚磷酸与棉杆表面的有机物结合
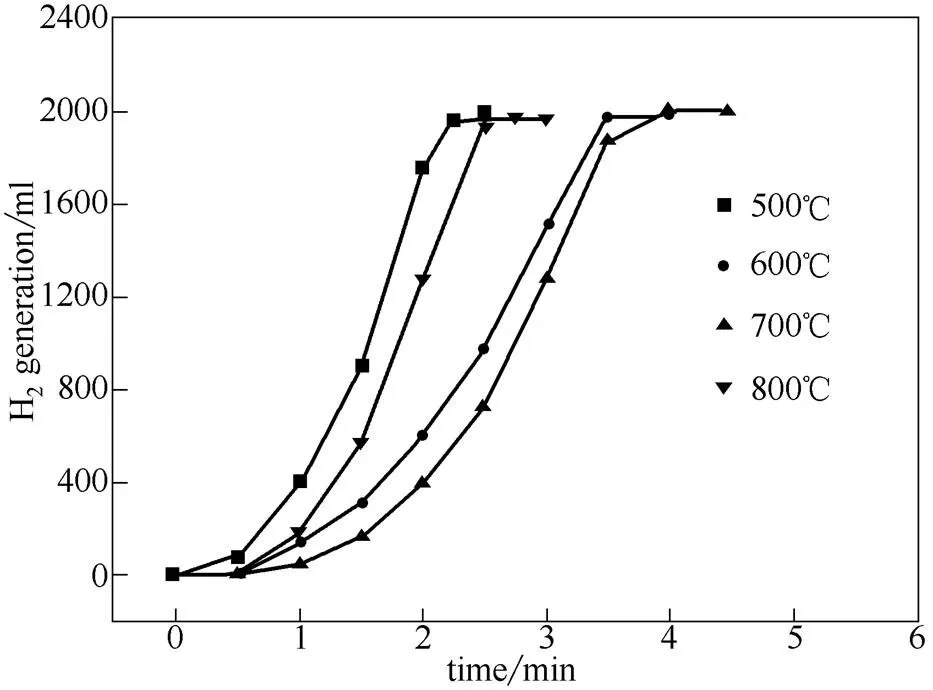
图6 不同活化温度制备的活性炭对氢气产率的影响
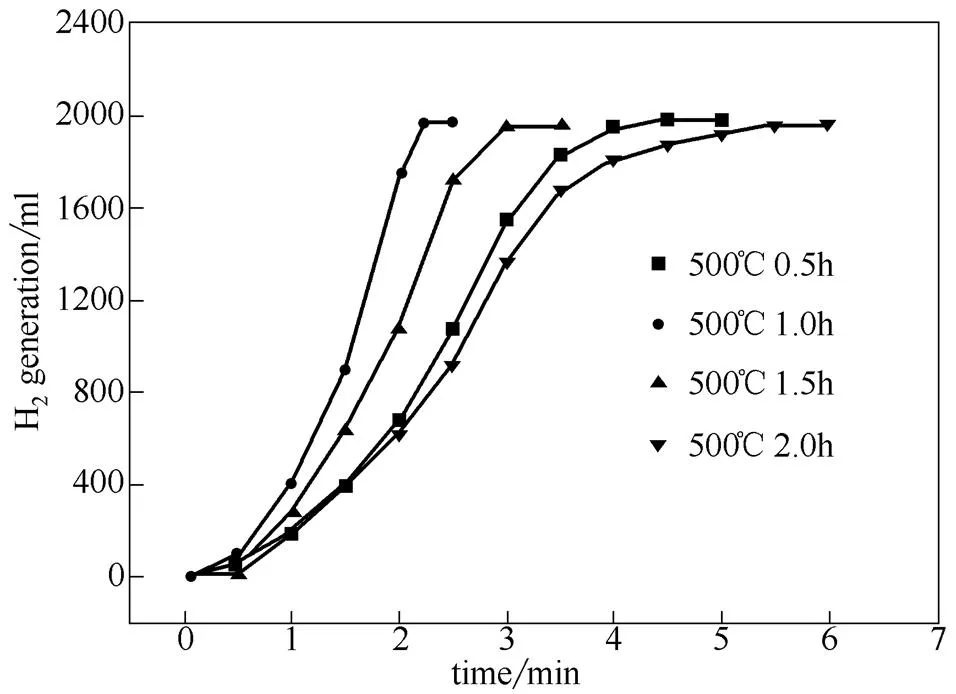
图7 不同活化时间制备的活性炭对氢气产率的影响
形成磷酸盐和聚磷酸盐,这些物质在连接和交联生物聚合物[12]的同时,拓展了生物质的结构,形成孔道。但随着反应温度的升高,能保持孔结构的磷酸盐和聚磷酸盐的桥梁发生破裂,使活性炭孔道发生收缩和坍塌,致使比表面积下降;而当温度达到 800℃时,磷酸化合物的挥发以及小分子含磷物质(如P2O5)的部分气化[13],使它们在离开孔道时,形成新的微孔,并拓宽原有孔道,使比表面积变大,有利于活性组分Co-B的分散和附着,使催化产氢速率增加。
2.2.2 不同活化时间制备的活性炭负载型Co-B/C催化剂的催化性能 固定活化温度500 ℃、为0.75,考察不同活化时间制备的活性炭对产氢速率的影响,如图7所示。活化时间从0.5 h增加到2 h后,催化剂的催化活性呈现先升高后降低的趋势,活化时间1 h为最优活化条件。这是因为随着活化时间的延长,活性炭活化越来越彻底,致使其孔隙发达,比表面积增大,但同时会使表面含氧官能团从活性炭表面脱除,含氧官能团的含量降低。活性炭载体表面上的羧基、羟基等含氧官能团可以在浸渍硝酸钴溶液时与Co2+发生键合,在化学还原时能够和活性炭载体有效结合并较好分散[14],而未结合的Co2+被NaBH4还原时反应速率很快,易发生均相成核过程,使活性组分与载体活性炭的相互作用减弱。因此,活化时间为1 h时制备的活性炭作为载体,催化剂的反应活性最优。
2.2.3 不同用量活化剂制备的活性炭负载型Co-B/C催化剂的催化性能 在生物质活化制备活性炭的过程中,增大活化剂用量()会拓宽棉杆与H3PO4的联系区域,使H3PO4更易扩散到棉杆内部结构中,促进孔道形成[13]。在低(0.3、0.75)下,多磷酸聚合物长度较小,挥发后易形成较窄的微孔;而在高(1.5、3)时,多磷酸聚合物的长度增加,促进了中、大孔的形成。从表2可以看出,从0.75提高到3,活性炭的比表面积从875.2 m2·g-1提高到1399.2 m2·g-1,介孔孔容大幅增加。
图8是在活化温度和时间分别为500℃和1 h条件下,不同用量的活化剂制备的活性炭对产氢速率的影响。由图8可知,硼氢化钠水解制氢速率随活化剂用量的增加先增大后减小,催化剂的催化活性并没有随载体比表面积的增大而一直变高。其原因在于虽然比表面积增大给活性组分附着提供的场所增大,但随着的增大,活性炭表面含氧官能团含量下降,使得活性组分与载体之间的结合力减弱,易造成活性组分在反应过程中流失和团聚,从而使得催化剂的反应活性下降。因此,在为0.75时,Co-B/C催化剂上的产氢速率最快。
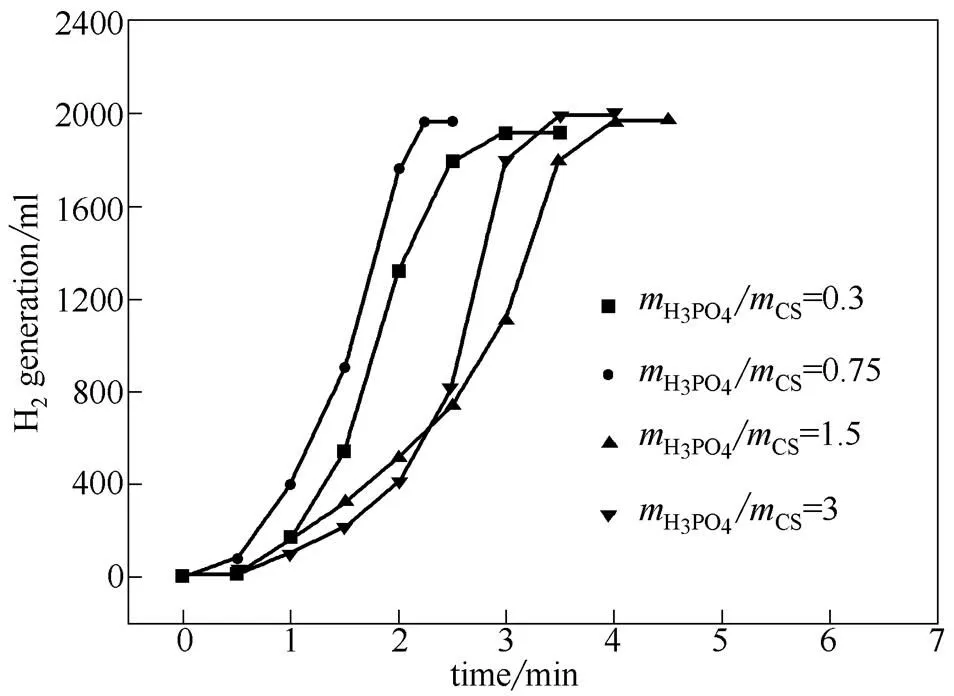
图8 不同活化剂用量制备的活性炭对氢气产率的影响
根据上述结果可知,活性炭的比表面积和表面含氧官能团对Co-B/C催化剂的反应活性起协同作用,但当载体达到一定的比表面积时,比表面积对催化活性的影响减弱,载体表面含氧官能团的含量增加成为提高催化剂活性的主导因素。棉杆活性炭的最佳活化条件:活化温度为500℃、活化时间为1 h、为0.75。下述Co-B/C催化剂都是以此优化条件制备的活性炭为载体。
2.3 反应温度对Co-B/C催化剂催化性能的影响
图9是在最优条件制备的0.2 g催化剂上不同反应温度下的产氢曲线。可以看到,提高反应温度可以加快氢气的生成,反应温度从20℃提高到 40℃,实际产氢量均为1.992 L(理论产氢量为2.07 L),而反应时间从8.5 min缩短至2.5 min。其原因在于温度升高,反应物分子的动能增大,活化分子增多,使催化剂与反应物的接触频率增加;同时传质过程的加快使得生成的H2及副产物NaBO2能及时从催化剂表面脱附,从而使产氢速率增大。
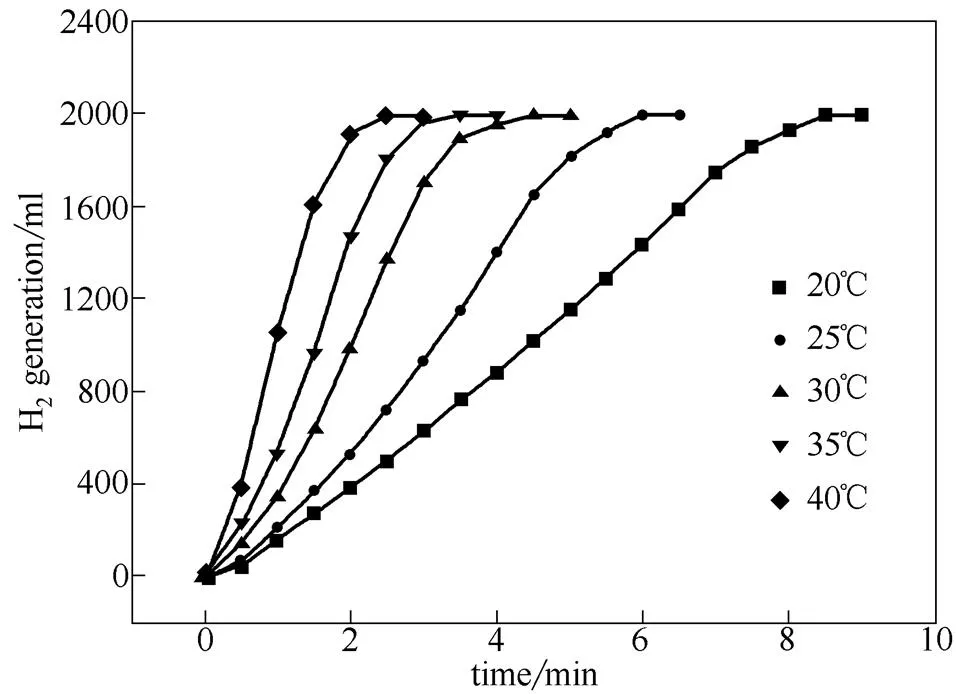
图9 不同反应温度对氢气产率的影响
对于硼氢化钠水解反应的表观活化能,可用Arrhenius方程计算
式中,为平均产氢速率,L·min-1·(g Co)-1;为指前因子;a为活化能,kJ·mol-1;为摩尔气体常量,J·mol-1·K-1;为反应温度,K。
ln对1/作图,如图10所示,通过斜率求得此反应的表观活化能为44.61 kJ·mol-1。
表3列出了不同催化剂催化硼氢化钠水解反应的催化性能及活化能。与前人工作相比,本文中棉杆活性炭基Co-B催化剂的反应活化能低于未负载的Co-B催化剂[15]、炭黑负载的Co-B催化剂[17]以及用TiO2、Al2O3和CeO2为载体的Co-B催化剂[18]。与γ-Al2O3为载体的Co催化剂[19]、沸石为载体的Co催化剂[20]等相比,此催化剂的反应活化能相对较高。为了提高Co-B催化剂的反应活性,前人常使用载体担载催化剂。Rakap等[20]将沸石上负载零价Co,该催化剂在反应温度为25℃时的平均产氢速率为6.09 L·min-1·(g Co)-1。Huang等[21]和Baydaraglu等[17]分别选用多壁碳纳米管和炭黑作为Co-B催化剂载体,其催化活性相比于未负载Co-B催化剂有明显提高。本文使用商业负载型活性炭为载体制备了Co-B/CAC催化剂,在反应温度为25℃时,其平均产氢速率为8.28 L·min-1·(g Co)-1。在相同反应条件下,以棉杆活性炭为载体的Co-B/C催化剂的平均产氢速率达到12.06 L·min-1·(g Co)-1。由此可以看出,本文制备的Co-B/C催化剂

图10 产氢反应的Arrhenius曲线
具有较高的催化活性,产氢速率高于以商业负载型活性炭为载体的Co-B/CAC催化剂和大部分文献中制备的Co基催化剂。同时,以废弃棉杆活性炭为载体制备的Co-B催化剂还具有成本低廉的优势,因此,在制氢领域有广阔的应用前景。
2.4 Co-B/C催化剂的循环使用性能
将使用后的催化剂过滤回收,用蒸馏水洗涤干燥后,再次用于硼氢化钠水解反应,考察了Co-B/C催化剂的循环使用性能。催化剂在循环使用中的催化活性由来表示,其中r是第次循环使用Co-B/C催化剂时的平均产氢速率[L·min-1·(g cat)-1]。催化剂5次循环使用性能如图11所示。可以看出,随着催化剂的循环使用,硼氢化钠水解产氢量维持稳定,5次循环过程中产氢量保持不变;但催化剂的催化活性随着循环次数的增加而降低,
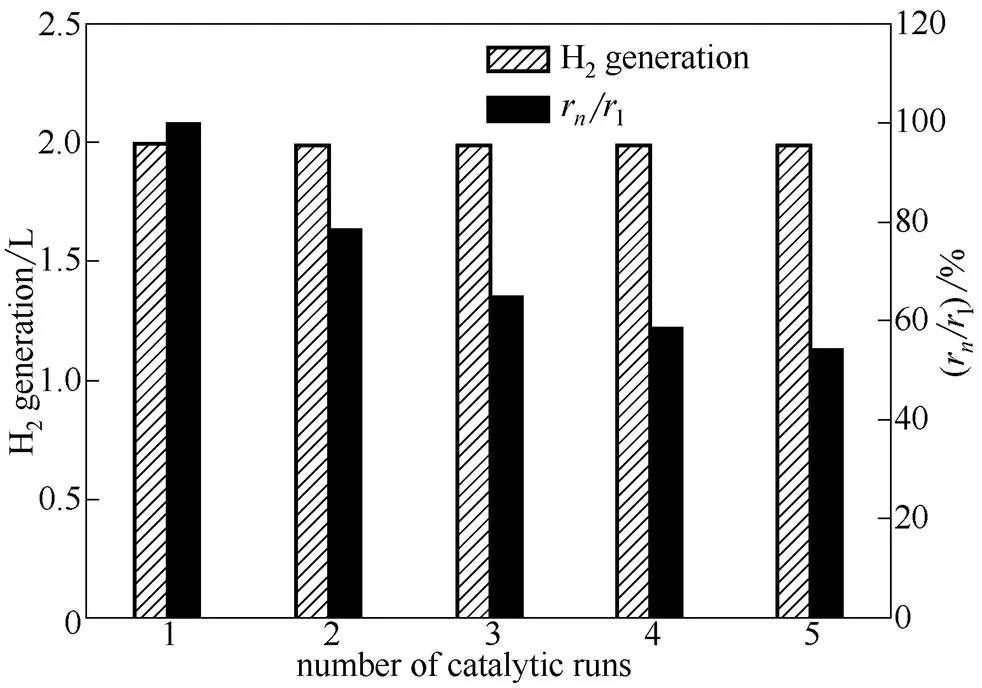
图11 催化剂的循环使用情况
5次循环后,能保持初次活性的54%。蔡凡等[9]使用硝酸活化的商业活性炭为载体浸渍负载Co-B催化剂,5次循环后的催化活性为初始值的30%,孔德成等[24]将Pt/Ni双金属纳米溶胶应用于硼氢化钠水解制氢,5次循环使用后,催化剂的产氢量达到理论值的80%以上,催化活性为初次活性的8.02%。与之相比,本研究使用自制棉杆活性炭为载体的催化剂稳定性优于前述文献结果。Rakap等[20]采用沸石负载Co催化剂,在反应温度为25℃时平均产氢速率为6.09 L·min-1·(g Co)-1,催化剂在5次循环后催化活性为初次活性的59%。在相同反应温度下本文中的Co-B/C催化剂反应活性明显高于前者。
催化剂循环使用后的XRD谱图如图12所示。循环使用后的催化剂除了在26°、44°附近有两处活性炭载体的衍射峰外,无Co-B的特征峰出现。说明活性组分在反应后仍以非晶态形式存在。
对新鲜及循环 使用的Co-B/C催化剂进行扫描电镜分析,如图13所示。由图13 (a)可见,负载到活性炭载体上的Co-B是由粒径为100 nm左右的小颗粒组成,其中大部分活性组分均匀吸附在活性炭表面,但也有少量因分散不均,出现颗粒的团聚。从图13 (b)~(d)可以看出,随着循环使用次数的增加,Co-B催化剂的表面形貌出现了变化,一部分小颗粒转变成片状结构,同时出现了明显的颗粒团聚现象。这可能由于产氢反应剧烈,快速生成的大量氢气对催化剂表面活性组分造成了冲击,使负载在载体表面的活性组分形貌部分发生变化,同时,未与载体紧密结合的活性组分发生脱落,形成团聚。经ICP-AES分析知,5次循环使用后的催化剂Co含量由14.5%降至13.6%(质量分数),B含量由1.09%降至0.89%(质量分数)。说明在催化剂循环使用过程中,活性炭载体表面的Co-B组分有溶脱现象,导致活性组分流失,使得活性组分数量减少,导致催化剂活性逐渐下降。

图12 循环使用后Co-B/C催化剂的XRD谱图
3 结 论
(1)N2物理吸附和FTIR结果表明,用磷酸活化制备的棉杆活性炭孔径发达,具有较高的比表面积,表面含有羧基、羟基、内酯基等含氧官能团。
(2)在活化温度为500℃、活化时间为1 h、活化剂用量()为0.75条件下制备的棉杆活性炭,比表面积为875.2 m2·g-1,总孔容为0.51 cm3·g-1,平均孔径为2.33 nm。以其为载体,用浸渍-化学还原法制备的Co-B/C催化剂催化产氢性能最佳,反应温度为25℃时,平均产氢速率达到12.06 L·min-1·(g Co)-1。
(3)优化条件制备棉杆活性炭负载的催化剂Co-B/C上硼氢化钠水解反应的活化能为44.61 kJ·mol-1。催化剂5次循环使用后,催化活性仍保持初次活性的54%。
References
[1] Letcher T M. Future Energy: Improved, Sustainable and Clean Options for our Planet [M]. London: Elsevier, 2014: 495-510
[2] Li C, Peng P, Zhou D W, Wan L. Research progress in LiBH4for hydrogen storage: a review [J]., 2011, 36 (22): 14512-14526
[3] Muir S S, Yao X D. Progress in sodium borohydride as a hydrogen storage material: development of hydrolysis catalysts and reaction systems [J]., 2011, 36 (10): 5983-5997
[4] Wang Yuxiao (王玉晓). Recent advances in the study of sodium borohydride hydrolysis for pure hydrogen supply to PEM fuel cell [J].(化工进展), 2009, 28 (12): 2122-2128
[5] Li Y H, Zhang Q, Zhang N W, Zhu L H, Zheng J B, Chen B H. Ru-RuO2/C as an efficient catalyst for the sodium borohydride hydrolysis to hydrogen [J]., 2013, 38 (30): 13360-13367
[6] Su Runhua (苏润华), Xiao Hui (肖慧), Lin Jianbiao (林坚标). Hydrogen generation from hydrolysis of sodium borohydride with platinum catalysts loaded on nickel foam [J].(电源技术), 2010, 34 (9): 919-923
[7] Xu D Y, Wang H Z, Guo Q J, Ji S F. Catalytic behavior of carbon supported Ni-B, Co-B and Co-Ni-B in hydrogen generation by hydrolysis of KBH4[J]., 2011, 92 (8): 1606-1610
[8] Tian H J, Guo Q J, Xu D Y. Hydrogen generation from catalytic hydrolysis of alkaline sodium borohydride solution using attapulgite clay-supported Co-B catalyst [J]., 2010, 195 (8): 2136-2142
[9] Cai Fan (蔡凡), Shen Xiaochen (沈晓晨), Dai Min (戴敏), Gao Ming (高鸣), Wang Zhibin (王志斌), Zhao Bin (赵斌), Ding Weiping (丁维平). Catalytic performance of CoB/C for hydrolysis of NaBH4aqueous solution [J].(无机化学学报), 2013, 29 (4): 689-696
[10] Girgis B S, Smith E, Louis M M, EI-Hendawy A A. Pilot production of activated carbon from cotton stalks using H3PO4[J]., 2009, 86 (1): 180-184
[11] Rouquerol J, Avnir D, Fairbridge C W, Everett D H, Haynes J M, Pernicone N, Ramsay J D F, Sing K S W, Unger K K. Recommendations for the characterization of porous solids (technical report) [J]., 1994, 66 (8): 1739-1758
[12] Liu H, Zhang J, Bao N, Cheng C, Ren L, Zhang C L. Textural properties and surface chemistry of lotus stalk-derived activated carbons prepared using different phosphorus oxyacids: adsorption of trimethoprim [J]., 2012, 235/236: 367-375
[13] Nahil M A, Williams P T. Pore characteristics of activated carbons from the phosphoric acid chemical activation of cotton stalks [J]., 2012, 37: 142-149
[14] Rios R R V A, Alves D E, Dalmazio I, Bento S F V, Donnici C L, Lago R M. Tailoring activated carbon by surface chemical modification with O, S, and N containing molecules [J]., 2003, 6 (2): 129-134
[15] Jeong S U, Kim R K, Cho E A, Kim H J, Nam S W, Oh I H, Hong S A, Kim S H. A study on hydrogen generation from NaBH4solution using the high-performance Co-B catalyst [J]., 2005, 144 (1): 129-134
[16] Ding X L, Yuan X X, Jia C, Ma Z F. Hydrogen generation from catalytic hydrolysis of sodium borohydride solution using cobalt-copper-boride (Co-Cu-B) catalysts [J]., 2010, 35 (20): 11077-11084
[17] Baydaroglu F, Ozdemir E, Hasimoglu A. An effective synthesis route for improving the catalytic activity of carbon-supported Co-B catalyst for hydrogen generation through hydrolysis of NaBH4[J]., 2014, 39 (3): 1516-1522
[18] Lu Y C, Chen M S, Chen Y W. Hydrogen generation by sodium borohydride hydrolysis on nanosized CoB catalysts supported on TiO2, Al2O3and CeO2[J]., 2012, 37 (5): 4254-4258
[19] Ye W, Zhang H M, Xu D Y, Ma L, Yi B L. Hydrogen generation utilizing alkaline sodium borohydride solution and supported cobalt catalyst [J]., 2007, 164 (2): 544-548
[20] Rakap M, Ozkar S. Intrazeolite cobalt (0) nanoclusters as low-cost and reusable catalyst for hydrogen generation from the hydrolysis of sodium borohydride [J]., 2009, 91 (1/2): 21-29
[21] Huang Y Q, Wang Y, Zhao R X, Shen P K, Wei Z D. Accurately measuring the hydrogen generation rate for hydrolysis of sodium borohydride on multiwalled carbon nanotubes/Co-B catalysts [J]., 2008, 33 (23): 7110-7115
[22] Xu D Y, Dai P, Liu X M, Cao C Q, Guo Q J. Carbon-supported cobalt catalyst for hydrogen generation from alkaline sodium borohydride solution [J]., 2008, 182 (2): 616-620
[23] Niu W L, Ren D B, Han Y Y, Wu Y J, Gou X L. Optimizing preparation of carbon supported cobalt catalyst for hydrogen generation from NaBH4hydrolysis [J]., 2012, 543: 159-166
[24] Kong Decheng (孔德成), Gu Yajun (古亚军), Xiang Sheng (向胜), Wang Peng (王鹏), Cheng Jun (成军), Zhang Haijun (张海军), Zhang Shaowei (张少伟). Preparation of colloidal Pt/Ni bimetallic nanosols and their catalytic activities for hydrogen generation from hydrolysis reaction of sodium borohydride [J].(高等学校化学学报), 2013, 34 (10):2377-2382
Hydrogen generation by sodium borohydride hydrolysis on Co-B catalysts supported on cotton stalk-based activated carbon
QU Jianlin1, HAN Min1, ZHANG Xiuli1, XU Xiufeng2, GUO Qingjie1
(1Key Laboratory of Clean Chemical Processing of Shandong Province, School of Chemical Engineering,Qingdao University of Science & Technology, Qingdao 266042, Shandong, China;2Institute of Applied Catalysis, Yantai University, Yantai 264005, Shandong, China)
Cotton stalk-based activated carbons were prepared by phosphoric acid activation of cotton stalks (CS) in a fluidized bed. The Co-B catalysts supported on cotton stalk-based activated carbon were generated by the impregnation-chemical reduction method. Meanwhile, the prepared activated carbons and catalysts were characterized by nitrogen physisorption, FTIR, XRD and SEM. The effects of activation reaction parameters, reaction temperature and recycle times on hydrogen generating performance of the activated carbons supported Co-B catalysts were investigated. The optimal activation temperature, activation time and amount of activator () for activation of cotton stalk were 500℃, 1 h and 0.75, respectively. Under these conditions, the as-prepared Co-B/C catalyst with 14.5% (mass) Co exhibited the best hydrogen generating performance with an average rate of hydrogen generation up to 12.06 L·min-1·(g Co)-1at 25℃. Activation energy of hydrogen generation reaction on such catalyst was estimated to be 44.61 kJ·mol-1. After five cycles, the catalyst retained 54% initial activity, exhibiting high activity and stability.
activated carbon; catalyst support; activation condition; Co-B/C catalyst; sodium borohydride; hydrogen production
date: 2014-04-23.
Prof. GUO Qingjie, qj_guo@yahoo.com
10.11949/j.issn.0438-1157.20140645
TK 91;X 712;TQ 426.65
A
0438—1157(2015)01—0105—09
国家自然科学基金项目(21276129);青岛市应用基础研究计划项目(14-2-4-5-jch)。
2014-04-23收到初稿,2014-10-21收到修改稿。
联系人:郭庆杰。第一作者:曲健林(1990—),男,硕士研究生。
supported by the National Natural Science Foundation of China (21276129) and the Qingdao Application Foundation Research Project (14-2-4-5

