不同贮藏条件下棉花叶片DNA提取效果分析
郑子漂 曲延英 王丽丽等

摘要:针对棉叶贮藏方法不恰当导致DNA提取得率及纯度较差的问题,本研究以新鲜棉叶为对照,比较了5种贮藏条件下的棉叶DNA提取效果,以期筛选出一种棉叶贮藏的较优模式,从而提高DNA的提取得率及纯度。结果表明,-20℃冷冻3 d的棉叶DNA得率最高且纯度较好,甚至比新鲜叶片的DNA得率高51.4%; 3 d冷冻贮藏的DNA得率明显高于3 d冷鲜贮藏的;7 d液氮冷冻贮藏的DNA得率明显优于7 d硅胶干燥贮藏的和冷冻贮藏的;7 d液氮速冻贮藏的DNA纯度与7 d硅胶干燥贮藏的相近。综上所述,短期贮藏可采用-20℃冷冻保存的方法;较长时间的保存建议采用液氮速冻的贮藏方式。
关键词:贮藏条件;棉叶;DNA提取;纯度;得率
中图分类号:S562+S188 文献标识号:A 文章编号:1001-4942(2015)08-0011-03
Abstract This study was conducted based on the problems that inappropriate storage could lead to poor extraction rate and purity of DNA from cotton leaves. With the fresh leaves as control, the DNA extraction effects of cotton leaves were compared after storage in five kinds of conditions to screen out a best storage method. The results showed that the DNA extraction rate of cotton leaves was the highest after -20℃ frozen storage for 3 days with better purity, which increased by 51.4% compared to that of the control. The DNA yield of 3-day frozen storage was obviously higher than that of 3-day 4℃ storage, and the 7-day liquid nitrogen frozen had clear advantages over the silica gel dry storage and 7-day frozen storage. The DNA purity of 7-day liquid nitrogen frozen was close to that of 7-day silica gel dry storage. In conclusion, -20℃ frozen storage could be used for short-term storage, while the liquid nitrogen frozen could be used for longer-time storage.
Key words Storage condition; Cotton leaves; DNA extraction; Purity; Extraction rate
近年来, 分子生物技术在棉花育种上的应用,使棉花在抗性、产量及品质改良等方面均取得了较大进展。但棉花组织中富含酚类及多糖类物质,棉叶总DNA的提取较为困难,若采集的鲜叶样品保存不当,将严重影响其DNA的提取纯度及得率,进而影响后续分子工作的开展[1~3]。因此,通过实验手段找出满足不同要求的植物叶片贮藏条件,对各项实验的开展具有重要意义。
本研究以棉花新鲜嫩叶为对照,比较了不同贮藏条件对棉叶DNA提取得率及纯度的影响,以期筛选出最佳的棉叶贮藏方法,为今后开展分子生物学和生物技术试验提供技术支持。
1 材料与方法
1.1 试验材料
棉花品种新陆早26号、新陆早36号、新陆早42号、苏K202、辽棉18号,种植于新疆农业大学病圃。
1.2 试剂
A液:1 mol/L Tris-HCl (pH 8.0),0.5 mol/L EDTA (pH 8.0),4.5 mol/L NaCl,2% SDS,2% PVP;B液:1 mol/L Tris-HCl (pH 8.0), 0.5 mol/L EDTA (pH 8.0), 4.5 mol/L NaCl,10% CTAB; 5 mol/L醋酸钾溶液,氯仿+异戊醇(V∶V=24∶1),异丙醇,无水乙醇,2%β-巯基乙醇。
1.3 样品采集与处理方法
采集花铃期叶宽为 1~2 cm的新鲜嫩叶,置于冰盒在5 min内带回实验室,迅速将每个品种的叶片分成6份并标号,每份约1 200 mg,1号样品直接用于提取棉叶DNA, 2号样品放入普通冰箱(4℃)冷鲜保存3 d,3号、4号样品分别放入普通冰箱(-20℃)冷冻保存3 d和7 d,5号样品放入液氮中(-196℃)保存7 d,6号样品用硅胶干燥保存7 d。每个处理重复3次。
1.4 棉叶DNA提取
采用改良CTAB法提取,主要参照石庆华等[4]的方法,稍加改动。
1号样品取 400 mg洗净,置于研钵中,加入适量液氮,迅速研磨后,小心缓慢移入 2 mL离心管中,加A液(预热至65℃)1 000 μL、β-巯基乙醇 40 μL,放入 65℃恒温水浴锅水浴1 h;取出,加入1/3体积的醋酸钾溶液(5 mol/L),冰浴 1 h后取出,4℃下12 000 r/min离心10 min, 取上清750 μL,加1/5体积的B液后放入65℃恒温水浴锅中均匀水浴20 min,取出,室温冷却;加入600 μL氯仿+异戊醇(V∶V=24∶1)轻轻摇晃混合,平衡后12 000 r/min离心5 min;取上清液600 μL,用氯仿+异戊醇再抽提1次;取上清500 μL,加2/3体积的异丙醇,置于-20℃冰箱过夜;次日取出,6 000 r/min离心5 min,弃上清,用70%乙醇洗涤3次,自然风干后,溶于50 μL ddH2O中备用。endprint
2、3、4、6号样品处理和提取方法同1号样品;5号样品先用组织粉碎机粉碎后,再用于DNA的提取,提取方法同1号样品。
1.5 数据处理和分析
数据采用Microsoft Excel 2003处理,采用DPS软件进行方差分析。
DNA得率(μg/gFW)=DNA浓度×DNA溶解于ddH2O的体积/棉叶鲜重
2 结果与分析
2.1 DNA产物的得率
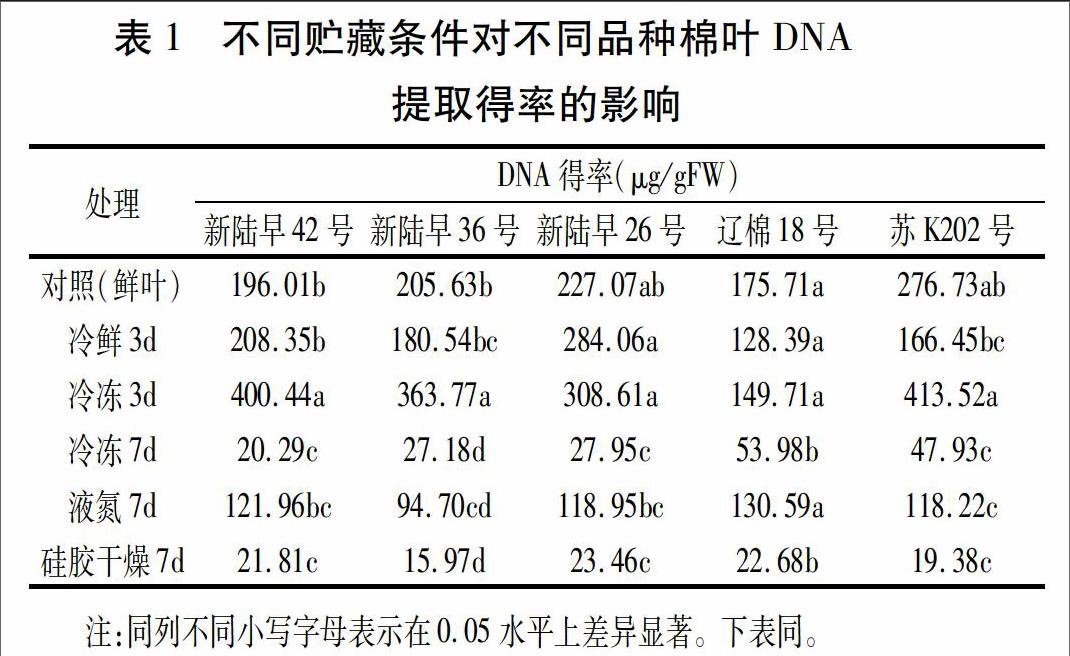
由图1可以看出,冷冻3 d的棉叶DNA平均得率最高,为327.21 μg/gFW;其次为新鲜棉叶的DNA得率,平均为216.23 μg/gFW;冷鲜3 d、液氮冷冻7 d、冷冻7 d和硅胶干燥7 d的棉叶DNA得率均低于对照(新鲜棉叶),平均得率分别为193.56、116.89、35.47和20.66 μg/gFW。
对不同贮藏条件下不同品种的棉叶DNA提取得率进行显著性分析,结果(见表1)显示新陆早42号和新陆早36号冷冻3 d的DNA得率显著高于对照,其它三品种则与对照差异不显著;与对照相比,各品种冷鲜3 d的DNA得率有高有低,但均未达显著水平;液氮冷冻7 d,各品种的DNA得率均低于对照,其中新陆早36号和苏K202与对照的差异达显著水平;各品种冷冻7 d和硅胶干燥7 d的DNA得率均显著低于对照。综上所述,就提取棉叶总DNA而言,虽不同品种间变化不同,但总体来说以-20℃冷冻保存3 d的提取效果最好,而且短期(3 d)贮藏的效果明显优于较长期(7 d);较长期贮藏中,则以液氮保存的效果较好。
2.2 DNA产物的纯度
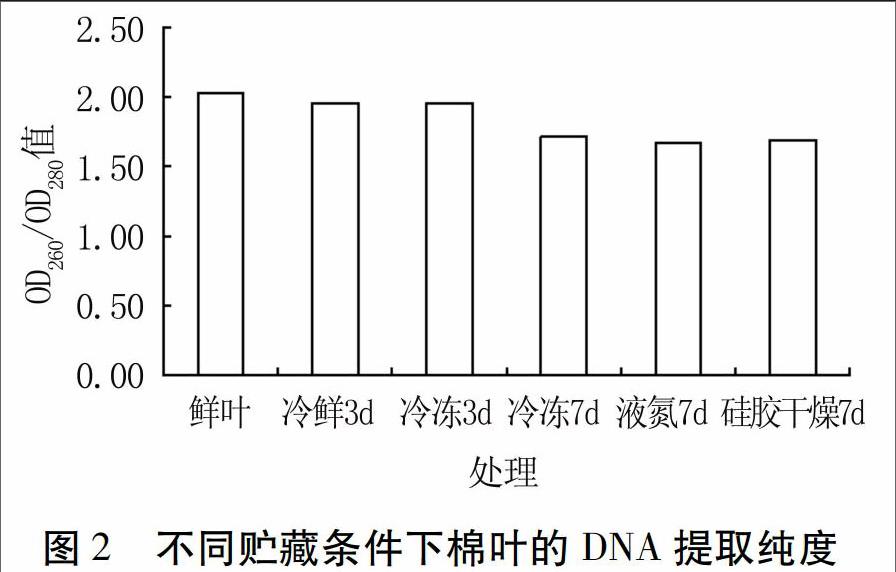
由图2可以看出,对照新鲜棉叶DNA的OD260/OD280平均值为2.03,冷鲜3 d和冷冻3 d的平均值均为1.96,说明冷鲜3 d和冷冻3 d两种方法保存的棉叶DNA提取纯度较好;而冷冻7 d、液氮7 d、硅胶干燥7 d的棉叶DNA OD260/OD280平均值在1.67~1.71之间,说明用这三种处理棉叶提取的DNA中有些蛋白质和酚类物质未除尽。
由表2可以看出,各品种的棉叶DNA提取纯度均以鲜叶的最高;冷鲜3 d和冷冻3 d间基本无差异,且除辽棉18号与对照差异显著外,其余品种均与对照差异不显著;冷冻7 d、液氮7 d和硅胶干燥7 d后,不同品种的DNA提取纯度变化不同,并无统一的规律可循。
3 结论与讨论
本试验结果表明,-20℃冷冻保存3 d的棉叶DNA得率最高,纯度较优。李志真等[5]曾利用冷冻方法贮藏光皮桦鲜叶15 d,结果因叶片完全褐变未能提取到DNA。而本研究发现,棉花鲜叶冷冻3 d时只发生了轻微均匀褐变,DNA提取效果很好,甚至比鲜叶的DNA得率还高出51.4%;但到第7 d时,所提取的DNA得率就很低,今后的研究应在冷冻 1~7 d内设置更细化的时间梯度,寻找最适合的冷冻期限[6,7]。
硅胶干燥法是国内外研究人员贮藏植物组织时最常用的方法,一般认为它的效果最为显著[8~10]。何天明等[11]曾利用该法保存果树材料,成功分离出杏的S-Rnase基因并进行了特异PCR扩增。但本试验中,硅胶干燥法保存的棉叶DNA得率和纯度都较低,可能与叶片粉碎颗粒过大有关,建议今后采用该方法时应加大粉碎力度并增加粉碎次数。
综合来看,可采用-20℃冷冻保存的方法短期贮藏多酚类植物材料,若需较长时间的保存,建议采用液氮速冻的贮藏方式。
参 考 文 献:
[1] 蓝海燕,刘桂珍,王长海. 棉叶总DNA提取的改良方法[J].棉花学报, 2000, 12(1):53.
[2] 王荣栋,尹经章.作物栽培学[M].北京:高等教育出版社,2004.
[3] 谢中稳, 葛颂,洪德元,等.从普通野生稻硅胶干燥的小量叶片中制备DNA用于RAPD分析和总DNA库的建立[J]. 植物学报, 2000, 41(6): 807-812.
[4] 石庆华,张桦,王希东,等.生物化学实验指导[M].北京:中国农业大学出版社,2006.
[5] 李志真,谢一青,黄勇,等.不同保存方法对光皮桦总DNA提取效果的影响[J].分子植物育种,2006,4(1):131-134.
[6] 夏玉玲,张春霖,鲁成.不同处理对动物线粒体DNA提取的影响[J].蚕学通讯, 2003, 23(1): 5-10.
[7] 易庆平,罗正荣,张青林.植物总基因组DNA提取纯化方法综述[J].安徽农业科学,2007,35 (25):7789-7791.
[8] 张国防,陈存及,邢建宏.樟树干叶DNA提取方法的研究[J].江西农业大学学报, 2006, 28(1):111-114.
[9] Chase M W, Hills H H. Silica gel: an ideal material for field preservation of leaf samples for DNA studies[J]. Taxon, 1991, 40(2): 215- 220.
[10]董蔚, 黄寿先, 陈荣, 等.西南桦硅胶干燥叶DNA提取方法比较[J]. 西南林学院学报, 2010,30(4):36-38, 43.
[11]何天明,陈学森,吴燕,等.从蔷薇科果树硅胶干燥叶片中制备DNA用于RAPD分析[J].石河子大学学报:自然科学版, 2001(1): 237-241.endprint

