红景天和党参合剂对小鼠免疫功能的影响
马天宇,姜国哲,韩春姬,刘丽萍,俞笃文
(1. 延边大学医学院预防医学教研室,吉林 延吉 133002;2. 延边大学医学院免疫学与病原生物学教研室,吉林 延吉 133002;3. 延边大学医学院生理学教研室,吉林 延吉 133002;4. 嘉南药理大学药学院药学系,台湾 台南 71710;5. 台湾丰山生技医药品股份公司,台湾 台北 10597)
红景天和党参合剂对小鼠免疫功能的影响
马天宇1,姜国哲2,韩春姬2,刘丽萍3,俞笃文4,5
(1. 延边大学医学院预防医学教研室,吉林 延吉 133002;2. 延边大学医学院免疫学与病原生物学教研室,吉林 延吉 133002;3. 延边大学医学院生理学教研室,吉林 延吉 133002;4. 嘉南药理大学药学院药学系,台湾 台南 71710;5. 台湾丰山生技医药品股份公司,台湾 台北 10597)
目的:应用血清药理学方法探讨红景天提取物(RSE)与党参提取物(CPE)合剂对免疫功能的影响,分析提高免疫功能的最佳配伍剂量。方法:采用3×3析因设计,制备9种不同浓度的CPE和RSE混合含药血清,在体外测定T、B 淋巴细胞增殖活性和 NK 细胞活性,确定CPE和RSE的最佳组合剂量。用该组合剂量缩小2.5、5.0及10.0倍作为RSE+CPE合剂高、中和低剂量组,进行小鼠体内实验,检测T、B 淋巴细胞的增殖能力和NK 细胞的杀伤能力。结果:血清药理学实验,与空白组比较,RSE 200 mg·kg-1+CPE 790 mg·kg-1剂量组由ConA、LPS诱导的T、B淋巴细胞增殖能力及NK细胞活性明显升高(P<0.05)。小鼠体内实验,与环磷酰胺组比较,RSE+CPE合剂中(RSE 40 mg·kg-1+CPE 158 mg·kg-1)和高剂量(RSE 80 mg·kg-1+ CPE 316 mg·kg-1)组脾脏指数(SI)明显升高(P<0.05);与RSE+合剂低剂量(RSE20 mg·kg-1+CPE 79 mg·kg-1)组比较,合剂中剂量组白细胞数明显升高(P<0.05);与环磷酰胺组比较,CPE合剂高、中和低3个剂量组及阳性药物CVT-200(富含西洋参多糖的免疫增强剂)组ConA、LPS诱导的T、B淋巴细胞增殖能力及NK细胞活性均显著升高(P<0.05);与CVT-200组、合剂高剂量和低剂量组比较,合剂中剂量组T、B淋巴细胞增殖能力及NK细胞活性均显著升高(P<0.05)。结论:RSE和CPE合剂有增强小鼠免疫功能的作用,RES 200 mg·kg-1与CPE 790 mg·kg-1组合的合剂为最佳配伍剂量。
红景天;党参;免疫功能
高山红景天(Rhodiolasachalinensis,RS)属景天科(Crasulaceae)红景天属多年生草木或亚灌木植物,被誉为“高原人参”[1],其主要化学成分包括黄酮类、皂苷类、氨基酸类、酚类、豆香素类、萜类、矿物质、酶类、挥发油以及其他一些常见的大分子物质,如多糖类、果胶、脂类、蛋白质和蜡类[2]。以往研究[3]表明:高山红景天多糖参与体液免疫、细胞免疫和非特异性免疫,是一种良好的免疫调节剂。党参为桔梗科植物党参[Codonopsispilosula(Franch)Nannf,CP]及其同属多种植物的干燥根,具有补中益气、健脾益肺之功效,其主要成分有多糖,单糖,党参炔苷,党参苷Ⅰ、Ⅱ、Ⅲ和Ⅳ,苍术内酯类,烯醇类,烟酸,香草酸,阿魏酸及无机元素等有效成分。党参具有比较丰富的药理作用,其中对免疫功能作用的研究最为深入[4]。复方中药制剂的优点是既保持了成分多样化、药理作用广泛等特点,又有化学不良反应少而轻、无依赖性的特点[5]。不同的中药复方可以相互作用,更好地达到提高免疫作用的效果,实现多靶点免疫调节。如党参与黄芪、枸杞配伍,对环磷酰胺处理的免疫低下小鼠具有免疫保护作用[6]。但关于党参与其他中药配伍的最佳剂量研究报道甚少,红景天和党参配伍增强免疫功能的研究尚未见报道。本实验旨在通过血清药理学实验,筛选红景天联合党参提高免疫功能的最佳配伍剂量及其合剂对小鼠免疫功能的影响,为开发和利用红景天和党参资源提供科学的理论依据。
1 材料与方法
1.1细胞、主要试剂和仪器YAC-1细胞(小鼠淋巴瘤细胞)购自上海博谷生物科技有限公司。RPMI-1640为美国Gibco公司产品,胎牛血清(fetal bovine serum,FBS)、脂多糖(lipopolysaccharide,LPS)、刀豆蛋白(concanavalin,ConA)、硫酸甲酯酚嗪(phenazinemethosulfate,PMS)均为美国Sigma公司产品,MTS(3-(4,5-dimethylthiazol-2-yl)-5-(3-carboxymethoxyphenyl)-2-(4-sulfophenyl)-2h-tetrazolium)为美国Promega公司产品,环磷酰胺(CTX)为江苏恒瑞医药股份有限公司产品,CVT-200(富含西洋参多糖的免疫增强剂)由韩国食品研究院提供。MCO-5AC型CO2培养箱为日本SanYo公司制造,DG5033A型酶联免疫检测仪为南京华东电子集团医疗装备有限责任公司制造。
1.2红景天和党参提取物制备红景天为吉林省敦化市产的人工种植高山红景天(Rhodiolarsachalinensis),粗粉碎后备用。党参饮片购自同仁堂药店。称取红景天200 g和党参400 g,分别加入10倍体积双蒸水浸泡24 h,100℃加热提取120 min,过滤,药渣中再分别加入8倍体积双蒸水,100℃加热提取60 min,过滤,合并2次滤液。滤液经3 000 r·min-1离心20 min,滤纸过滤,提取物进行减压真空浓缩、干燥后得红景天提取物(Rhodiolarsachalinensis extract,RSE)粉末48.4 g,党参提取物(Codonopsispilosula extract,CPE)粉末252.0 g。
1.3含药血清的制备清洁级SD雌性大鼠9只,体质量180~200 g,由延边大学实验动物中心提供(动物合格证号:2011-0007)。在IVC饲养系统适应3 d,自由供给饲料和饮水。按表1的设计方案进行3×3析因设计,制备RSE、CPE及RSE+CPE含药血清。RSE设3个剂量(0、200和400 mg·kg-1),CPE设3个剂量(0、790和1 580 mg·kg-1),设计9个不同的剂量组合,分别给大鼠连续灌胃5 d,每天早晚各1次。第5天灌胃给药1 h后,将大鼠乙醚麻醉,无菌条件下摘眼球取血,静止2 h后,2 000 r·min-1离心10 min,分离血清,置于56℃水浴30 min,进行灭活处理。
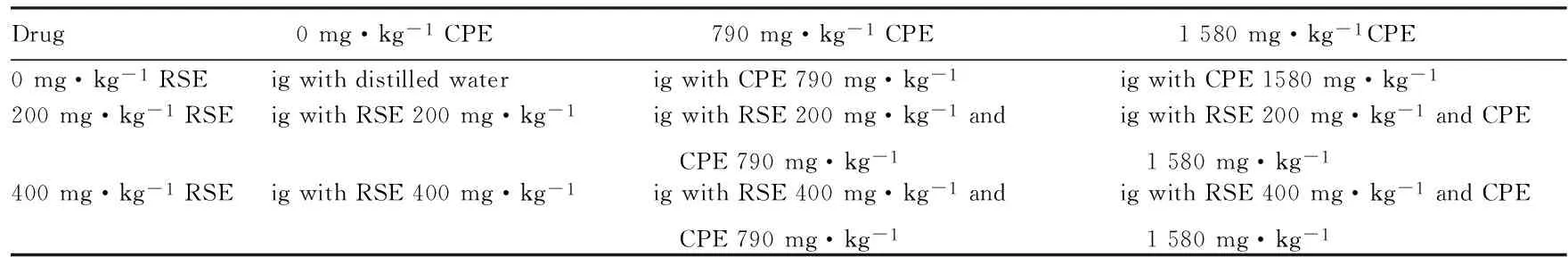
表1 RSE和CPE联合作用的3×3析因设计
1.4细胞悬液的制备将BALB/c品系清洁级小鼠(延边大学实验动物中心提供)颈椎脱臼处死,无菌取小鼠的脾脏,用眼科剪剪碎,用5 mL一次性注射器芯研磨,制备成脾细胞悬液。
1.5脾淋巴细胞增殖实验用含10%胎牛血清和1%双抗(青霉素、链霉素)的RPMI 1640完全培养基将脾细胞稀释成1×106mL-1,移入96孔板中,每孔加45 μL。T淋巴细胞实验孔设计:每孔加入含ConA(终浓度为7 mg·L-1)完全培养基45 μL及含药血清10 μL,刺激T 淋巴细胞的增殖。B细胞实验孔设计:每孔加入含LPS(终浓度为10 mg·L-1)完全培养基45 μL及含药血清10 μL,刺激B淋巴细胞的增殖。对照孔设计:加入含有10% 胎牛血清的RPMI 1640 45 μL及正常血清10 μL。上述各项均设置5个平行孔。将96孔板放置在37℃、5% CO2培养箱中培养。T和B淋巴细胞培养72 h后,每孔加入混合好的MTS-PMS 20 μL,继续置于37℃、5%CO2培养箱中培养。培养4 h后,将培养板放入酶标仪内于492 nm处测定吸光度(A)值,以A值表示细胞增殖活性。T淋巴细胞增殖活性=T淋巴细胞增殖实验孔A值-对照孔A值。B淋巴细胞增殖活性=B淋巴细胞增殖实验孔A值-对照孔A值。
1.6NK细胞活性实验用含10%胎牛血清的 RPMI 1640完全培养基将脾细胞和YAC-1细胞分别稀释成2×106mL-1和1×105mL-1。靶细胞实验孔设计:每孔中各加入脾细胞45 μL和对数生长期的YAC-1细胞45 μL,含药血清10 μL。效应细胞对照孔:每孔加入脾细胞和含有10%胎牛血清的RPMI 1640各45 μL,正常血清10 μL;靶细胞对照孔设计:每孔中均加入YAC-1细胞和含10%胎牛血清的RPMI 1640各45 μL,正常血清10 μL。上述各项均设置5个平行孔。将96孔板置于37℃、5%CO2培养箱中培养4 h后,每孔加入混合好的MTS-PMS 20 μL,继续置于37℃、5%CO2培养箱中培养。培养4 h 后,将培养板置于酶标仪内,于492 nm处测定A值。以A值表示细胞活性。NK细胞活性=[靶细胞对照孔A值-(实验孔A值-效应细胞对照孔A值)]/靶细胞对照孔A值×100%。
1.7小鼠体内淋巴细胞增殖和NK细胞活性实验采用上述筛选的最佳组合剂量缩小10倍进行小鼠体内实验,设6个实验组,即空白对照组、环磷酰胺组、阳性药物(CVT-200,200 mg·kg-1)对照组、低剂量(RSE 20 mg·kg-1+ CPE 79 mg·kg-1)组、中剂量(RSE 40 mg·kg-1+ CPE 158 mg·kg-1)组、高剂量(RSE 80 mg·kg-1+ CPE 216 mg·kg-1)组。选取7~8周龄雄性清洁级昆明种小鼠60只,体质量18~22 g,由延边大学实验动物中心提供,自由供给基础饲料及水,在本实验室IVC饲养系统适应性饲养3 d,随机分为6组,每组10只。连续灌胃28 d。每周记录2次小鼠体质量变化情况及饲料摄入量。空白对照组和环磷酰胺组每天灌胃蒸馏水,阳性对照组每天灌胃CVT-200药物,实验组分别以RSE和CPE合剂高、中、低剂量连续灌胃,共28 d。在实验第23和24天,空白对照组腹腔注射生理盐水0.1 mL·kg-1,其他组腹腔注射环磷酰胺40 mg·kg-1,连续2 d,注射后第5天处死小鼠,取出脾脏,按1.4所述方法制备脾细胞悬液,按1.5和1.6所述方法测定T、B淋巴细胞的增殖活性和NK细胞的活性。
1.8小鼠脏器指数的测定小鼠处死前称体质量,处死小鼠,并记录所有小鼠的脾脏及胸腺质量,计算脏器指数(mg/10 g)。脾脏指数(SI)=脾脏质量(mg)/小鼠体质量 (g )×10;胸腺指数(TI)=胸腺质量(mg)/小鼠体质量 (g) ×10。
1.9小鼠白细胞数的测定将小鼠处死,摘眼球取血,取20 μL血加入到380 μL白细胞稀释液中,混匀,显微镜下记录白细胞数量。
2 结 果
2.1红景天与党参最佳配比的体外析因设计实验与空白对照组比较,所有的RSE和CPE含药血清组其由ConA、LPS诱导的T和B淋巴细胞增殖活性及NK细胞活性均显著升高(P<0.05)。与RSE 200 mg·kg-1和CPE 790 mg·kg-1含药血清组比较,RSE 200 mg·kg-1+ CPE 790 mg·kg-1含药血清组其由ConA、LPS诱导的T和B淋巴细胞增殖活性及NK细胞活性均显著升高(P<0.05),且RSE 200 mg· kg-1+CPE 790 mg·kg-1含药血清组由ConA、LPS诱导的T和B淋巴细胞增殖活性显著高于RSE 400 mg· kg-1+CPE 1 580 mg·kg-1含药血清组(P<0.05)。RSE和CPE的最佳组合剂量为200 mg·kg-1RSE 和790 mg· kg-1CPE (表2)。RSE和CPE的交互作用无统计学意义(P>0.05)。

表2 红景天与党参合剂最佳配比筛选实验
*P<0.05vscontrol group;△P<0.05vsRSE 200 mg·kg-1group;#P<0.05vsCPE 790 mg·kg-1group;▲P<0.05vsRSE 400 mg·kg-1+CPE 1 580 mg·kg-1group.
利用筛选出的最佳组合剂量组成红景天和党参合剂(RSE-CPE),重复进行血清药理学实验。与空白对照组比较,RS+CPE低、中和高剂量组由 ConA、LPS诱导的T和B淋巴细胞增殖活性明显升高,中和高剂量组NK细胞的活性明显升高(P<0.05)。而且中剂量组ConA和LPS诱导的T和B淋巴细胞增殖活性及NK细胞活性显著高于低和高剂量组(P<0.05),与析因实验结果一致。见表3。
2.2小鼠体质量的变化在实验第23和24天,空白对照组腹腔注射生理盐水0.1 mL·kg-1,其他组腹腔注射环磷酰胺40 mg·kg-1,连续2 d,记录各组小鼠体质量变化。各组小鼠体质量均无明显差异(P>0.05)。见表4。
2.3小鼠体内实验脏器指数及白细胞计数CTX组SI、TI和白细胞数均显著低于正常对照组(P<0.05)。与环磷酰胺组比较,RS+CPE合剂中和高剂量组的SI显著高于CTX组(P<0.05);CVT-200和RS+CPE合剂低、中和高剂量组白细胞数均显著高于CTX组(P<0.05)。见表5。

表3 红景天与党参合剂最佳配比验证实验
*P<0.05vscontrol group;#P<0.05vslow dose group;△P<0.05vshigh dose group. RSE-CPE low dose group:RSE 100 mg·kg-1+ CPE 395 mg·kg-1;RSE-CPE middle dose group: RSE 200 mg·kg-1+ CPE 790 mg·kg-1;RSE-CPE high dose group:RSE 400 mg·kg-1+ CPE 1 580 mg·kg-1.
表4各组小鼠体质量变化


GroupBodyweight(t/d) 1471013Control25.16±1.1131.41±1.7634.53±2.3136.40±2.4138.54±2.69CTX40mg·kg-125.91±1.2832.60±1.8336.10±2.2338.13±2.4740.08±2.46CVT-200200mg·kg-126.30±1.7732.77±2.4736.12±2.4838.26±2.3940.25±2.44RSE+CPE Lowdose25.59±1.1432.72±1.1436.00±1.8238.42±2.1539.91±2.36 Middledose26.52±1.3132.87±1.5836.36±1.9039.09±2.4540.85±2.69 Highdose25.98±1.5732.11±2.4836.03±3.5738.09±3.5640.22±3.60GroupBodyweight(t/d) 17212528Control40.89±2.8543.02±3.6744.19±4.0345.10±4.18CTX40mg·kg-142.58±2.8444.52±3.0645.54±3.1146.64±3.26CVT-200200mg·kg-143.21±3.0744.39±3.6345.41±4.2745.88±4.35RSE+CPE Lowdose42.96±3.0244.55±3.2045.54±3.3346.20±3.79 Middledose43.89±3.2045.30±3.7546.50±3.8747.68±4.14 Highdose42.94±3.8844.41±3.8145.20±3.9545.61±4.02
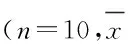
表5 各组小鼠体内实验脏器指数和白细胞数
*P<0.05vscontrol group;△P<0.05vsCTX group;#P<0.05vslow dose group. Low dose of RSE-CPE group:RSE 20 mg·kg-1+ CPE 79 mg·kg-1;Middle dose of RSE-CPE group: RSE 40 mg·kg-1+ CPE 158 mg·kg-1;High dose of RSE-CPE group:RSE 80 mg·kg-1+ CPE 316 mg·kg-1.
2.4各组小鼠免疫功能指标与空白对照组比较,CTX组小鼠的T和B淋巴细胞增殖活性及NK细胞活性显著降低(P<0.05)。CVT-200组,RS+CPE合剂高、中和低剂量组由ConA诱导的T淋巴细胞和LPS诱导的B淋巴细胞增殖活性及NK细胞活性均显著高于CTX组(P<0.05)。RS-CPE合剂中剂量组小鼠T和B淋巴细胞增殖活性及NK细胞活性显著高于CVT-200组和RS+CPE合剂高、低剂量组(P<0.05)。RS+CPE合剂高剂量组小鼠NK细胞活性显著高于CVT-200组(P<0.05)。
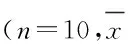
表6 各组小鼠体内T和B淋巴细胞增殖情况及NK细胞活性
*P<0.05vscontrol group;△P<0.05vsCTX;#P<0.05vsCVT-200 group;▲P<0.05vslow dose of RSE+CPE group.◆P<0.05vshigh dose of RSE+CPE group.Low dose of RSE+CPE group:RSE 20 mg·kg-1+ CPE 79 mg·kg-1;Middle dose of RSE+CPE group:RSE 40 mg·kg-1+ CPE 158 mg·kg-1;High dose of RSE+CPE group:RSE 80 mg·kg-1+ CPE 316 mg·kg-1.
3 讨 论
以往的中药药理实验多采用将中药粗提物直接进行体外实验,但粗提物不能代表在体内能真正发挥作用的有效成分[7]。血清药理学的提出排除了通常体外实验所带来的弊端。制备含药血清所需的给药时间报道不一致,有实验早晚2次给药,连续给药3 d[8],也有实验连续给药4 d[9]。李秀荣等[10]在实验中发现:连续给药5 d和10 d,其含药血清的药理活性相近。
本实验采用3×3析因设计,制备了9种RSE和CPE不同剂量组合的合剂,给大鼠连续灌胃5 d得到含药血清,体外进行T、B淋巴细胞增殖实验及NK细胞活性实验结果表明:RSE 200 mg·kg-1+ CPE 790 mg·kg-1组合的合剂提高免疫功能的作用明显优于单独用相应剂量的RSE或CPE,且其作用优于其他剂量的组合,提示该剂量组合为RSE和CPE增强免疫功能的最佳剂量组合。本研究结果表明:RSE和CPE间无显著的交互作用,提示RSE和CPE的联合作用仅为2种物质的相加作用。
血清药理学实验中给药剂量的选择是血清药理学实验的重点和难点。给药量通常选择整体动物的等效剂量或乘以一定的倍数[11],目前尚无统一的标准。本研究结果显示:RSE和CPE合剂的血清药理学实验剂量为5倍于动物体内实验剂量时效果最佳。
为了进一步证明血清药理学筛选的最佳剂量组合在体内的免疫增强功能,本研究取血清药理学实验最佳剂量的1/10、1/5及2/5,检测RSE和CPE合剂对免疫抑制小鼠的免疫增强作用。CTX是较强的烷化剂,对骨髓细胞具有毒性,且可杀伤各种免疫细胞,抑制免疫功能。本实验中给予CTX的小鼠各项免疫学指标均明显低于正常对照组,表明小鼠免疫功能受损,模型制备成功。本实验结果表明:血清药理学实验最佳剂量的1/5(RSE 40 mg·kg-1和CPE 158 mg·kg-1)剂量组合显著提高免疫抑制小鼠T和B淋巴细胞增殖能力及NK细胞活性,而且作用优于其他2个剂量组合,此结果与体外实验结果一致。
研究[12]表明:给予老年大鼠喂饲添加红景天苷的饲料,增加其总T细胞(CD3+)和辅助T细胞(CD4+),可以通过增强大鼠单核吞噬细胞系统的功能从而提高机体的防御能力。李立等[13]给小鼠连续灌胃红景天提取物30 d,红景天提取物可明显提高小鼠NK细胞活性及小鼠腹腔巨噬细胞的吞噬功能。
唐清秀等[14]观察发现:甘肃产党参精和党参多糖能提高小鼠腹腔巨噬细胞吞噬功能,并增加免疫器官质量。曹丽等[15]和李艳等[16]分别探讨了党参多糖和新疆党参多糖对正常脾淋巴细胞增殖的作用,均发现有促进作用,且前者作用明显。俞星等[17]发现党参皂苷D在一定剂量范围内能较好的抑制肝癌细胞的增殖及扩散。马方励等[18]研究发现党参多糖具有促进小鼠小肠推动、促进大鼠消化及生长的作用。
胸腺和脾脏是重要的免疫器官。脾脏可以从血液中收集抗原,经过T、B淋巴细胞的成熟和抗原的刺激,形成淋巴细胞分化的主要场所。胸腺和脾脏质量和指数变化是评价机体免疫状况的重要指标[19],常用于免疫增强功能的初筛实验。白细胞数量的变化可以影响机体的免疫力。本实验在预先给予RSE和CPE合剂的同时腹腔注射CTX后,SI和白细胞数显著升高,表明RSE和CPE合剂对CTX所致的脾脏萎缩和白细胞减少的不良反应具有显著的拮抗作用。上述结果提示RSE和CPE合剂有望作为临床癌症化疗的辅助治疗剂,减少化疗药物免疫抑制的不良反应。本实验中RSE和CPE合剂对CTX所致的免疫抑制小鼠TI虽然有一定的升高作用,但差异无统计学意义,推测其原因可能是实验周期较短,胸腺尚未得到恢复。
T淋巴细胞是重要的免疫活性细胞,T淋巴细胞在受到抗原刺激后变成致敏细胞,攻击具有抗原性的异物,其经有丝分裂原ConA激活后转化为淋巴母细胞,其转化增殖程度可反映机体细胞免疫功能。B淋巴细胞在受到抗原刺激后变成浆细胞,产生并分泌多种免疫球蛋白,使抗体与抗原发生免疫反应,对抗原进行攻击,消除对抗体的损害作用。本实验结果显示:高、中、低剂量RSE和CPE合剂可显著提高免疫抑制小鼠脾脏T淋巴细胞转化增殖能力及B淋巴细胞增殖能力,且中剂量组的作用最强,说明RSE和CPE合剂在一定剂量范围内可以上调ConA诱导的T淋巴细胞增殖和LPS诱导的B淋巴细胞增殖反应,从而提高环磷酰胺诱导的免疫低下小鼠特异性体液免疫和细胞免疫功能,且存在最佳作用剂量范围。RSE和CPE合剂中剂量组增强免疫功能的作用显著高于阳性对照药物CVT-200组,表明本研究所用的RSE和CPE合剂增强免疫功能的作用达到或超过市售的免疫调节剂,具有可开发利用的价值。
骨髓抑制、白细胞数减少、NK细胞活性降低及机体免疫功能降低是癌症化疗过程中常出现的不良反应[20]。NK 细胞在脾脏中占3%~4%,是与 T、B 细胞并列的第三类群淋巴细胞。NK细胞在抑制和清除恶性肿瘤细胞中起着非常重要的作用[21],其杀伤能力的增强也反映了免疫功能的增强。王著敏等[22]研究显示:RSE可提高慢性疲劳模型动物NK细胞的杀伤活性,其作用优于归脾丸。很多研究结果表明:具有增强免疫功能的成分相互配伍后,其增强免疫功能作用显著放大[23]。本实验结果表明:RSE和CPE联合应用显著增强NK细胞的杀伤活性,且其作用优于单独使用RSE或CPE,提示RSE和CPE配伍有利于提高增强免疫功能。
综上所述,RSE和CPE组成的合剂增强了免疫抑制小鼠T和B淋巴细胞增殖能力及NK细胞活性,其作用优于2种提取物单一使用时的效果。有关RSE和CPE合剂增强免疫功能的作用机制有待于今后进一步研究。
[1]向进乐,刘勤晋.红景天及其功能性食品开发现状[J].粮食与油脂,2003,17 (9):47-49.
[2]季宇彬,耿欣,汲晨锋.红景天研究进展[J].天津中医药,2007,24(1):81-85.
[3]Zhao X,Lu Y,Tao Y,et al.Salidroside liposome formulation enhances the activity of dendritic cells and immune responses[J].Int Immunopharmacol,2013,17(4):1134-1140.
[4]吴君,黄萍,成金乐,等.党参破壁粉粒增强免疫功能及抗疲劳作用的研究[J].中国实验方剂学杂志,2011,17(4):179-181.
[5]吴晓牧,胡建新,张昆南,等.复方中药抑制免疫反应的研究[J].现代中西医结合杂志,2007,16(8):1022-1045.
[6]贾宁,王汉,郑晶.复方党参提取物对环磷酰胺处理小鼠免疫功能的调节作用[J].中国实验方剂学杂志,2011,17(17):206-209.
[7]刘殿菊,关霞.柴胡含药血清的体外抗肿瘤作用的实验研究[J].内蒙古中医药,2011,30(12):76-77.
[8]刘倩,马学盛.化浊行血汤含药血清血管内皮保护作用及其体内给药时效差异的研究[J].时珍国医国药,2009,20(10):2501-2502.
[9]魏雅芹,汤道权,高媛媛,等.银杏叶提取物血清药理学方法的建立及验证[J].中药药理与临床,2009,25(3):74-76.
[10]李秀荣,张丹,齐元富,等.消瘤平移合剂含药血清诱导肝癌 H-7402细胞凋亡的实验研究[J].中国中西医结合杂志,2001,21(9):684-687.
[11]朱凌鹏,常厦云,何贺,等.红景天苷对脂多糖诱导的小鼠心肌损伤保护作用的研究[J].药学与临床研究,2015,23(1):13-15.
[12]Lu L,Yuan J,Zhang S.Rejuvenating activity of salidroside (SDS):dietary intake of SDS enhances the immune response of aged rats[J].Age,2013,35(3):637-646.
[13]李立,王秋水,王亚东,等.红景天提取物对小鼠免疫功能的影响[J].安徽农业科学,2011,39 (6):3301-3302.
[14]唐清秀,程国权,张晓文.党参精及党参多糖对C57BL/6小鼠免疫功能的影响[J].地方病通报,1996,11(S1):1-3.
[15]曹丽,罗崇念,卞庆亚,等.党参多糖对鸡IL-2活性和淋巴细胞增殖反应的促进作用[J].中兽医医药杂志,2004 (1):3-4.
[16]李艳,孙萍,刘霞,等.新疆党参多糖的提取、含量分析及免疫功能的初步研究[J].中成药,2005,27(7):839-840.
[17]俞星,韩春姬,朴惠善,等.党参皂苷D对HepG-2细胞增殖时间效应和细胞周期的影响[J].吉林大学学报:医学版,2012,38(2):236-239.
[18]马方励,沈雪梅,时军.党参多糖对实验动物胃肠道功能的影响[J].安徽医药,2014,18(9):1626-1630.
[19]Xiong Q,Jiao Y,Zhao X,et al.Purification,characterization and immunostimulatory activity of polysaccharide fromCipangopaludinachinensis[J].Carbohydrate Polymers,2013,98(1):217-223.
[20]许炜茹,张青,富琦,等.升血汤对转移性结直肠癌化疗患者骨髓抑制及免疫功能的影响[J].中华中医药杂志,2015,30(6):2230-2232.
[21]Koo KC,Shim DH,Yang CM,et al.Reduction of the CD16-CD56 bright NK cell subset precedes NK cell dysfunction in prostate cancer[J].PLoS One,2013,8(11):e78049.
[22]王著敏,金杰.红景天对复合应激因素致慢性疲劳大鼠脾脏质量及NK cell 的影响[J].中医研究,2014,27(10):59-61.
[23]叶伶艳,任明,吕琳,等.多糖合剂的制备及体外间接抗肿瘤活性[J].吉林大学学报:医学版,2014,40(5):1033-1037.
Influence of Rhodiolasachalinensis and Codonopsispilosula mixture in immune function of mice
MA Tianyu1,JIANG Guozhe2,HAN Chunji2,LIU Liping3,YU Duwen4,5
(1. Department of Preventive Medicine,College of Medical Sciences,Yanbian University,Yanji 133002,China; 2. Department of Immunology and Pathogenic Biology,College of Medical Sciences,Yanbian University,Yanji 133002,China; 3. Department of Physiology,College of Medical Sciences,Yanbian University,Yanji 133002,China; 4.Department of Pharmacy,College of Pharmacy,Chia Nan University,Tainan 71710,Taiwan; 5.Fun Sun Medical and Pharmaceutical Technology Co.,Ltd.,Taipei 10597,Taiwan)
ObjectiveUsing serum pharmacology method to assess the optimal dose of Rhodiolasachalinensis extract(RSE)and Codonopsispilosula extract(CPE)combination as well as the effects of the combination on the immune function of mice.MethodsUsing the 3×3 facterial design,nine medicated serum of CPE and RSE mixture were made to assess the optimum combinational dose of CPE and RSE by detecting the T,B lymphocyte proliferation abilities and NK cell activityinvitro.Using the optimum combinational dose and reducing 2.5,5 and 10 times as high,middle and low doses of RSE+CPE groups,and the T,B lymphocyte proliferation abilities and the activity of NK cells in the mice were detectedinvivo.ResultsThe result of serum pharmacology indicates that compared with control group,the proliferation abilities of T,B lymphocytes and the activity of NK cells inducing by ConA and LPS in 200 mg·kg-1RSE +790 mg·kg-1CPE group were increased (P<0.05).The result ofinvivoexperiment indicated that compared with cyclophosphamide group,the spleen indexes(SI) in middle and high doses of RSE+CPE groups were significantly increased (P<0.05); compared with low dose of RSE+CPE group,the WBC number in middle dose of RSE+CPEgroup was significantly increased (P<0.05).Compared with cyclophosphamide group,the T and B cell proliferation abilities induced with ConA and LPS and killing activities of NK cells in low,middle and high doses of RSE+CPE groups and positive drug CVT-200 group were significantly increased (P<0.05).Compared with CVT-200 group,low and high doses of RSE+CPE groups,the T and B cell proliferation abilities induced with ConA and LPS and the activity of NK cells in middle dose of RSE+CPE group were significantly increased(P<0.05).ConclusionRSE and CPE mixture can enhance the immune function of mice; RES 200 mg·kg-1and CPE 790 mg·kg-1are the optimal doses.
Rhodiolasachalinensis;Codonopsispilosula;serum pharmacology; immune function
1671-587Ⅹ(2015)06-1163-08
10.13481/j.1671-587x.20150613
2015-06-17
科技部国际合作专项基金资助课题(2011DFA33470);吉林省科技厅科技发展计划项目资助课题(200905208)
马天宇(1990-),女,吉林省延吉市人,在读医学硕士,主要从事分子毒理学及保健食品研发方面的研究。
韩春姬,教授,博士研究生导师(Tel:0433-2435076,E-mail:cjhan@ybu.edu.cn);
俞笃文,助理教授,硕士研究生导师(Tel:886-2-27682713,E-mail:vincent@fungsun.com)
R285
A

