OX-LDL介导内皮细胞损伤及其对TLR-4和EpCAM表达的影响
陈 为,张 葵,张宸豪,李 强,李 妍
(1.吉林医药学院检验学院免疫学教研室,吉林 吉林 132013;2.第四军医大学西京医院临床免疫科,陕西 西安 710032)
OX-LDL介导内皮细胞损伤及其对TLR-4和EpCAM表达的影响
陈为1,张葵2,张宸豪1,李强1,李妍1
(1.吉林医药学院检验学院免疫学教研室,吉林 吉林 132013;2.第四军医大学西京医院临床免疫科,陕西 西安 710032)
目的:研究氧化型低密度脂蛋白(OX-LDL)对血管内皮细胞的损伤效应及其对Toll样受体4(TLR-4)和上皮细胞黏附分子(EpCAM)表达的影响。方法:培养人脐静脉内皮细胞ECV-304,实验分为对照组和实验组(25、50、100和200 mg·L-1OX-LDL),处理后细胞继续培养24 h,台盼蓝拒染法检测细胞活力;流式细胞术检测活性氧(ROS)水平、线粒体膜电位(MMP)、细胞周期与凋亡以及EpCAM和TLR-4表达水平。结果:与对照组比较,25、50、100和200 mg·L-1OX-LDL组ECV-304细胞内ROS水平升高,细胞活力和MMP下降(P<0.05)。与对照组比较,25和50 mg·L-1OX-LDL组S期细胞百分率升高,而G0/G1期细胞略减少,SubG1期细胞(凋亡细胞)随OX-LDL浓度增加而增加。与对照组比较,50 mg·L-1OX-LDL组24 h时ECV-304细胞膜表面TLR-4和EpCAM表达水平均明显升高(P<0.05)。结论:OX-LDL具有提高内皮细胞ROS水平、降低细胞活力和MMP以及诱导细胞凋亡等损伤效应,此过程中ECV-304细胞中TLR-4和EpCAM水平升高。
氧化型低密度脂蛋白;血管内皮细胞;活性氧;上皮细胞黏附分子;Toll样受体-4
血管内皮细胞覆盖于血管内膜表面,不仅在维持血管渗透性和血压调节中起关键作用,还通过分泌细胞因子、肽类激素和调节免疫黏附等机制参与免疫应答与炎症反应[1]。血管内皮细胞损伤在动脉粥样硬化(atherosclerosis,AS)、高血压、糖尿病和脑血管疾病等病理过程中起着重要作用[2]。常见导致血管内皮细胞损伤的因素包括内毒素脂多糖(lipopolysaccharides,LPS)、某些细菌的外毒素、体液中氧化型低密度脂蛋白(oxidized low density lipoprotein,OX-LDL)、同型半胱氨酸、血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)、末端晚期糖基化终末产物(advanced glycation end products,AGEs)和肿瘤坏死因子(tumor necrosis factors,TNFs)等[3]。近年来,微炎症(microinflammation)的概念被提出并引起重视。微炎症是指以循环系统中炎性蛋白和炎症性细胞因子轻度升高为特征的低强度、慢性炎症状态[4]。血管内皮细胞是微炎症的损伤对象,血管损伤因素OX-LDL和Ang Ⅱ可通过对内皮细胞的影响参与微炎症形成和维持。Ang Ⅱ可导致单核细胞表面的Toll样受体4(Toll like receptor 4,TLR-4)表达增加,增强LPS诱导单核细胞活化和细胞因子分泌[5]。OX-LDL是否在介导内皮细胞损伤同时也形成内皮细胞对外源血管损伤因素的高反应状态尚不清楚,上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)是一种细胞黏附分子,相对分子质量为40 000,具有314 个氨基酸,胞膜外区由242氨基酸组成[6]。EpCAM主要分布于正常上皮细胞间隙的紧密连接处,其细胞外区参与细胞与细胞、细胞与细胞外基质以及免疫细胞与血管内皮细胞的黏附;EpCAM还与调控细胞增殖的Wnt和PI3K信号途径相联。EpCAM组成性表达在血管内皮单层上皮、白细胞表面以及胰腺和肝脏等组织细胞表面。LPS可上调白细胞表面EpCAM表达,但体液中的内源性血管损伤因素OX-LDL对血管内皮和白细胞EpCAM有何影响尚未见相关报道[7]。本研究将探讨OX-LDL介导致血管内皮细胞损伤过程中,OX-LDL对TLR-4和EpCAM表达的影响,阐明微炎症刺激对血管内皮细胞重要的模式识别受体和黏附分子表达的影响。
1 材料与方法
1.1主要试剂OX-LDL购自北京索莱宝科技有限公司,碘化丙啶(propidium iodide,PI)为美国Sigma-Aldrich公司产品,罗丹明123(rhodamine 123,Rh123)和双氯荧光黄乙酸乙酯(dichlorofluorescin diacetate,DCFH-DA)购自上海碧云天生物技术研究所,RPMI 1640培养液购自美国Gibco公司,胎牛血清购自美国Hyclone公司,兔抗人TLR-4抗体购自美国Santa Cruz公司,鼠抗人EpCAM抗体由第四军医大学免疫学教研室惠赠,FITC标记的羊抗兔IgG、FITC标记的羊抗鼠IgG以及兔和鼠IgG购自北京中杉金桥生物科技有限公司。
1.2细胞培养自液氮中复苏人脐静脉内皮细胞ECV-304,在含10%小牛血清的RPMI 1640培养液中培养,每周传代3次,取对数生长期细胞用于实验。
1.3活性氧(reactive oxygen species,ROS)分析接种细胞于6孔板,对照组加入含10%小牛血清RPMI 1640培养液,实验组添加OX-LDL至不同终浓度(25、50、100和200 mg·L-1),继续培养24 h后收集细胞。PBS洗涤2次,100 μL PBS重悬细胞,加入DCFH-DA工作液,至其终浓度为5 μmol·L-1,混匀后在37℃避光反应30 min,PBS洗2次,400 μL PBS重悬细胞,流式细胞仪分析。荧光探针DCFH-DA进入细胞后被酯酶水解为DCFH,继而被ROS氧化而生成二氯氢化荧光素(dichlorofluorescin,DCF),DCF荧光强度值可反映细胞内ROS水平。
1.4细胞活力分析收集对照组和不同浓度OX-LDL处理24 h的细胞,PBS洗2次后,PBS重悬细胞,取50 μL细胞悬液,加入等量0.4%台盼蓝染色液染色2 min,加入血细胞计数板,显微镜下计数细胞,计算活细胞百分率,即细胞活力。细胞活力=(拒染细胞总数/计数细胞总数)×100%。
1.5线粒体膜电位(mitochondrial membrane potential,MMP)分析收集对照组和不同浓度OX-LDL处理24 h的细胞,PBS洗2次后,加入浓度为1 μmol·L-1的Rh123染色工作液200 μL,37℃条件下反应30 min。洗涤细胞2次,用400 μL的PBS缓冲液重悬细胞,流式细胞术分析。若MMP下降,被线粒体吸附的Rh123减少,因此检测Rh123发射平均荧光强度可代表MMP。
1.6细胞凋亡和细胞周期检测OX-LDL(0和50 mg·L-1)处理细胞24 h,每组取1×106个细胞,PBS洗涤2次后用80%甲醇溶液固定细胞,置于-20℃保存。检测前离心弃上清,PBS洗涤细胞2次,加入PI染液400 μL,室温染色30 min后,流式细胞术分析细胞周期。
1.7细胞膜分子表达分析OX-LDL(0和50 mg·L-1)处理细胞24 h,收集细胞,用含1%牛血清白蛋白的PBS溶液重悬细胞,密度为5×106mL-1。取200 μL细胞悬液,加入TLR-4或兔IgG(同型对照抗体),室温反应30 min,PBS洗涤3次,加入FITC标记羊抗兔IgG抗体反应30 min;PBS洗涤2次,400 μL PBS重悬细胞。取200 μL细胞悬液,加入EpCAM抗体或鼠IgG(同型对照抗体),室温反应30 min,PBS洗涤3次,加入FITC标记羊抗鼠IgG抗体反应30 min,洗涤2次后400 μL PBS重悬细胞。流式细胞术分析同型对照(isotype)、TLR-4和EpCAM的表达。
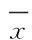
2 结 果
2.1ECV-304细胞中ROS水平对照组和25、50、100、200 mg·L-1OX-LDL组细胞内荧光强度值分别为26.9±1.4、28.4±1.9、32.1±1.6、33.5±2.3和29.6±2.5。与对照组比较,不同浓度OX-LDL作用24 h,细胞内ROS水平均升高(P<0.05)。
2.2ECV-304细胞活力对照组和25、50、100、200 mg·L-1OX-LDL组活细胞百分率分别为(96.4±4.5)%、(95.3±4.6)%、(92.2±6.9)%、(86.9±7.2)%和(81.2±6.1)%。与对照组比较,OX-LDL组活细胞百分率随OX-LDL浓度增加而下降(P<0.05)。
2.3ECV-304细胞MMPOX-LDL作用24 h,对照组和25、50、100、200 mg·L-1OX-LDL组MMP分别为22.8±1.5、21.6±1.3、19.1±1.8、17.0±1.9和12.3±2.1(图1)。ECV-304细胞的MMP随OX-LDL浓度增加而下降(P<0.05)。

A:Control group;B-E:25,50,100, and 200 mg·L-1 OX-LDL groups.
2.4ECV-304细胞周期和凋亡处理24 h后,细胞周期分析结果见表1。与对照组比较,25和50 mg·L-1OX-LDL组S期细胞百分率升高,而G0/G1期细胞略减少(P<0.05);SubG1期细胞(凋亡细胞)随OX-LDL浓度增加而增加(P<0.05)。

表1 各组ECV-304细胞周期百分率
*P<0.05 compared with control group.
2.5ECV-304细胞中TLR-4和EpCAM的表达免疫荧光染色和流式细胞术分析TLR-4和EpCAM表达,结果见图2和表2。50 mg·L-1OX-LDL作用24 h,ECV-304细胞膜表面TLR-4和EpCAM表达水平均明显升高(P<0.05)。

A,D:Control group( Isotype);B:Control group(stained by TLR-4 antibody);C:50 mg·L-1OX-LDL group(stained by TLR-4);D:Control group (Isotype);E:Control (stained by EpCAM antibody);F:50 mg·L-1OX-LDL group(stained by EpCAM antibody).
图2流式细胞术检测各组ECV-304 细胞中TLR-4和EpCAM表达
Fig.2Expressions of TLR-4 and EpCAM in ECV-304 cells in various groups detected FCM
表2各组ECV-304细胞中TLR-4和EpCAM表达水平


*P<0.05 compared with control group.
3 讨 论
高脂血症是AS的重要致病因素,黏附于血管内皮细胞的单核细胞增多并迁入内皮下间隙,在摄取大量的脂蛋白后转变成为泡沫细胞,泡沫细胞不断在内皮间隙聚积,形成脂纹病变[8]。以往在细胞与分子水平对OX-LDL致病作用的研究主要集中于单核巨噬细胞。OX-LDL升高巨噬细胞内ROS水平,而ROS可启动线粒体相关的凋亡转导途径,同时也诱导炎症性细胞因子(如IL-6)、趋化因子和多种黏附分子的合成,形成炎症反应的级联放大效应[9]。OX-LDL也通过血管内皮参与AS,探讨OX-LDL对血管内皮细胞的影响,对预防和治疗AS等疾病具有重要意义。本研究结果表明:OX-LDL可导致内皮细胞ROS水平升高,高浓度OX-LDL组ECV-304细胞的活力和MMP明显下降,细胞发生凋亡。低浓度OX-LDL可促进细胞增殖周期运转,25和50 mg·L-1OX-LDL作用24 h,S期细胞百分率增加。血管内皮细胞需保持数目相对稳定,内皮细胞数目减少或过度增殖均影响血管正常结构与功能,因此低浓度OX-LDL促进细胞周期的效应也应引起注意。
OX-LDL在单核巨噬细胞和泡沫细胞表面的受体有多种,包括清道夫受体(cavenger receptors)如CD36分子、B族Ⅰ型清道夫受体、CD68分子和含成束蛋白的、表皮生长因子样、层连蛋白型表皮生长因子样和连接域清道夫受体1/2(fascicin,EGF like,laminin-type EGF-like and link domain-containing scavenger receptor 1/2, FEEF1/2)等[10]。上述受体可能在介导OX-LDL毒性、促进AS过程中发挥重要作用,但其在内皮细胞不表达或表达量很低。近年来发现的凝集素样氧化型低密度脂蛋白受体1(LOX-1)是表达于内皮细胞的主要OX-LDL受体,LOX-1是一个多配基受体,除了结合OX-LDL外,还可结合末端晚期糖基化终末产物、C反应蛋白和热休克蛋白等[11]。OX-LDL与LOX-1结合,可通过线粒体电子传递链等途径诱导内皮细胞内ROS水平升高。而ROS可作为第2信使活化细胞内磷脂酰肌醇3激酶(PI3K)、细胞外调节激酶1/2(ERK1/2)和p38丝裂原激活的蛋白激酶(p38MAPK)等偶联的信号通路。OX-LDL与LOX-1结合,可上调血管内皮黏附分子1(VCAM-1)、细胞间黏附分子1(ICAM-1)和单核细胞趋化蛋白1(MCP-1)等表达,介导单核细胞与内皮细胞的结合和迁移[12]。本研究中OX-LDL对ECV-304细胞ROS水平、细胞活力、周期和凋亡的影响与文献报道一致,体现了LOX-1和其他OX-LDL受体介导的效应。
微炎症是指循环系统以炎性蛋白、炎性细胞因子低幅度升高为特征的慢性炎症状态。AngⅡ参与微炎症状态,并与AS和糖尿病等慢性疾病关联的观点受到重视[13-14]。AngⅡ与其受体结合可导致血管平滑肌收缩,从而调节血压平衡[15]。在严重创伤、失血性休克和烧伤等急性应激情况下,AngⅡ主要体现其对机体的保护性作用。但是上述疾病并发感染,尤其感染革兰阴性菌后,内毒素对血管内皮的损伤作用严重。有学者将AngⅡ诱导微炎症基础上内毒素致病性加重的现象称为“二次打击”,是微炎症参与疾病的具体表现。AngⅡ促进肺泡上皮细胞中TLR-4表达可能是形成该现象的重要原因[15-16]。本研究结果显示:OX-LDL对TLR-4和EpCAM表达具有明显的上调作用,2种膜分子均与免疫应答和炎症反应关系密切。TLR-4是LPS的主要受体,表达于多种免疫细胞和血管内皮细胞[17]。本研究结果提示:OX-LDL也可能通过上调血管内皮细胞LPS受体的表达,形成微炎症的状态,与LPS形成协同作用,增强内皮细胞对外源炎症刺激的反应,导致血管内皮系统损伤。
EpCAM(CD326)是近年来发现一种Ⅰ型跨膜蛋白,相对分子质量约为40 000,EpCAM的表达模式不同于其他细胞黏附分子,正常情况下仅表达于上皮组织,但在病理情况下在多种肿瘤和炎症组织中表达。EpCAM的胞膜外区和胞浆区均具有重要功能,胞膜外区主要发挥黏附作用,参与免疫细胞和血小板黏附、迁移和相互作用;其胞浆区可以被切割并入细胞核,参与调控多种细胞周期相关基因的表达[18,6]。OX-LDL诱导对EpCAM表达的影响尚未见相关报道。本课题组发现:OX-LDL可上调EpCAM的表达,前期实验还发现转染EPCAM促进单核细胞与内皮细胞的黏附作用。
综上所述,OX-LDL对TLR-4和EpCAM 2种膜分子具有上调效应,表明OX-LDL可能在介导血管内皮细胞损伤同时,也形成血管内皮细胞对LPS等外源血管损伤因素的高反应状态。阻断TLR-4和EpCAM是否可减轻血管内皮细胞在细菌感染等情况下的损伤,尚需要结合体内研究进一步探索。
[1]Onat D, Brillon D, Colombo PC, et al. Human vascular endothelial cells: a model system for studying vascular inflammation in diabetes and atherosclerosis[J].Curr Diab Rep,2011,11(3):193-202.
[2]Park C, Kim TM, Malik AB.Transcriptional regulation on endothelial cell and vascular development[J].Circ Res,2013,112(10): 1380-1400.
[3]Sima AV, Botez GM, Stancu CS,et al. Effect of irreversibly glycated LDL in human vascular smooth muscle cells: lipid loading, oxidative and inflammatory stress [J]. Cell Mol Med, 2010,14(12):2790-2802.
[4]Merino A, Portolés J, Selgas R, et al. Effect of different dialysis modalities on microinflammatory status and endothelial damage[J].Clin J Am SocNephrol,2010,5(2):227-234.
[5]Kranidioti H, Orfanos SE, Vaki I, et al. Angiopoietin-2 is increased in septic shock: evidence for the existence of a circulating factor stimulating its release from human monocytes [J].Immunol Lett, 2009,125(1):65-71.
[6]Wu CJ, Mannan P, Lu M,et al. Epithelial cell adhesion molecule (EpCAM) regulates claudin dynamics and tight junctions[J]. J Biol Chem, 2013,288(17):12253-12268.
[7]Wang X, Wang Y, Yang M, et al. A newly identified epithelial cell adhesion molecule (EpCAM) from grass carp (Ctenopharyngodon idellus): cloning, tissue distribution and lipopolysaccharide-induced expression in head kidney leucocytes [J].Fish Shellfish Immunol, 2010,29(6):998-1002.
[8]Di Pietro M, Filardo S, De Santis F, et al. Chlamydia pneumoniae and oxidative stress in cardiovascular disease: state of the art and prevention strategies [J]. Int J Mol Sci, 2014,16(1):724-735.
[9]Lee WJ, Ou HC, Hsu WC, et al.Ellagic acid inhibits oxidized LDL-mediated LOX-1 expression, ROS generation, and inflammation in human endothelial cells [J]. Vasc Surg, 2010,52(5):1290-1300.
[10]冉小丽,吴芹,石京山,等.凝集素样氧化型低密度脂蛋白受体1在动脉粥样硬化中的作用[J].中国药理学与毒理学杂志,2013,27(5):865-869.
[11]Li C, Zhao G, Che C, et al. The role of LOX-1 in innate immunity to aspergillus fumigatus in corneal epithelial cells[J].Invest Ophthalmol Vis Sci,2015,56(6):3593-3603.
[12]Feng Y,Cai ZR, Tang Y, et al.TLR4/NF-κB signaling pathway-mediated and oxLDL-induced up-regulation of LOX-1, MCP-1, and VCAM-1 expressions in human umbilical vein endothelial cells[J]. Genet Mol Res,2014,13(1):680-695.
[13]Schilling JD, Machkovech HM, He L, et al. TLR4 activation under lipotoxic conditions leads to synergistic macrophage cell death through a TRIF-dependent pathway [J]. J Immunol, 2013,190(3):1285-1296.
[14]张伟, 蒋耀光, 谢志坚,等.严重胸部创伤复合内毒素感染对肺泡与肺间质巨噬细胞吞噬功能的影响[J].中国危重病急救医学,2003,15(7): 408-410.
[15]刘铭,王志禄.肾素-血管紧张素-醛固酮系统及其受体与心血管疾病[J].中华心血管病杂志,2002,30(3):190-192.
[16]于振香, 赵珩, 彭丽萍.人参二醇组皂苷对失血-内毒素二次打击大鼠肺脏氧化损伤的保护作用[J].吉林大学学报:医学版,2008,34(4):594-598.
[17]Karnati HK, Pasupuleti SR, Kandi R,et al. TLR-4 signalling pathway: MyD88 independent pathway up-regulation in chicken breeds upon LPS treatment [J]. Vet Res Commun, 2015,39(1):73-78.
[18]Ni J, Cozzi P, Hao J, et al. Epithelial cell adhesion molecule (EpCAM) is associated with prostate cancer metastasis and chemo/radioresistance via the PI3K/Akt/mTOR signaling pathway [J]. Int J Biochem Cell Biol, 2013,45(12):2736-2748.
Damage of endothelial cells induced by OX-LDL and its influence in expressions of TLR-4 and EpCAM
CHEN Wei1,ZHANG Kui2,ZHANG Chenhao1,LI Qiang1,LI Yan1
(1.Department of Immunology,School of Medical Labrotary, Jilin Medical University,Jilin 132013,China;2.Department of Clinical Immunology, Xijing Hospital, Fourth Military Medical University,Xi’an 710032,China)
ObjectiveTo study the damage effect of oxidized low density lipoprotein (OX-LDL) on the endothelial cells and its influence in the expressions of Toll like receptor 4 (TLR-4) and epithelial cell adhesion molecule(EpCAM). MethodsThe human endothelial cells ECV-304 were culturedinvitroand treated by different concentrations of OX-LDL for 24 h, and the cell vitality was measured by Taipan blue rejection test.The reactive oxygen species(ROS) level,mitochondrial membrane potential(MMP),cell cycle and apoptosis were detected by flow cytometry (FCM).The expression of TLR-4 and EpCAM were also analyzed by FCM. ResultsCompared with control group, the ROS levels in ECV-304 cells in 25,50,100, and 200 mg·L-1OX-LDL were increased,but the cell vitalities and MMP were decreased(P<0.05). Compared with control group, the percentages of S phase cells in 25 and 50 mg·L-1OX-LDL groups were increased,the G0G1phase cells were slightly reduced, and the SubG1phase cells (apoptotic cells) were increased with the increasing of OX-LDL concentration. Compared with control group, the TLR-4 and EpCAM expression levels in ECV-304 cells in 50 mg·L-1OX-LDL group at 24 h were significantly increased (P<0.05).Conclusion OX-LDL could increase the ROS level and induce the apoptosis in vascular endothelial cells,while increase the cell vitality and MMP.During the damage process, the expresion levels of TLR-4 and EpCAM are up-regulated.
oxidized low density lipoprotein;vascular endothelial cell;reactive oxygen species;epithelial cell adhesion molecule;Toll like receptor-4
1671-587Ⅹ(2015)06-1144-06
10.13481/j.1671-587x.20150609
2015-08-23
国家自然科学基金资助课题(82102953);吉林省科技厅重大项目资助课题(20140203012YY);吉林省科技厅中青年科技创新领军人才及团队项目资助课题(20130521018JH);吉林省卫生厅项目资助课题(2012Z076);吉林省中医药管理局重点项目资助课题(2014ZD30)
陈为(1986-),男,河南省三门峡市人,在读医学硕士,主要从事非感染性炎症的免疫机制方面的研究。
李妍,教授,硕士研究生导师(Tel: 0432-64560461,E-mail:13894212310@163.com)
R541.6
A
网络出版时间:2015-11-11 16:30:32
网络出版地址:http://www.cnki.net/kcms/detail/22.1342.r.20151111.1630.001.html

