不可逆性电穿孔介导HPV16 E6 shRNA干扰质粒对宫颈癌SiHa细胞增殖的影响
王智亮,余腾骅,秦 琴,吴雨桐,张文倩,华媛媛,熊正爱,周 玮
(1. 重庆医科大学附属第二医院妇产科,重庆 400010;2. 重庆医科大学附属第一医院内分泌乳腺外科,重庆 400016;3.重庆市妇幼保健院产科,重庆 400013)
不可逆性电穿孔介导HPV16 E6 shRNA干扰质粒对宫颈癌SiHa细胞增殖的影响
王智亮1,余腾骅2,秦琴1,吴雨桐1,张文倩1,华媛媛1,熊正爱1,周玮3
(1. 重庆医科大学附属第二医院妇产科,重庆 400010;2. 重庆医科大学附属第一医院内分泌乳腺外科,重庆 400016;3.重庆市妇幼保健院产科,重庆 400013)
目的:探讨利用治疗剂量脉冲电场产生不可逆电穿孔(IRE)介导HPV16 E6 shRNA干扰质粒进入细胞的可行性,阐明二者共同作用对宫颈癌SiHa细胞增殖的影响及其作用机制。方法:将HPV16 E6基因特异性干扰序列插入pGenesil-1质粒,构建HPV16 E6 shRNA真核表达载体,将10个电压为800 V、脉宽100 μs、频率1 Hz的IRE作用于SiHa细胞与HPV 16 E6 shRNA干扰质粒的混悬液,根据处理因素组合,分为空白对照组、IRE处理组、pGenesil-N组、pGenesil-N+IRE组、pGenesil-E6组和pGenesil-E6+IRE组。在荧光显微镜下观察SiHa细胞绿色荧光蛋白(GFP)的表达,计算GFP表达效率;RT-PCR法检测HPV 16 E6 mRNA表达水平,Western blotting法检测HPV16 E6蛋白、P53及PCNA蛋白表达水平,CCK-8法检测各组SiHa细胞增殖能力的变化。结果:成功构建HPV16 E6 shRNA真核表达载体,IRE处理后24 h细胞即可见到绿色荧光;与IRE组比较,pGenesil-E6+IRE组E6 mRNA表达水平下降(P<0.05),E6蛋白表达水平降低(P<0.05),P53蛋白表达水平增高(P<0.05),PCNA表达水平下降(P<0.05);CCK-8法检测,与pGenesil-E6组比较,pGenesil-E6+IRE组细胞增殖活性下降更明显(P<0.05)。结论:治疗剂量的IRE可介导外源基因进入细胞,二者联合作用能明显抑制宫颈癌SiHa细胞增殖。
电穿孔;干扰质粒;宫颈肿瘤;细胞增殖
对脉冲电场(pulsed electric fields,PEF)的各参数(电场强度、脉冲宽度、脉冲频率和脉冲个数)进行不同调节及组合,可以实现电化学治疗(electrochemtherapy,ECT)、电基因治疗(electrogenetherapy,EGT)以及不可逆性电穿孔(irreversible electroporation,IRE)等作用[1]。外加较低场强电场作用于细胞,细胞膜脂质双分子层上形成可逆性“小孔”(可逆性电穿孔,reversible electroporation, RE),当电场参数达到一定阈值时,形成“永久性孔道”,细胞发生凋亡、坏死,即IRE,这是利用IRE进行肿瘤治疗的基础[2]。IRE对肿瘤的杀伤作用具有剂量依赖性[3],随着组织对电场能量的沉降,远离针极中心的组织所承受的电场强度降低,仅能发生RE[4],能量不足以杀伤细胞。人乳头瘤病毒(human papillomavirus,HPV)编码的E6可以与抑癌基因p53结合,使抑癌蛋白丧失功能,导致细胞生长失控,并逐步演变成侵袭性宫颈癌[5]。基因电转染(electrogene transfer)作为一种细胞转染的物理方法,与病毒载体转染法相比,具有无免疫原性和无突变风险[6]。为保证转染后细胞活力,其所需电场场强较低,在多种上皮性肿瘤细胞中为200~300 V·cm-1[7],而这恰好在IRE靶区外场强衰减范围(RE区域)内。Au等[4]率先在动物研究中证实:经门静脉大剂量团注质粒对猪肝实施IRE后,猪胆囊内可观察到绿色荧光,表明IRE可介导质粒进入肝细胞。但目前尚无治疗剂量IRE联合干扰质粒治疗肿瘤的可行性研究报道。因此,本研究拟以HPV16病毒阳性的宫颈癌SiHa细胞为研究对象,探讨以治疗剂量的IRE杀伤肿瘤细胞时,充分利用RE区域介导靶向HPV16病毒E6基因干扰质粒的可行性,阐明二者共同作用对于SiHa细胞增殖的影响及其可能的机制。
1 材料与方法
1.1细胞、主要试剂和仪器宫颈鳞癌细胞株SiHa(HPV16型病毒阳性)由重庆医科大学附属第二医院妇产科实验室提供;DMEM(高糖)培养基、胎牛血清和0.125%胰蛋白酶(美国Hyclone公司),质粒载体pGenesil-1和质粒抽提纯化试剂盒(北京鼎国昌盛有限公司),试剂盒反转录试剂盒2×Mix (大连宝生物公司),HPV16 E6蛋白抗体(兔抗人)(美国Santa Cruz公司),兔抗人PCNA和p53抗体(博奥森公司),Lipofecter脂质体转染试剂(碧云天生物技术研究所);脉冲电场肿瘤治疗仪(重庆大学输配电装备及系统安全与新技术国家重点实验室研制,专利号:ZL20071007828 2.7),电击小室(美国BIO-RAD公司)。
1.2HPV16 E6干扰质粒的构建与鉴定根据已知文献[8]中关于HPV 16 E6基因的有效siRNA靶序列,选择HPV 16型病毒E6蛋白的基因序列(Gene ID:1489078)第377~395核苷酸为HPV16E6靶序列小干扰RNA:5′-UACAACAAACCGUUGUGUG-3′;同时设计1条经Blast检索与现有基因文库中所有人源基因均无同源性的非特异性序列作为阴性对照序列:5′-GCAGATAGGTAGGCGTTAT-3′。上述2条序列分别命名为HPV16 siE6和HPV16 siN(negative)。HPV16 siE6引物正义链:5′-GATCCGGGAATCCATATGCTGTATTTCAAGAGAATACAGCATATGGA-
TTCCCTTTTTTA-3′,反义链:5′-AGCTTAAA-
AAAGGGAATCCATATGCTGTATTCTCTTGA-
AATACAGCATATGGATTCCCG-3′。将HPV16 E6基因特异干扰序列构建入pGenesil-1质粒。将单链目的序列片段退火形成的双链与经BamH和Hind 双酶切后的质粒pGenesil-1用T4连接酶连接,转化DH5α感受态细胞,经扩大培养、质粒提取、酶切鉴定与测序(上海生工生物工程技术公司),将二者分别命名为pGenesil-E6和pGenesil-N(阴性质粒)。通过鉴定的质粒,扩大培养后提取质粒备用。
1.3细胞培养SiHa细胞培养于含10%胎牛血清的DMEM培养基(37℃、5%CO2饱和湿度)中。
1.4细胞IRE及分组选取指数生长期SiHa细胞,用无血清DMEM培养基重悬,调整密度为2×106mL-1。细胞分为6组:空白对照组、IRE处理组、pGenesil-N组、pGenesil-N+IRE组、pGenesil-E6组和pGenesil-E6+IRE组。其中,IRE处理组、pGenesil-N+IRE组和pGenesil-E6+IRE组按如下步骤操作:将细胞悬液加入电转杯中,体积为500 μL,分别加入相应质粒20 μg,吹打均匀。处理参数:电压800 V、脉宽100 μs、频率1 Hz,脉冲个数10个。处理后电转杯置于37℃细胞孵箱孵育10 min。将细胞悬液转移至6孔板中,加入完全培养基2 mL,6 h后更换完全培养基。空白对照组、pGenesil-N组和pGenesil-E6组,提前1 d进行6孔板铺板,IRE处理IRE处理组、pGenesil-N+IRE组和pGenesil-E6+IRE组后,pGenesil-N组、pGenesil-E6组按照Lipofecter脂质体转染试剂盒说明书进行质粒转染。
1.5倒置荧光显微镜观察SiHa细胞中GFP表达电处理后24 h,用倒置荧光显微镜观察细胞形态学、GFP表达情况。随机选取5个高倍视野,分别计数细胞总数和发绿色荧光的细胞数,重复计数3次。表达效率=发绿色荧光细胞数/细胞总数×100%。
1.6RT-PCR法检测HPV16 E6 mRNA的表达TRIzol试剂盒提取各组细胞总mRNA,RT-PCR试剂盒检测各组细胞HPV16 E6 mRNA表达量。靶基因上游引物:5′-GAGCGACCCAGAAAGTTACCA-3′,下游引物:5′-AAATCCCGAAAAGCAAAGTCA -3′;GAPDH基 因 上 游 引 物:5′-AGGCCGAGAATGGGAAGCTTGTC-3′,下游引物:5′-CCCGGCATCGAAGGTGGAAGAG-3′。反应条件:95℃预变性5 min,95℃、30 s,60℃、30 s,72℃、90 s,30个循环,PCR产物经2%琼脂糖凝胶电泳检测后凝胶成像仪显影。按照相对定量的方法,利用HPV16 E6 mRNA基因与内参GAPDH的定量结果计算2-Δ ΔCt值,HPV16 E6 mRNA表达抑制率=(1-HPV16 E6 mRNA基因相对表达水平)×100%。
1.7Western blotting法检测各组细胞HPV16 E6、P53及PCNA的表达采用总蛋白提取试剂盒提取各组细胞总蛋白,15%SDS-PAGE凝胶电泳,常规湿法转膜,5%脱脂奶粉封闭1 h,一抗4℃孵育过夜[E6(1∶200),P53(1∶500),PCNA (1∶500),GAPDH(1∶3 000)],HRP标记的羊抗兔( 1∶5 000,P53/PCNA/GAPDH)、羊抗鼠(1∶5 000,E6)二抗常温孵育1 h,ECL发光显色,进行E6、P53和PCNA与GAPDH相对强度的比值分析。
1.8CCK-8法测定细胞增殖能力各组细胞处理后,离心、完全培养基重悬,调整细胞密度为8×104mL-1,每孔100 μL细胞悬液接种于96孔板。背景组不接种细胞只加入相应体积的培养基,每组设置5个复孔,培养24 h后,每孔加入10 μL CCK-8试剂,细胞孵箱中孵育2 h,酶标仪测定各孔的吸光度(A)值,波长选择450 nm,计算各处理组中的相对细胞数。实验重复3次。
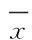
2 结 果
2.1HPV16基因shRNA重组质粒测序鉴定重组质粒单酶切后,在DL 2000 DNA marker凝胶电泳出现200 bp左右(引物+目的片段)的片段,证明人HPV16 E6 shRNA基因已成功插入到载体中;测序结果显示重组质粒的目的序列与设计的寡核苷酸序列一致。见图1。
2.2倒置荧光显微镜观察GFP表达效率IRE转染后24 h,SiHa细胞在荧光显微镜下发出绿色荧光(图2,见插页一)。pGenesil-N+IRE组与pGenesil-E6+IRE组GFP表达效率比较差异无统计学意义(P>0.05),表明IRE可以发挥基因转染作用,促进外源基因进入细胞内部。由于pGenesil-1载体上含有neo基因,使用G418筛选IRE处理后的细胞,传代5次以后,使pGenesil-N+IRE组IRE联合阳性质粒与pGenesil-E6+IRE组GFP阳性细胞数比例升高,与pGenesil-N组和pGenesil-E6组比较,GFP表达效率差异无统计学意义(P>0.05)。

M:DL 2000 DNA marker; Lane 1: pGenesil-E6; Lane 2:pGenesil-N; Lane 3:pGenesil-1 blank vector.
图1重组质粒单酶切鉴定结果
Fig.1Single enzyme digestion results of recombinant plasmid
2.3IRE处理质粒后SiHa细胞中HPV16 E6 mRNA及相关蛋白表达水平RT-PCR法检测结果:与正常对照组和IRE组比较,pGenesil-E6组及pGenesil-E6+IRE组HPV16 E6 mRNA表达水平均降低(P<0.05),以pGenesil-E6+IRE组更明显,E6 mRNA降低(63.23±8.17)%(图3A和B)。Western blotting法检测结果:E6蛋白表达趋势与PCR结果一致,与IRE处理组比较,pGenesil-E6+IRE组E6蛋白表达水平[(51.06±6.32)%]降低(P<0.05);同时P53蛋白水平[(246.27±13.18)%]升高,PCNA表达水平[(63.26±7.17)%]降低(图4A和B)。
2.4CCK-8实验测定各组细胞增殖情况CCK-8实验检测结果显示:96 h时pGenesil-E6组细胞增殖活性显著低于对照组(P<0.05),pGenesil-N+IRE组细胞增殖活性明显低于IRE组(P<0.05),pGenesil-E6+IRE组细胞增殖活性明显低于pGenesil-N +IRE组(P<0.05)。各组SiHa细胞增殖活性从48 h开始出现升高,pGenesil-E6组细胞增殖活性低于对照组(P<0.05),pGenesil-E6+IRE组细胞增殖活性低于pGenesil-N +IRE组(P<0.05)。 见表1。
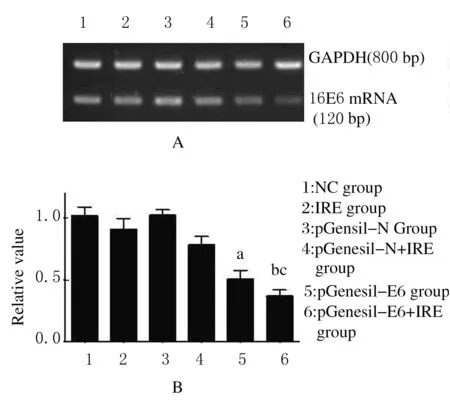
A:Electrophoregram;Lane 1:NC group;Lane 2:IRE group;Lane 3:pGenesil-N group;Lane 4:pGenesil-E6 group;Lane 5:pGenesil-E6 group;Lane 6:pGenesil-E6+IRE.B:E6 mRNA semi-quantitative analysis;a:P<0.05vspGenesil-N group; b:P<0.05vspGenesil-N +IRE group; c:P<0.05vspGenesil-E6 group.
图3IRE处理后SiHa细胞中HPV16 E6 mRNA表达
Fig.3Expressions of HPV16 E6 mRNA in SiHa cells after treated with IRE detected by RT-PCR

A:Electrophoregram;Lane 1:NC group;Lane 2:IRE group;Lane 3:pGenesil-N group;Lane 4:pGenesil-E6 group;Lane 5:pGenesil-E6 group;Lane 6:pGenesil-E6+IRE.B:E6 mRNA semi-quantitative analysis;a:P<0.05vspGenesil-N group; b:P<0.05vspGenesil-N +IRE group; c:P<0.05vspGenesil-E6 group.
图4Western blotting法检测IRE处理后SiHa细胞E6及相关蛋白表达
Fig.4Expressions of E6 mRNA and related proteins in SiHa cells after treated with IRE detected by Western blotting method

表1 CCK-8实验检测各组SiHa细胞增殖活性
*P<0.05,P<0.01 compared with control group;△P<0.05 compared with IRE group;#P<0.05 compared with pGenesil-N +IRE group.
3 讨 论
通过调整PEF的相关物理参数(电压、脉宽、频率和脉冲个数)可以观察到复杂的生物学效应,这主要与位于电场内的细胞或亚细胞结构的变化有关[9]。PEF在生命科学领域内的早期应用,均基于PEF的可逆性电穿孔RE效应,撤去外加电场后,细胞膜表面的孔洞自然闭合,不影响细胞的存活[10]。在孔洞闭合之前,细胞周围的大分子(DNA、化疗药物和碘化丙啶PI等)可以通过该孔洞进入细胞,这就是基因电转染、EGT或ECT。在此过程中,PEF的主要作用是开放细胞膜、形成孔洞,但必须要保证细胞的存活率,因此,一般外加电场的场强较低即阈值场强为<667 V·cm-1,这是发生IRE损伤的理论阈值[3],大于此阈值,细胞将发生不可逆性电穿孔,导致细胞死亡。
本课题组前期研究已证实HeLa细胞在参数为“脉宽100 μs,频率1 Hz,脉冲8个”的PEF作用下,发生凋亡的阈值场强为1 250~1 500 V·cm-1,发生不可逆性电穿孔而早期坏死的阈值场强为1 750 V·cm-1[11],而且亚致死剂量PEF对HeLa细胞增殖无明显影响[12]。因此,本研究保持其他参数同前(脉宽100 μs,频率1 Hz,脉冲8个),而采用了较高场强2 000 V·cm-1(确保发生IRE),以验证IRE介导干扰质粒进入细胞的可行性,以及二者对宫颈癌SiHa细胞增殖的影响。
本研究成功构建了GFP标记的靶向HPV16型病毒E6基因的质粒pGenesil-E6,采用治疗剂量的PEF处理SiHa细胞后24 h,在倒置荧光显微镜下可以观察到绿色荧光,表明治疗剂量PEF可介导质粒进入肿瘤细胞。本研究进一步显示:虽然在参数为电压800 V(场强2 000 V·cm-1)、脉宽100 μs、频率1 Hz、脉冲个数10个时,细胞增殖受到抑制,但与正常对照比较差异无统计学意义;而IRE转染pGenesil-E6质粒后,E6蛋白表达水平降低,P53蛋白表达水平增加,与细胞增殖相关的PCNA表达降低,细胞增殖能力与脂质体转染pGenesil-E6比较差异有统计学意义。上述结果表明:靶向HPV16 E6基因的shRNA发挥了基因沉默的作用,E6蛋白可能参与细胞增殖的调节; IRE与靶基因转染或有协同作用,使得pGenesil-E6+IRE发挥了更强的抑制增殖作用。本文作者猜测这可能是二者共同作用影响了PEF的“剂量效应窗口”,或者在IRE与shRNA干扰质粒之间存在某种协同作用,其具体机制有待进一步研究。
虽然IRE已成功应用于多种实体肿瘤(肝、肾、胰腺和前列腺等)的实验性治疗,且展现了良好的应用前景[2],但是由于PEF自然属性,IRE损伤区域存在较大异质性[13](不同组织或者个体存在电导性差异)、治疗区域偏小(单次治疗体积≤1 cm3)[13-14]。Qin等[15]研究发现:未完全消融的肿瘤组织有较高的复发风险。本研究所验证的“治疗剂量IRE也可发挥基因转染作用”的实验基础,有望克服上述单用IRE存在的问题,因此这将为尝试联合IRE与干扰质粒对宫颈癌的物理治疗奠定理论基础。
[1]Yao C,Guo F,Li C,et al.Gene transfer and drug delivery with electric pulse generators[J].Curr Drug Metab,2013,14(3):319-323.
[2]Silk M,Tahour D,Srimathveeravalli G,et al.The state of irreversible electroporation in interventional oncology[J].Semin intervent Radiol,2014,31(2):111-117.
[3]Rubinsky B,Onik G,Mikus P.Irreversible electroporation:a new ablation modality -clinical implications[J].Technol Cancer Res Treat,2007,6(1):37-48.
[4]Au JT,Mittra A,Song TJ,et al.Irreversible electroporation facilitates gene transfer of a GM-CSF plasmid with a local and systemic response[J].Surgery,2013,154(3):496-503.
[5]Steenbergen RD,Snijders PJ,Heideman DA,et al.Clinical implications of (epi)genetic changes in HPV-induced cervical precancerous lesions[J].Nat Rev Cancer,2014,14(6):395-405.
[6]Hacein-Bey-Abina S,Von Kalle C,Schmidt M,et al.A serious adverse event after successful gene therapy for X-linked severe combined immunodeficiency[J].N Engl J Med,2003,348(3):255-256.
[7]Guo H,Hao R,Wei Y,et al.Optimization of electrotransfection conditions of mammalian cells with different biological features[J].J Membrane Biol,2012,245(12):789-795.
[8]Butz K,Ristriani T,Hengstermann A,et al.siRNA targeting of the viral E6 oncogene efficiently kills human papillomavirus-positive cancer cells[J].Oncogene,2003,22(38):5938-5945.
[9]Jiang C,Davalos R,Bischof JC.A review of basic to clinical studies of irreversible electroporation therapy[J].IEEE Trans Biomed Eng,2015,62(1):4-20.
[10]Yarmush ML,Golberg A,Serša G,et al.Electroporation-based technologies for medicine:principles,applications,and challenges[J].Annu Rev Biomed Eng,2014,16(1):295-320.
[11]周玮,熊正爱,刘颖,等.不可逆性电穿孔致HeLa细胞凋亡与坏死的作用研究[J].第三军医大学学报,2010,32(18):1941-1944.
[12]周玮,熊正爱,刘颖,等.亚致死剂量脉冲电场对HeLa细胞恶性生物学行为的影响[J].第三军医大学学报,2012,34(16):1604-1607.
[13]Guo Y,Zhang Y,Klein R,et al.Irreversible electroporation therapy in the liver:longitudinal efficacy studies in a rat model of hepatocellular carcinoma[J].Cancer Res,2010,70(4):1555-1563.
[14]Ellis TL,Garcia PA,Rossmeisl JH Jr,et al.Nonthermal irreversible electroporation for intracranial surgical applications[J].J Neurosurg,2011,114(3):681-688.
[15]Qin Z,Jiang J,Long G,et al.Irreversible electroporation:an in vivo study with dorsal skin fold chamber[J].Ann Biomed Eng,2013,41(3):619-629.
Influence of irreversible electroporation mediated HPV16 E6 shRNA interference plasmid in proliferation of cervical cancer SiHa cells
WANG Zhiliang1,YU Tenghua2,QIN Qin1,WU Yutong1,ZHANG Wenqian1,HUA Yuanyuan1,XIONG Zhengai1,ZHOU Wei3
(1.Department of Gynecology and Obstetrics,Second Affiliated Hospital,Chongqing Medical University,Chongqing 400010,China; 2.Department of Endocrine and Breast Surgery,First Affiliated Hospital,Chongqing Medical University,Chongqing 400016,China; 3.Department of Obstetrics,Chongqing Health Center for Women and Children,Chongqing 400013,China)
Objective To explore the feasibility of using irreversible electroporation(IRE) mediating HPV16 E6 shRNA into cervical cancer cell line SiHa,and to clarify the influence of their co-effect on the proliferation of SiHa cells and its mechanism.MethodsA HPV16 E6 gene specific interference sequence was inserted in pGenesil-1 to build a interference vector.10 pulses of IRE with 800 V,100 μs, and 1 Hz were applied to the suspension of SiHa cells and vectors.According to the treatment factors,control group,IRE group,pGenesil-N group,pGenesil-N+IRE group,pGenesil-E6 group and pGenesil-E6+IRE group were set up.The expression of green fluorescent protein (GFP) and transfection efficiency were confirmed by inverted fluorescence microscope 24 h after the vector was transfected by IRE,and the expression efficancy of GFP was calculated.The expression levels of E6 mRNA and protein were detected by RT-PCR and Western blotting method which was also applied to detect the expressions of P53 and PCNA.The proliferative activity of SiHa cells was determined by CCK-8 assay. ResultsEnzyme digestion and DNA sequencing verified that the vectors were correctly constructed. GFP was seen under inverted fluorescence microscope 24 h after IRE transfection.Compared with IRE group,the expression levels of E6 mRNA and protein were decreased detected by RT-PCR and Western blotting method after the vectors were treated with IRE,the P53 protein expression level was increased(P<0.05),and the PCNA expression level was decreased(P<0.05). The CCK-8 assay results showed the proliferative activity of SiHa cells in pGenesil-E6+IRE group was decreased more obviously than that in pGenesil E6 group (P<0.05).ConclusionIRE can play the role of gene transfection of mediating HPV16 E6 shRNA into SiHa cells,and their co-effect can significantly inhibit the proliferation of SiHa cells.
electroporation;interference plasmid;uterine cervical neoplasms; cell proliferation
1671-587Ⅹ(2015)06-1107-06
10.13481/j.1671-587x.20150602
2015-04-03
国家自然科学基金资助课题(81201745,81301928);重庆市卫生局医学科研项目资助课题(2011-2-155)
王智亮(1987-),男,陕西省汉中市人,在读医学博士,主要从事妇科肿瘤方面的研究。
周玮,副主任医师(Tel:023-60333346,E-mail:dr.zhouwei@163.com)
R737.33
A

