植绒和棉签拭子对不同载体微量生物物证的提取研究
徐海军,叶志鹏,徐姚力,张金燕,李 丽
(海宁市公安司法鉴定中心,浙江 海宁 314400)
植绒和棉签拭子对不同载体微量生物物证的提取研究
徐海军,叶志鹏,徐姚力,张金燕,李 丽
(海宁市公安司法鉴定中心,浙江 海宁 314400)
目的 比较4N6FLOQSwabsTM植绒拭子和复合纳米棉签拭子对微量生物样本DNA的提取效果。方法 选取常见的三种载体(玻璃、一字开刀、抽屉拉手),经消毒去污处理,模拟载体表面微量DNA样本,分别采用4N6FLOQSwabsTM植绒拭子和复合纳米棉签拭子提取载体上微量DNA样本,以检出STR分型基因座数量、等位基因丢失数量、峰高面积三个方面作为提取效果的比较指标。结果 4N6FLOQSwabsTM植绒拭子提取微量DNA样本组成功检出5份微量DNA样本,有效检出4份;复合纳米棉签拭子提取微量DNA样本组中9份微量DNA样本均有效检出;复合纳米棉签拭子提取组的等位基因丢失数量显著多于4N6FLOQSwabsTM,峰高面积显著低于4N6FLOQSwabsTM。 结论 4N6FLOQSwabsTM植绒拭子对本研究中的玻璃表面指纹印、开刀表面脱落细胞和抽屉拉手表面脱落细胞的DNA提取效果显著优于复合纳米棉签拭子。
法医遗传学;微量DNA;DNA提取;4N6FLOQSwabsTM植绒拭子;复合纳米棉签拭子
长期以来,微量DNA样本的检验一直是个难题。有学者通过更高浓度DNA模板[1]或增加扩增循环次数[2]、纯化扩增产物等方式来提高微量DNA检出率[3,4]。要提高微量DNA的检出率,不能仅局限于DNA提取、扩增、检测方法的改良,更应注重对不同载体表面DNA的提取,提高载体表面DNA提取效果。本研究模拟了三种犯罪现场常见的载体表面微量DNA样本,分别采用4N6FLOQSwabsTM植绒拭子和复合纳米棉签拭子进行DNA提取,并对获得的常染色体多态性STR分型结果进行比较分析,旨在为选择微量DNA检材的提取手段提供参考和借鉴。
1 材料和方法
1.1 主要仪器和试剂
QIAcube纯化仪(美国QIAGEN公司),24孔2.0 mL恒温混匀仪(德国Eppendorf公司),高速离心机(德国Eppendorf公司),QIAamp DNA Investigator Kit(美国QIAGEN公司),Identifiler PlusTMkit(美国Life Technologies公司),9700型扩增仪(美国Life Technologies公司),3130XL分析仪(美国Life Technologies公司)。
4 N6FLOQSwabsTM植绒拭子(美国Life Technologies公司);复合纳米棉签拭子(北京佰优意诺言科技有限公司)。
1.2 实验样本
样本准备:已知DNA分型的试验人员三名,分别编号为A,B,C;规格为5cm×5cm的玻璃6块和同一型号的一字开刀6把,办公室相同类型抽屉拉手6处,试验前对以上样本和载体表面采用相同方法处理:先用10%漂洗液(7 mmol/L次氯酸钠溶液)反复擦拭玻璃表面,再用75%的乙醇反复擦洗,晾干待用。
样品采集:三名试验人员分别用左右手大拇指在两块规格为5cm×5cm的玻璃上捺指纹印1枚,用左右手各握1把一字开刀10 s,用左右手拉办公室抽屉拉手处进行开关动作2次。
样本提取与编号:分别采用4N6FLOQSwabsTM植绒拭子和复合纳米棉签拭子,干湿两步擦拭法对三名试验人员的平行样本进行提取,6枚指纹印分别编号为A1,A2,B1,B2,C1,C2;6把一字开刀表面擦拭分别A3,A4,B3,B4,C3,C4;6处办公室抽屉拉手表现擦拭分别编号为A5,A6,B5,B6,C5,C6。 其 中 A1,A3,A5,B1,B3,B5,C1,C3,C5为4N6FLOQSwabsTM植 绒 拭 子 提 取 样 本,A2,A4,A6,B2,B4,B6,C2,C4,C6为复合纳米棉签拭子提取样本。
1.3 检验方法
DNA提取:各样本分别置于2.0 mL带过滤篮的离心管中,加入480 µL ATL和20 µL PK,置于56℃恒温混匀仪900 r/min裂解2 h,裂解好后13000 r/ min离心5 min,弃过滤篮,在滤下的液体中加入1 µL载体RNA,混匀后置于QIAcube纯化仪中,启动程序进行样本DNA的提取。
STR复合扩增及检测分析:用Identifiler® PlusTM试剂盒、9700型扩增仪扩增,各组样本分别设3个平行进行相同条件扩增。采用10 µL扩增体系,模板DNA 4 µL,Reaction Mix 4 µL,Primer Set 2 µL。用3130XL分析仪对扩增产物进行毛细管电泳分离,使用GeneMapper ID V3.2软件进行数据分析。
2 结果与讨论
参考共有图谱分析法[5],采用重复出现的等位基因来判定STR分型检验结果(3个平行样本的同一基因座出现两次或以上相同数值分型,即认定该基因座检出该数值分型[6]),从认定的STR分型结果中统计各样本DNA图谱的检出基因座数量、等位基因丢失数量以及检出等位基因峰高面积。完整的16个基因座包括15个常染色体STR基因座及Amelogenin基因座,检出16个基因座分型为“成功”,检出9个以上STR基因座及Amelogenin基因座为“有效”。
植绒拭子和棉签拭子对玻璃表面指纹印、一字开刀表面脱落细胞、抽屉拉手表面脱落细胞的DNA常染色体多态性STR分型检验结果比较分别见表1、表2、表3。18份微量DNA检材,成功检出5份,有效检出13份,未检出混合基因分型,阴阳型对照均正常。选用4N6FLOQSwabsTM植绒拭子和复合纳米棉签分别提取的9份微量DNA样本中,利用植绒拭子提取的微量DNA样本中有5份成功检出16个基因座分型,4份有效检出9个以上基因座分型;复合纳米棉签拭子提取的9份微量样本均为有效检出。未成功检出的13份微量样本均不同程度地出现等位基因丢失的情况,4N6FLOQSwabsTM植绒拭子提取的微量样本丢失的等位基因座主要是CSF1PO、D18S51及D2S1338等长片段基因座,以丢失单个基因为主,复合纳米棉签拭子提取的微量样本组等位基因丢失的基因座除CSF1PO、D18S51、D2S1338、TPOX、D16S539等 长 片 段 外, 在vWA、D5S818等基因座也有丢失情况出现,丢失数量显著多于4N6FLOQSwabsTM植绒拭子提取组,部分长片段还出现了完全丢失情况;复合纳米棉签拭子提取的微量DNA样本检出的等位基因峰高明显低于4N6FLOQSwabsTM植绒拭子提取的微量样本。从检出基因座数量、等位基因丢失数量、峰高面积拉手表面脱落细胞的STR分型结果,4N6FLOQSwabsTM植绒拭子对上述三种载体的DNA提取效果显著好于复合纳米棉签拭子。
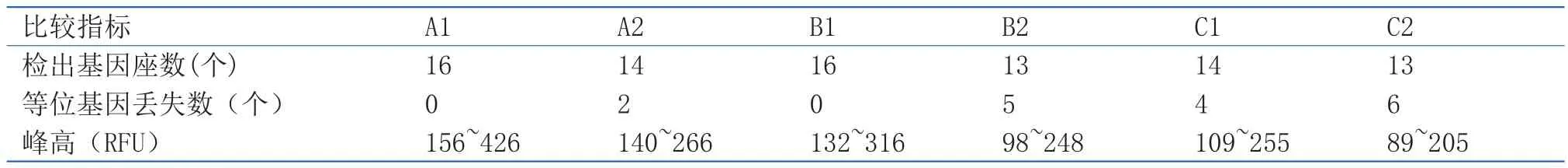
表1 指纹的STR分型结果比较Table1 Comparison of STR profi les of fi ngerprint DNA extracted with two kinds of swabs

表2 一字开刀表面DNA的STR分型结果比较Table2 Comparison of STR profi les of DNA extracted with two kinds of swabs from screwdrivers
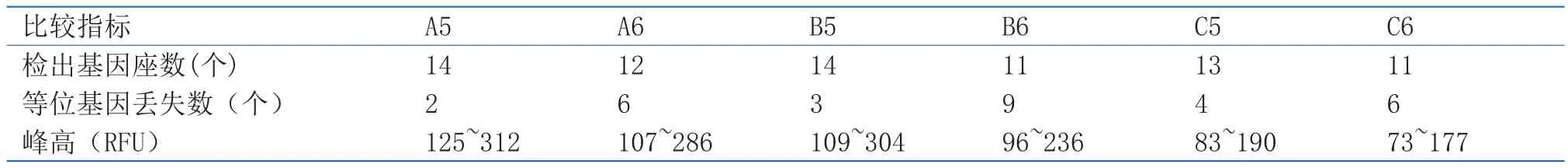
表3 抽屉拉手表面DNA的常染色体多态性STR分型检验结果比较Table3 Comparison of STR profi les of DNA extracted with two kinds of swabs from drawer handles
目前对接触类生物检材提取方法主要有棉签拭子干湿两步擦拭法、脱落细胞粘取法等,本研究中引入4N6FLOQSwabsTM植绒拭子,与传统的复合纳米棉签拭子对三种载体DNA提取效果比较分析,结果显示,4N6FLOQSwabsTM植绒拭子提取效果显著好于传统的复合纳米棉签拭子,其主要原因有:(1)4N6FLOQSwabsTM植绒拭子利用尼龙纤维植绒填充技术最大限度地提高DNA采集和洗脱效率。与传统的普通棉签不同,植绒拭子的尼龙纤维结构垂直于基底,使整个样本采集区域无内部吸收孔,DNA不易分散和滞留,洗脱更快更高效;(2)4N6FLOQSwabsTM植绒拭子擦拭微量样本表面后,包装在密封的光管中,拭子头部悬空,不接触其它物体表面,不存在二次转移,棉签拭子提取微量样本后采用滤纸包裹,使棉签上的脱落细胞等微量样本转移到滤纸上,增大了微量样本DNA含量的损耗[7];(3)4N6FLOQSwabsTM植绒拭子对样本的吸附和释放能力更强,由于植绒拭子材料与结构的特殊性,在采集样本时可更大程度吸附人体脱落细胞,在对样本进行裂解消化时,样本中微量成分也可高效释放,不滞留微量成分在植绒拭子内部。而传统的复合纳米棉签拭子由吸水性更强的纤维制成,在裂解消化过程中,样本中微量成分容易滞留在缠绕的纤维团中,影响DNA提取效果。需要注意的是,植绒拭子的吸水能力低于棉签拭子,在对灰尘较多、覆盖杂质较多的物体表面的DNA提取时可能会受到一定的影响,这有待进一步的试验研究。
[1] 张晓红,吴微微.3种常见体表痕迹接触性DNA的检验[J].刑事技术,2012(6):52-54.
[2] 吴微微,郝宏蕾,金胄,等.PCR扩增3因素对低拷贝模板STR分型的影响研究[J].中国法医杂志,2006, 21(6):4-6.
[3] 侯一平.法医学进展与实践(第7卷) [M].成都:四川大学出版社,2010:1-6.
[4] Hanson EK,Ballantyne J.Whole genome amplification strategy for forensic genetic analysis using single or few cell equivalents of genomic DNA [J].Anal Biochem, 2005,346(2):246-257.
[5] 张广峰,陈松,涂政,等.接触DNA检验成功率的影响因素探讨[J].刑事技术,2013(3):9-14.
[6] Bright JA, Gill P, Buckleton J.Composite profiles in DNA analysis [J].Forensic Sci Int Genet, 2012,6(3):317-321.
[7] Mariya G, van Oorschota RAH, Mitchellb JR.DNA transfer within forensic exhibit packaging: Potential for DNA loss and relocation[J].Forensic Sci Int Genet, 2012,6(2):158-166.
本文引用格式:徐海军, 叶志鹏, 徐姚力, 等.植绒和棉签拭子对不同载体微量生物物证的提取研究 [J].刑事技术,2015,40(5):373-375.
Trace DNA Extraction from Three Kinds of Carrier Using 4N6FLOQSwabsTMand Nano-cotton Swab
XU Haijun, YE Zhipeng, XU Yaoli, ZHANG Jinyan, LI Li
(Institute of Forensic Science, Haining Public Security Bureau,Zhejiang Haining 314400, China)
Objective To compare the effect of the 4N6FLOQSwabsTMand Nano-cotton swab on extracting trace DNA.Methods Three kinds of pre-decontaminated carriers, glass, screw driver and drawer’s handle, were used to contact volunteers’hands and 9 pairs of samples of human trace DNA (fingerprints on glass, exfoliated cells on screwdrivers and drawer handles) were prepared.DNA was extracted by either 4N6FLOQSwabsTMand/or Nano-cotton swab from all the samples and analyzed with GeneMapper ID V3.2 software.The DNA extract effi ciency was judged by the quantity of the detected loci,the loss of allelic genes and the peak area.Results For the 4N6FLOQSwabsTM, fi ve samples were successfully detected and the other four were effectively detected.For the Nano-cotton swab, all the nine samples were detected just at the effective level along with more signifi cant loss of allelic gene and more remarkable lower peak area than the corresponding one of the 4N6FLOQSwabsTM.Conclusions The effect of extracting trace DNA using 4N6FLOQSwabsTMis better than that using Nanocotton swab.
forensic genetics; trace DNA; DNA extraction;4N6FLOQSwabsTM; Nano-cotton swab
DF795.2
A
1008-3650(2015)05-0373-03
10.16467/j.1008-3650.2015.05.006
徐海军(1984—),男,浙江海宁人,法医师,硕士,研究方向为法医遗传学。 E-mail: xinhaijin1232000@163.com
2014-10-01

