皮秒脉冲电场对宫颈癌侵袭能力影响的实验研究
吴丽梅,华媛媛,吴雨桐,姚陈果,张睿哲,王智亮,熊正爱
2012年国际癌症研究机构公布的全球肿瘤流行病学统计数据表明,发展中国家宫颈癌新增病例44.45万,其中死亡病例23.02万,分别居所有新增病例和死亡病例的第2﹑3位[1]。虽然世界各国的研究人员都在致力于探索新的宫颈癌治疗策略[2-4],但是目前的手术治疗及放﹑化疗效果有限,且不良反应明显[5-7],其临床应用前景不容乐观。皮秒脉冲电场作为一种新兴的物理治疗方法,具有较高的时间和空间分辨率,信号失真小,并能避免对正常组织的损伤,从而能实现肿瘤的无创治疗,但其对肿瘤的作用及机制研究尚处于初步阶段。本研究从组织水平研究皮秒脉冲电场对宫颈癌的组织杀伤效应及其对宫颈癌侵袭能力的影响,以期推动该技术尽早进入临床,为宫颈癌患者提供一种无创的保留生育功能的新方法。
1 材料与方法
1.1 主要试剂和仪器 10%水合氯醛(重庆医科大学附属儿童医院),抗基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)单克隆抗体(Santa Cruz公司),抗血管内皮生长因子(vascular endothelial growth factor,VEGF)多克隆抗体(北京博奥森生物科技有限公司);皮秒脉冲电场发生仪(重庆市重庆大学输配电装备及系统安全与新技术国家重点实验室制造并调试)﹑示波器(Tektronix TDS3032B,USA)﹑镊型电极(重庆市重庆大学输配电装备及系统安全与新技术国家重点实验室提供)。
1.2 实验动物 24只4~6周龄健康雌性BALB/c裸鼠由重庆医科大学实验动物中心提供,体重14.0~18.0g,饲养于无特殊病原体的环境中,实验前先于该环境中适应3~5d。1.3 宫颈癌移植瘤模型制作 消毒上述裸鼠腹股沟根部待接种部位,注射混匀的HeLa细胞悬液0.2ml(含细胞5×106个),20~25d后待肿瘤最大直径长至0.5~0.8cm时,采用10%水合氯醛(70μl/20g)麻醉裸鼠,取皮下肿瘤组织置于冰上的培养皿中剪碎至1mm×1mm×1mm大小,消毒待接种的裸鼠左上肢根部皮肤,将组织块迅速接种于裸鼠皮下,对合皮肤并消毒,每隔1d观察移植瘤生长情况,约20d后成功建立宫颈癌移植瘤动物模型备用。
1.4 psPEF电场处理裸鼠移植瘤 10%水合氯醛麻醉待处理裸鼠,常规消毒肿瘤区域皮肤,根据肿瘤的形态选择适当的镊形电极摆放位置,尽可能使其作用范围覆盖整个肿瘤区域。按皮秒脉冲电场场强不同随机将宫颈癌模型动物分为4组:对照组﹑场强50kV/cm组﹑场强60kV/cm组﹑场强70kV/cm组,每组6只裸鼠。脉冲电场参数设定:固定频率为3Hz,脉宽为800ps,脉冲个数为2000个,每只裸鼠处理时间11min。对照组不予以任何处理。然后继续在上述环境中饲养1周,期间每隔1d观察裸鼠移植瘤生长情况,裸鼠的精神及饮食状况。
1.5 裸鼠移植瘤的组织学观察 皮秒脉冲电场处理后1周颈椎脱臼法处死裸鼠,立即取肿瘤组织,放入4%多聚甲醛溶液中固定,常规石蜡包埋﹑切片﹑HE染色,光镜下观察组织形态学的改变;同时将即刻取下的肿瘤切取2~3个1mm3大小的组织块,4%戊二醛固定,送重庆医科大学生命科学院电子显微镜室脱水,环氧树脂浸透,包埋﹑聚合,超薄切片,铀/铅染色,应用Hitachi-7500型透射电镜观察组织超微结构的变化。
1.6 免疫组化检测VEGF﹑MMP-9的表达 用兔多克隆抗体VEGF﹑鼠单克隆抗体MMP-9检测肿瘤组织内VEGF﹑MMP-9的表达,免疫组化染色按SP试剂盒(北京中杉金桥生物技术有限公司)说明书进行,采用Image-pro plus 6.0对图片的平均光密度值进行分析。
1.7 Western blotting检测 皮秒脉冲处理后1周,颈椎脱臼法处死裸鼠,立即取肿瘤组织放入液氮中保存,Western blotting检测肿瘤组织内VEGF﹑MMP-9的表达情况,以GAPDH为内参,用Bio-Rad凝胶成像系统扫描制片并行半定量分析。
1.8 统计学处理 采用SPSS 19.0软件进行统计分析,数据用±s表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结 果
2.1 宫颈癌荷瘤裸鼠模型的建立 肿瘤组织接种裸鼠皮下后1周可于接种部位见明显的肿瘤生长,接种后20d肿瘤长至0.6~0.8cm大小,可用于皮秒脉冲处理(图1)。
2.2 皮秒脉冲电场对宫颈癌组织的杀伤效应
2.2.1 HE染色结果 光镜下,对照组可见大量肿瘤细胞活跃生长,细胞密集,间质少,细胞核呈圆形﹑不规则形,核大,核仁明显,核分裂象多见;50kV/cm处理组肿瘤组织周边仍可见较大范围的癌细胞生长,坏死主要集中在中间区域,坏死组织内夹杂少许癌细胞;60kV/cm处理组肿瘤组织周边癌细胞较50kV/cm组减少,中央坏死区域增大,坏死较彻底,少数可见坏死细胞轮廓;70kV/cm处理组肿瘤组织周边仅见3~4层肿瘤细胞,可见少数坏死细胞轮廓(图2)。
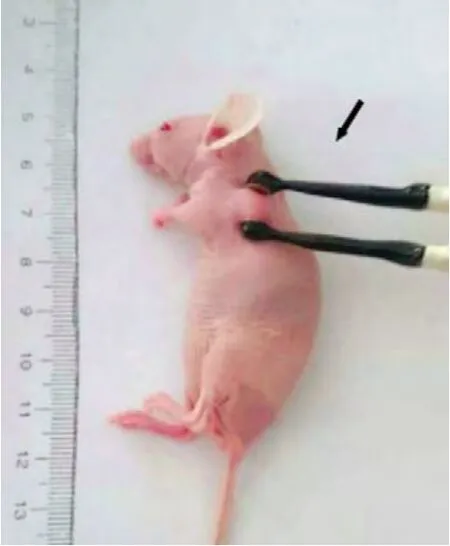
图1 皮秒脉冲电场作用于裸鼠皮下移植瘤(箭头示镊形电极)Fig. 1 psPEF acted on the subcutaneous transplanted tumor Arrow shows the tweezers type plate electrodes
2.2.2 电镜检测结果 电镜下,对照组肿瘤细胞核浆比大,核仁大而明显,可见少量粗面内质网和线粒体,细胞间连接清晰可见;50kV/cm处理组胞质内线粒体轻﹑中度肿胀,内质网轻﹑中度扩张,细胞核改变不明显,细胞间连接轻度减少;60kV/cm处理组肿瘤细胞质内线粒体明显肿胀,内质网明显扩张,细胞器部分受损,轮廓不清,胞核异染色质凝聚成团块状,并向核周边集;70kV/cm处理组肿瘤细胞大量坏死,镜下见大量细胞碎片,细胞器严重受损,不能辨认其结构,肿瘤细胞轮廓消失(图3)。

图2 各组肿瘤组织HE染色切片(×200)Fig. 2 HE staining of tumor tissue in each group (×200)
2.3 皮秒脉冲电场对宫颈癌细胞侵袭能力的影响
2.3.1 免疫组化检测结果 VEGF主要分布于胞质和基质中,MMP-9主要分布于胞质。对照组组织中阳性瘤细胞数目多,胞质染色较深,呈棕黄色,皮秒脉冲处理组随着脉冲场强的增加阳性瘤细胞数逐渐减少,染色逐渐变浅,呈浅黄色,尤其在70kV/cm处理组,极少见阳性瘤细胞(图4)。运用Image-Pro Plus 6.0软件对免疫组化图片进行光密度值测量,结果如表1所示:经皮秒脉冲电场处理后,肿瘤组织中VEGF和MMP-9蛋白的平均光密度值较对照组明显下降,且随着脉冲电场强度的增强,平均光密度值呈逐渐下降趋势,组间差异有统计学意义(P<0.05)。
表1 各组VEGF和MMP-9的平均光密度值变化(±s,n=6)Tab. 1 The average optical density of VEGF and MMP-9 in each group (±s, n=6)

表1 各组VEGF和MMP-9的平均光密度值变化(±s,n=6)Tab. 1 The average optical density of VEGF and MMP-9 in each group (±s, n=6)
(1)P<0.05 compared with control group; (2)P<0.05 compared with 50kV/cm group; (3)P<0.05 compared with 60kV/cm group
Group VEGF MMP-9 Control 0.151±0.012 0.146±0.011 50kV/cm 0.102±0.014(1) 0.100±0.016(1)60kV/cm 0.081±0.009(1)(2) 0.064±0.007(1)(2)70kV/cm 0.022±0.004(1)(2)(3) 0.014±0.002(1)(2)(3)

图4 VEGF﹑MMP-9表达的免疫组化分析(×400)Fig. 4 Expression of VEGF and MMP-9 in each group (IHC staining ×400)
2.3.2 Western blotting检测结果 随着皮秒脉冲电场强度的增加,VEGF和MMP-9的蛋白表达水平逐渐下降(P<0.05)。运用Quantity One灰度定量分析软件计算各条带的灰度值,并计算出目的条带灰度值与内参条带灰度值的比值,结果显示:处理组VEGF的灰度值(50kV/cm组0.666±0.055,60kV/cm组0.511±0.032,70kV/cm组0.305±0.023)明显低于对照组(0.818±0.043),组间比较差异有统计学意义(P<0.05),且60﹑70kV/cm组明显低于50kV/cm组(P<0.05),但60﹑70kV/cm组间差异无统计学意义。处理组MMP-9的灰度值(50kV/cm组0.818±0.040,60kV/cm组0.656±0.062,70kV/cm组0.464±0.027)也明显低于对照组(1.006±0.027,P<0.05),且60﹑70kV/cm组明显低于50kV/cm组(P<0.05),但60﹑70kV/cm组间差异无统计学意义(图5)。
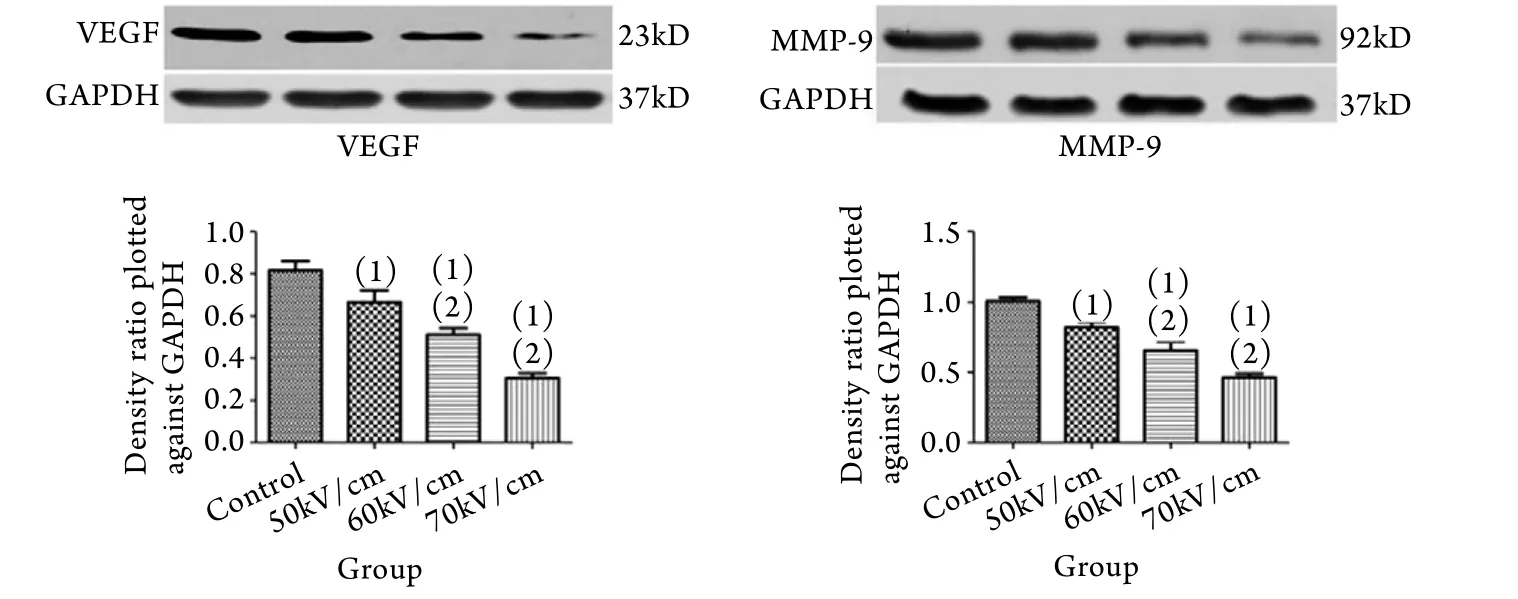
图5 皮秒脉冲电场对VEGF﹑MMP-9蛋白表达的影响Fig. 5 Effect of psPEF on the protein expression of VEGF and MMP-9
3 讨 论
近年来,世界各国的研究人员都致力于探索新的宫颈癌治疗策略[8-10],脉冲电场作为一种新兴的物理治疗方法逐渐被人们所重视。目前国内外研究者已对毫秒级﹑微秒级﹑纳秒级脉冲电场进行了大量研究,并取得了较大进展[11-14],但其有创性限制了在临床上的应用。皮秒脉冲电场通过冲激脉冲辐射天线可无创地将脉冲电场传输至生物组织内部,在杀伤肿瘤细胞的同时可避免对正常组织的损伤[15]。本课题组前期研究证实,psPEF对宫颈癌动物模型具有在体杀伤效应,而该效应可能与线粒体膜电位下降及内质网应激活化Caspase依赖的细胞凋亡途径相关[16]。但是我们同样观察到,皮秒脉冲作用后,肿瘤组织内仍残存少量癌细胞,而该部分癌细胞可能是后期复发和转移的隐患。因此,本课题在前期实验的基础上,重点对皮秒脉冲电场作用后残存肿瘤细胞的侵袭能力进行了初步研究。
肿瘤的侵袭过程主要包括肿瘤细胞的黏附﹑细胞外基质(ECM)的降解和细胞的远处转移[17]。在这个过程中MMP-9和VEGF发挥着重要作用,其中MMP-9主要发挥降解ECM的作用[18],而VEGF在肿瘤新生血管形成﹑肿瘤细胞远处转移方面发挥着重要作用[19]。本实验通过观察psPEF作用于裸鼠宫颈癌移植瘤后的组织学改变发现,psPEF能强有力地杀伤宫颈癌细胞,且在一定场强范围内随着脉冲电场强度的增强,杀伤效应逐渐增强,电镜观察可见大量不同形式的异染色质凝聚成块状﹑核溶解等,该结果符合本课题组前期实验结果[20]。此外,本研究结果还显示,促血管生成相关因子VEGF及基质降解相关蛋白MMP-9的表达随着脉冲电场强度的增强而逐渐降低,其中以70kV/cm组最为明显,说明psPEF可以抑制残存宫颈癌组织ECM的降解,减少肿瘤细胞周围营养血管的生成,从而降低其远处转移的可能。以上结果初步表明,psPEF在杀伤肿瘤细胞的同时,还可抑制残存肿瘤细胞分泌VEGF和MMP-9,能在一定程度上降低治疗后的复发和局部残存癌细胞的远处转移,降低其侵袭能力。但psPEF发挥该作用的机制并不清楚,我们推测可能是其引起了肿瘤内部微环境的变化,从而导致肿瘤细胞分泌功能的异常。
综上所述,psPEF具有抗宫颈癌的效应,该效应可能包括两个方面:直接作用于宫颈癌细胞,导致细胞死亡;间接调控肿瘤内部微环境,抑制残存肿瘤细胞VEGF﹑MMP-9的分泌。二者协同在宫颈癌治疗及提高宫颈癌患者远期生存率上具有很好的临床应用前景。但是由于目前的研究仅处于初步阶段,因此psPEF对宫颈癌的具体作用机制仍有待进一步完善。
[1] Torre LA, Bray F, Siegel RL, et al. Global cancer statistics[J]. CA Cancer J Clin, 2012, 65(2): 87-108.
[2] Eskander RN, Tewari KS. Targeting angiogenesis in advanced cervical cancer[J]. Ther Adv Med Oncol, 2014, 6(6): 280-292.
[3] Ma J, Waxman DJ. Combination of antiangiogenesis with chemotherapy for more effective cancer treatment[J]. Mol Cancer Ther, 2008, 7(12): 3670-3684.
[4] Ackermann M, Carvajal IM, Morse BA, et al. Adnectin CT-322 inhibits tumor growth and affects microvascular architecture and function in Colo205 tumor xenografts[J]. Int J Oncol, 2011,38(1): 71-80.
[5] Verheul HM, Pinedo HM. Possible molecular mechanisms involved in the toxicity of angiogenesis inhibition[J]. Nat Rev Cancer, 2007, 7(6): 475-485.
[6] Speiser D, Mangler M, Köhler C, et al. Fertility outcome after radical vaginal trachelectomy: a prospective study of 212 patients[J]. Int J Gynecol Cancer, 2011, 21(9): 1635-1639.
[7] Lloyd PA, Briggs EV, Kane N, et al. Women's experiences after a radical vaginal trachelectomy for early stage cervical cancer. A descriptive phenomenological study[J]. Eur J Oncol Nurs, 2014,18(4): 362-366.
[8] Liu XJ, Hou B, Song XJ, et al. The efficacy of Endostar combined with co-chemoradiotherapy for stage Ⅲ bulky cervical cancer[J]. J Logist Univ PAPF (Med Sci), 2013, 22(3): 178-181.[刘兴京, 侯兵, 宋晓军, 等. 恩度联合同步放化疗治疗Ⅲ期巨块型宫颈癌的临床疗效观察[J]. 武警后勤学院学报(医学版), 2013, 22(3): 178-181.]
[9] Liu HL, Lu CS, Ding BJ, et al. Photodynamic effect of new photodynamic therapy combined with nucleolin silenceon cervical cancer cell line SiHa[J]. J Jilin Univ (Med Ed), 2014,40(4): 748-752, 915. [刘洪丽, 吕昌帅, 丁佰娟, 等. 新型光动力学疗法联合核仁素沉默对宫颈癌SiHa细胞的光动力学效应[J]. 吉林大学学报(医学版), 2014, 40(4): 748-752, 915.]
[10] Wang J, Zhang YZ, Feng JB, et al. Inhibitive effects of lenti virus-mediated hTERT RNA interference and TMPyP4-PDT on cervix cancer SiHa cells[J]. J Shandong Univ (Health Sci),2015, 53(1): 27-33. [王颉, 张友忠, 冯进波, 等. 慢病毒介导的hTERT-shRNA联合光动力治疗对宫颈癌细胞SiHa的影响[J]. 山东大学学报(医学版), 2015, 53(1): 27-33.]
[11] Cemazar M, Parkins CS, Holder AL, et al. Electroporation of human microvascular endothelial cells: evidence for an antivascular mechanism of electrochemotherapy[J]. Br J Cancer,2001, 84(4): 565-570.
[12] Nuccitelli R, Chen X, Pakhomov AG, et al. A new pulsed electric field therapy for melanoma disrupts the tumor's blood supply and causes complete remission without recurrence[J]. Int J Cancer, 2009, 125(2): 438-445.
[13] Chen X, Chen X, Swanson RJ, et al. Histopathological follow-up by tissue micro-array in a survival study after melanoma treated by nanosecond pulsed electric fields (nsPEF)[J]. J Dermatolog Treat, 2011, 22(3): 153-161.
[14] Chen X, Zhuang J, Kolb JF, et al. Long term survival of mice with hepatocellular carcinoma after pulse power ablation with nanosecond pulsed electric fields[J]. Technol Cancer Res Treat,2012, 11(1): 83-93.
[15] Jia J, Xiong ZA, Qin Q, et al. Picosecond pulsed electric fields induce apoptosis in a cervical cancer xenograft[J]. Mol Med Rep, 2015, 11(3): 1623-1628.
[16] Hua YY, Xiong ZA, Zhang Y, et al. Growth and apoptosis of HeLa cells induced by intense picosecond pulsed electric field[J]. Med J Chin PLA, 2011, 36(7): 711-713. [华媛媛, 熊正爱, 张玉, 等.高强度皮秒脉冲电场对人宫颈癌HeLa细胞的生长抑制及凋亡诱导作用[J]. 解放军医学杂志, 2011, 36(7): 711-713.]
[17] Leber MF, Efferth T. Molecular principles of cancer invasion and metastasis (review)[J]. Int J Oncol, 2009, 34(4): 881-895.
[18] Roomi MW, Kalinovsky T, Cha J, et al. Effects of a nutrient mixture on immunohistochemical localization of cancer markers in human cervical cancer HeLa cell tumor xenografts in female nude mice[J]. Exp Ther Med, 2015, 9(2): 294-302.
[19] Nagy VM, Buiga R, Brie I, et al. Expression of VEGF, VEGFR,EGFR, COX-2 and MVD in cervical carcinoma, in relation with the response to radio-chemotherapy[J]. Rom J Morphol Embryol, 2011, 52(1): 53-59.
[20] Qin Q, Xiong ZA, Jia J. In vivo effects of picosecond pulse electric field on nude rat model of cervical cancer[J]. J Third Mil Univ, 2014, 36(23): 2372-2376. [秦琴, 熊正爱, 贾佳. 皮秒脉冲电场治疗宫颈癌动物模型的体内效应研究[J]. 第三军医大学学报, 2014, 36(23): 2372-2376.]

