EGFR基因状态与晚期非小细胞肺癌患者一线化疗疗效的关系
秦娜 张权 王敬慧 张卉 顾艳斐 杨新杰 李曦 吕嘉林 吴羽华 农靖颖 张新勇 张树才
肺癌发病率和死亡率均居我国恶性肿瘤第一位。2012中国肺癌登记年报统计,我国男性和女性肺癌分别占全部恶性肿瘤发病率的22.14%和14.36%,而死亡率则分别占27.21%和21.91%,30年来死亡率增加了464.84%[1]。非小细胞肺癌(non-small cell lung cancer,NSCLC)约占全部肺癌的80%-85%,5年生存率不到15%[2]。多数患者就诊时已属于局部晚期或发生远处转移。多项研究证实表皮生长因子受体(epidermal growth factor receptor,EGFR)基因状态是表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitor, EGFR-TKI)疗效的预测因子[3,4]。此外,化疗仍然是晚期NSCLC的传统治疗,目前对于EGFR基因状态与化疗疗效之间的关系尚未十分明确。
IPASS研究亚组分析中,EGFR突变患者的化疗的客观缓解率优于野生型患者(47.3%vs23.5%)[3],而Park等[5]研究发现,EGFR突变患者一线化疗的有效率与野生型患者无差异(34.1%vs35.0%)。因此我们拟通过回顾性分析181例EGFR基因状态已知的IIIb期/IV期的NSCLC一线接受化疗的疗效及无疾病进展生存期(progression-free survival, PFS),探讨EGFR基因状态对晚期NSCLC化疗的预测意义。
1 资料与方法
1.1 入排标准 入选标准:①2006年-2013年在首都医科大学附属北京胸科医院经组织病理学证实的IIIb期/IV期的NSCLC患者[根据美国癌症联合委员会(American Joint Committee on Cancer, AJCC)肺癌分期标准(第7版)];年龄18岁-75岁;美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)制定的体力状况评分(performance status, PS)≤2分;②所有患者均进行了治疗前组织标本的EGFR基因检测;③患者未接受过全身抗肿瘤治疗;④至少有一个可测量病灶,根据实体瘤的疗效评价标准(Response Evaluation Riteria in Solid Tumors, RECIST)1.1定义的可测量病灶为靶病灶。排除标准:临床资料不完整;既往接受过全身抗肿瘤治疗;合并其他部位肿瘤者。不吸烟定义为一生中吸烟<100支[6]。
1.2 病历资料及疗效评价
1.2.1 治疗方案 含长春瑞滨、吉西他滨、紫杉醇、多西他赛、培美曲赛在内的含铂或单药的化疗方案。长春瑞滨25 mg/m2,d1,d8,每21天1次:或吉西他滨l.0 g/m2-1.25 g/m2,d1,d8,每21天1次;或紫杉醇175 mg/m2,d1,每21天1次;或多西他赛75 mg/m2,d1,每21天1次;或培美曲赛500 mg/m2,d1,每21天1次;联合或不联合顺铂75 mg/m2,d1,每21天1次;或卡铂曲线下面积(area under the curve, AUC)=5,d1,每21天1次;或奈达铂 75 mg/m2,d1,每21天1次。
1.2.2 疗效评价 患者每2周期行疗效评价,按照RECIST 1.1评价疗效:完全缓解(complete response, CR)、部分缓解(partial response, PR)、稳定(stable disease, SD)、进展(progression disease,PD)。(CR+PR)/总人数×100%为客观缓解率(objective response rate, ORR),(CR+PR+SD)/总人数×100%为疾病控制率(disease control rate, DCR)。无疾病进展生存期(progression-free survival, PFS)定义为从首次用药时间到疾病进展或任何原因引起死亡的时间。在数据截止时尚未进展或死亡的患者将以最后一次肿瘤评价的日期计算。
1.3 统计学方法 采用SPSS 16.0统计软件进行统计分析。EGFR基因状态、临床特征与化疗疗效之间的关系采用χ2或Fisher's检验。PFS采用Kaplan-Meier生存曲线进行分析,Log-rank检验组间差异。Cox回归进行PFS的多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 临床资料 自2006年1月-2013年12月,共181例晚期NSCLC患者符合研究标准,一般临床料。见表1。中位年龄为56岁(范围21岁-75岁),男性103例(56.9%),女性78例(43.1%);腺癌154例(85.1%),鳞癌27例(14.9%);IV期152例(84.0%),IIIb期29例(16.0%);不吸烟92例(50.8%),吸烟患者89例(49.2%);PS 0-1分177例(97.8%),4例患者PS评分2分(2.2%)。171例(94.5%)患者接受含铂方案的化疗,其中含紫杉醇的铂二联方案的患者55例(30.4%),含长春瑞滨的铂二联方案的患者16例(8.8%),含吉西他滨的铂二联方案的患者36例(19.9%),含多西他赛的铂二联方案的患者31例(17.1%),含培美曲赛的铂二联方案的患者33例(18.2%)。因年龄、脏器功能及PS评分等原因10例(5.5%)患者接受非铂类的一线单药化疗。
2.2EGFR基因突变 所有患者均接受EGFR基因状态的检测,检测方法包括液相芯片法和蝎形探针扩增阻滞突变系统(amplification refractory mutation system, ARMS)方法。其中EGFR基因突变75例(41.4%),野生型106例(58.6%)。在女性、腺癌、不吸烟患者中EGFR基因突变率高,而与年龄、PS评分、临床分期无关。75例EGFR基因突变患者中,18外显子突变1例(0.6%),19外显子缺失突变37例(20.4%),21外显子L858R突变33例(18.2%)。另有4例患者存在两种突变,1例患者为外显子20 S768I合并21外显子L858R突变,1例患者为21外显子L858R突变合并T790M突变,1例患者为19外显子缺失突变合并21外显子L858R突变,1例患者为21外显子L858R突变合并18外显子突变。
2.3EGFR基因突变状态与化疗疗效
2.3.1EGFR基因突变状态与ORR和DCR之间的关系 181例患者均可评价疗效。其中CR 1例,PR 46例,SD 80例,PD 54例,ORR为26.0%,DCR为70.2%。男性患者的ORR较女性患者高(32.0%vs17.9%,P=0.032),ORR与年龄、病理类型、临床分期、吸烟状态、PS评分、EGFR基因状态及是否铂二联化疗无关。EGFR突变型患者的ORR与EGFR野生型患者分别为(32.0%vs21.7%,P=0.119),但差异无统计学意义。突变患者的DCR高于野生型患者(84.0%vs60.4%,P=0.001),DCR与EGFR基因状态有关,而与性别、年龄、病理类型、临床分期、吸烟状态、PS评分及是否铂二联化疗无关(表2)。
2.3.2EGFR19、21外显子敏感突变与野生型患者的化疗疗效 对仅为EGFR19外显子缺失突变,EGFR21外显子L858R突变,EGFR野生型的患者进行统计分析。共有173例患者,其中EGFR19外显子缺失突变36例,EGFR21外显子L858R突变33例,EGFR野生型患者104例。EGFR19外显子缺失突变患者一线化疗的ORR(38.9%vs22.1%,P=0.049)、DCR(88.9%vs60.6%,P=0.002)均高于EGFR野生型组患者,可见统计学差异。EGFR21外显子L858R突变患者一线化疗的DCR高于EGFR野生型患者(84.8%vs60.6%,P=0.010)。而ORR较EGFR野生型患者无统计学差异(30.3%vs22.1%,P=0.338)。EGFR19外显子缺失突变患者与EGFR21外显子L858R突变患者的ORR及DCR均无统计学差异(38.9%vs30.0%,P=0.889; 88.9%vs84.8%,P=0.454)。
2.3.3 不同EGFR状态下化疗药物的疗效比较EGFR突变型及野生型患者接受含紫杉醇方案化疗为58例,突变组与野生组患者化疗的ORR(9/25, 36.0%; 9/33, 27.3%;P=0.477)及DCR(18/25, 72.0%; 23/33, 69.7%;P=0.849)差异无统计学意义。接受含长春瑞滨方案化疗为16例,两组患者化疗的ORR(2/6, 33.3%; 2/10, 20.0%;P=0.604)差异无统计学意义,突变组DCR高于野生组(6/6, 100.0%;4/10, 40.0%;P=0.034)。接受含培美曲塞化疗为35例,两组患者化疗的ORR(5/12, 41.7%; 6/23, 26.1%;P=0.451)及DCR(10/12, 83.3%; 15/23, 65.2%;P=0.434)差异无统计学意义。接受含多西他赛方案化疗为36例,两组化疗的ORR(5/13, 38.5%; 3/23, 13.0%;P=0.107)无统计学差异,突变组DCR高于野生组(11/13, 84.6%; 11/23, 47.8%;P=0.039)。接受含吉西他滨方案化疗为36例,两组人群化疗的ORR(3/19, 15.8%; 3/17, 17.6%;P>0.999)无统计学差异,突变组DCR高于野生组(18/19, 94.7%; 11/17,64.7%;P=0.037)。
2.4 EGFR状态与无进展生存时间的关系 截至2014年4月1日,181例患者中163例患者出现疾病进展,5例患者仍在随访中,13例患者失访。168例患者中位PFS为4.3个月,其中腺癌患者PFS较鳞癌患者有所延长(4.7个月vs3.0个月,P=0.036)(图1);EGFR突变患者PFS较EGFR野生型患者延长(6.3个月vs3.0个月,P=0.002)(图2);PS评分0-1分患者PFS较PS评分2分患者延长(4.4个月vs0.7个月,P=0.016)(图3)。而性别、年龄、临床分期、是否铂二联化疗对PFS的影响无统计学意义。Cox多因素分析显示,EGFR突变是影响PFS的独立因素(HR=0.654, 95%CI:0.470-0.909,P=0.012)(表3)。
3 讨论
随着分子靶向药物的不断出现及分子分型的普遍开展,靶向治疗为部分晚期NSCLC患者带来明显的疗效,但化疗仍是晚期NSCLC患者的一线标准治疗方案之一。EGFR突变是EGFR-TKIs疗效最强的预测因素,但EGFR突变状态对化疗疗效的影响结果仍存争议。Gandara等[7]研究发现NSCLC患者EGFR基因突变与核苷酸切除修复交叉互补基因1(excison repair cross complementation group 1,ERCC1)表达水平相关,EGFR基因突变型患者ERCC1低表达。而ERCC1低表达者可能会从以铂类为基础的化疗中获益[8]。田玉旺等[9]研究也同样发现NSCLC患者中EGFR基因野生型与ERCC1高表达有关,EGFR基因突变型患者ERCC1低表达者多。由此该研究者推测ERCC1低表达的癌细胞DNA损伤修复能力低,因此EGFR基因更易出现突变,对以铂类为基础的化疗敏感。但也有临床研究提示EGFR突变会降低多西他赛的敏感性[10]。
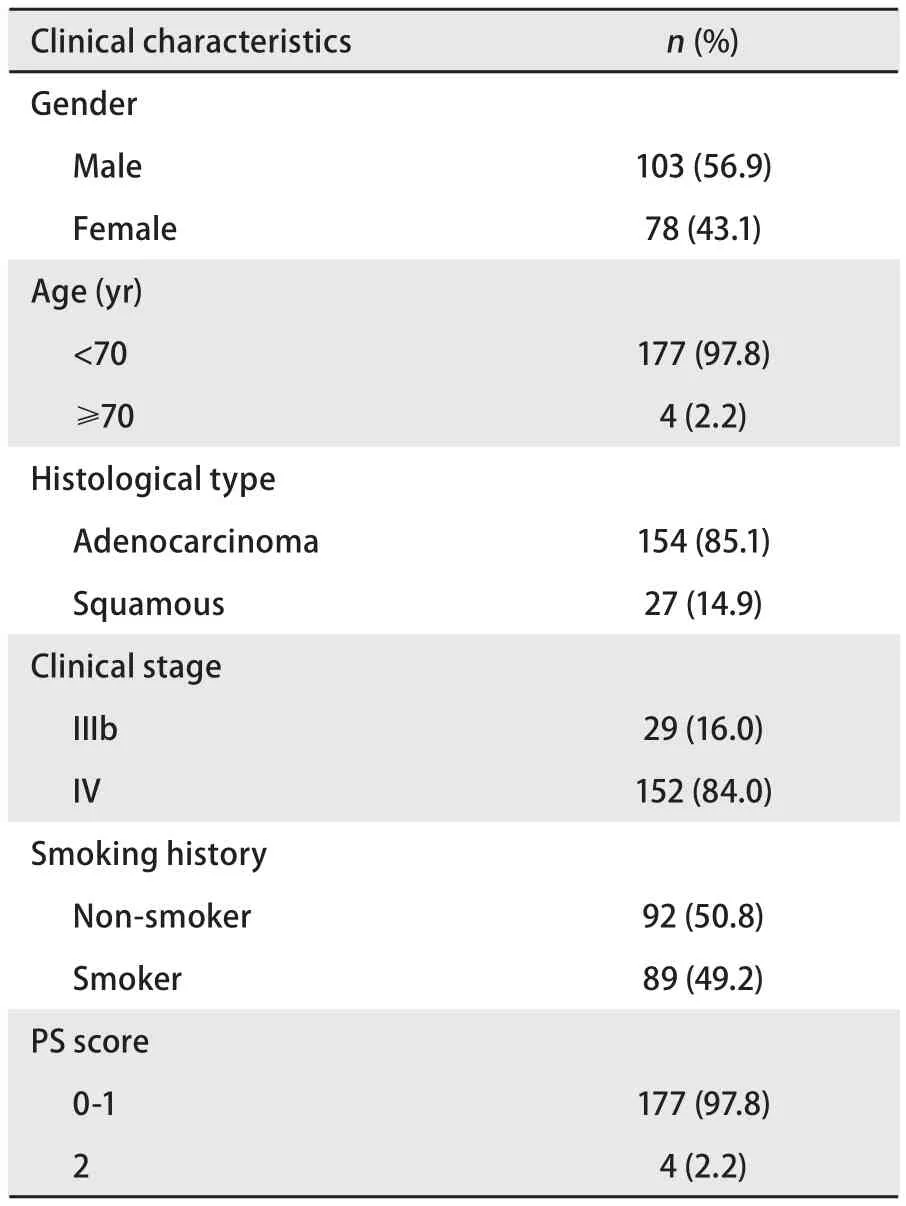
表1 181例NSCLC患者一般资料Tab 1 Clinical characteristics of 181 patients with NSCLC
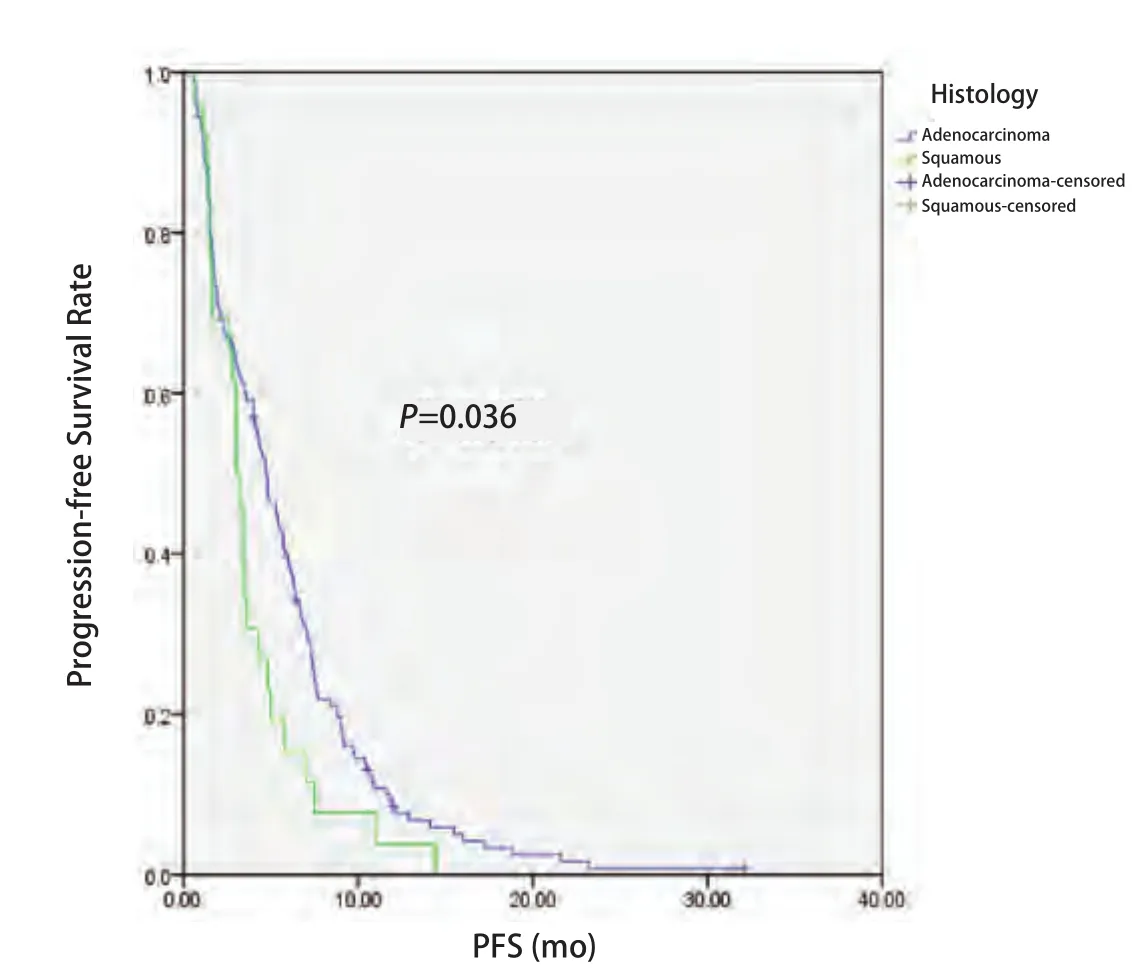
图1 不同病理类型NSCLC患者接受一线化疗的PFSFig 1 Progression-free survival (PFS) of patients with NSCLC according to histology
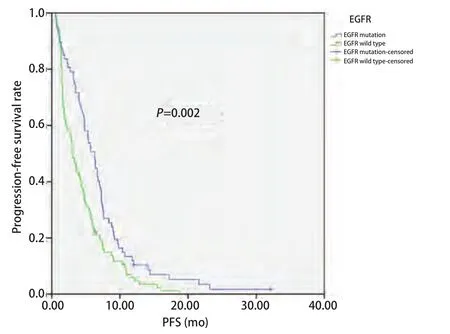
图2 EGFR突变与野生型NSCLC患者接受一线化疗的PFSFig 2 PFS of patients with NSCLC according to EGFR mutation status.EGFR: epidermal growth factor receptor.
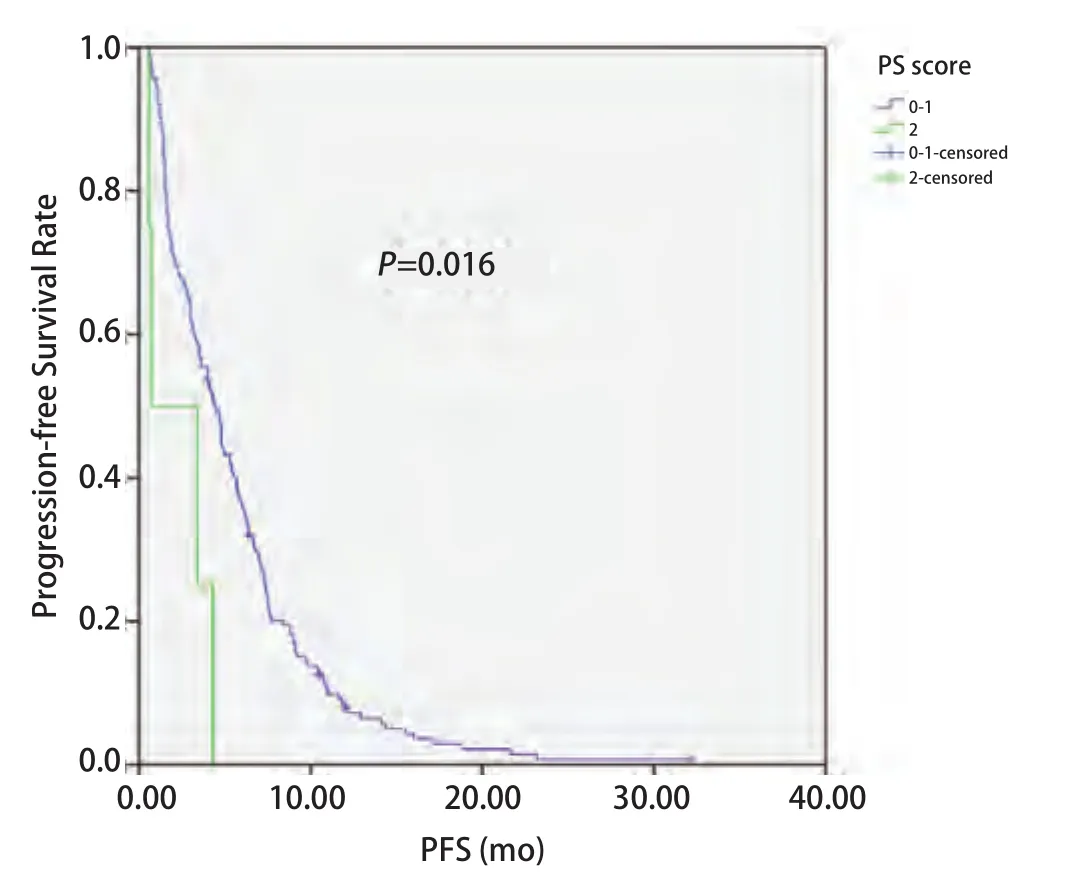
图3 不同PS评分NSCLC患者一线化疗的PFSFig 3 PFS of patients with NSCLC according to PS score
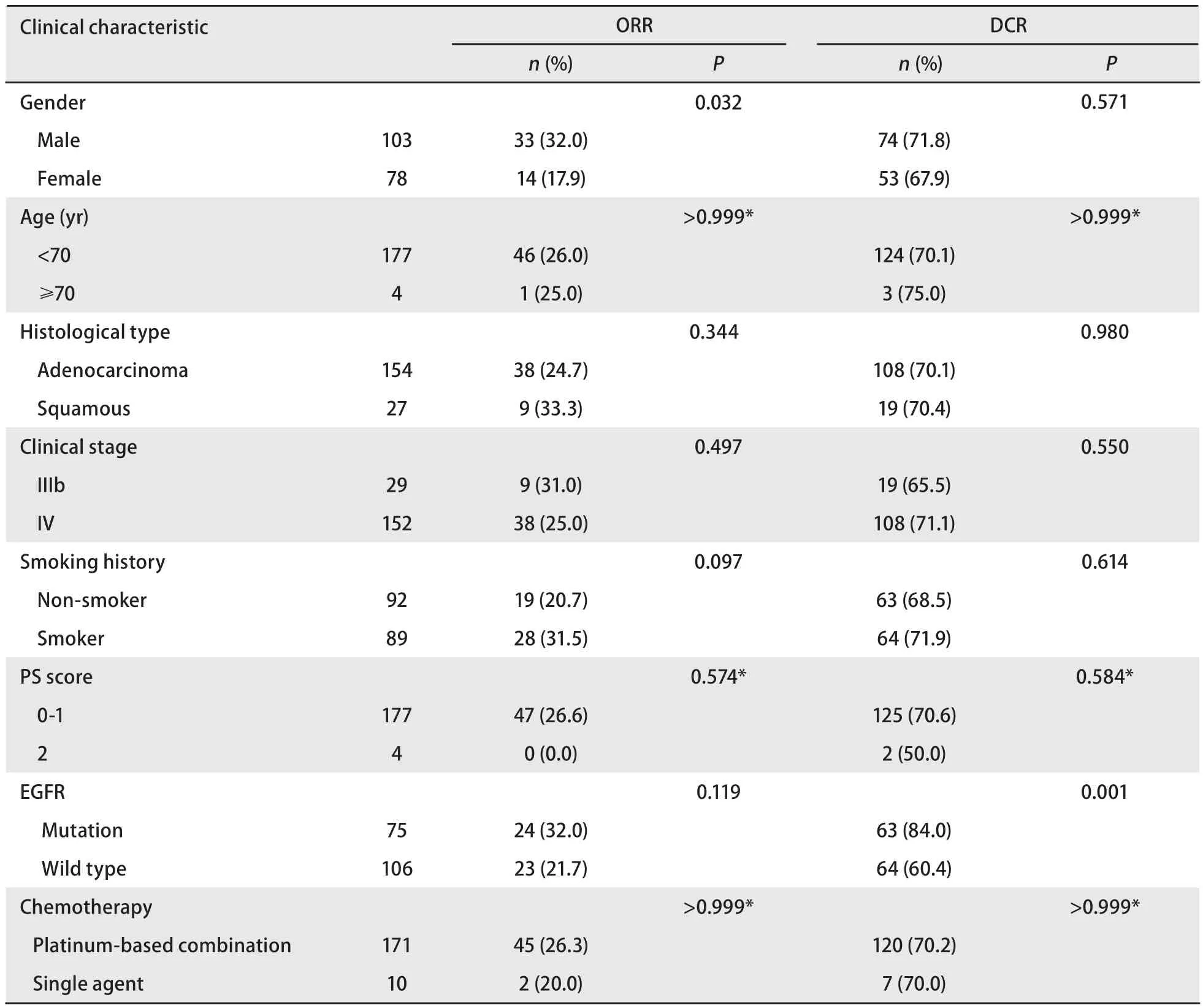
表2 NSCLC患者化疗ORR、DCR与其临床特征的关系Tab 2 Relationship between ORR, DCR to chemotherapy and clinical characteristics in patients with NSCLC
我们对181例EGFR状态明确的晚期NSCLC患者一线化疗疗效进行回顾性分析,探讨EGFR状态与化疗疗效的关系。结果显示,EGFR突变患者的DCR高于EGFR野生型患者。19外显子缺失突变患者化疗的ORR、DCR均高于EGFR野生型患者,21外显子L858R突变患者的DCR高于EGFR野生型患者。Cox多因素分析显示,EGFR突变是影响PFS的独立因素。
IPASS研究亚组分析中,EGFR突变患者的化疗的ORR优于野生型患者(47.3%vs23.5%)[3],Kalikaki等[11]报道的162例NSCLC患者中EGFR突变组一线接受化疗的有效率明显高于野生型患者(55.6%vs21.8%,P=0.023),多因素结果分析显示EGFR基因突变是预测化疗疗效的独立因素。Shu等[12]报道的266例NSCLC患者,在KRAS阴性的EGFR突变组一线接受化疗的有效率高于野生型患者(46.2%vs20.8%,P=0.043)。本研究显示EGFR突变组患者一线接受化疗的ORR与EGFR野生型组的患者无差异(32.0%vs21.7%,P=0.119)。分析可能的原因是样本量不是很大,化疗方案未全部统一,其中有10例患者接受了单药化疗。本研究结果提示两组人群在疾病控制率方面具有差异,EGFR突变组和野生型组的DCR为(84.0%vs60.4%,P=0.001),差异有统计学意义,与尹延涛等[13]的研究结果一致。但一项回顾性研究[14]结果显示,140例EGFR基因状态明确的NSCLC患者一线接受吉西他滨或长春瑞滨联合顺铂或卡铂化疗,EGFR基因突变患者与EGFR野生型患者的疾病控制率分别为(74.0%vs82.2%,P=0.250),无统计学差异。
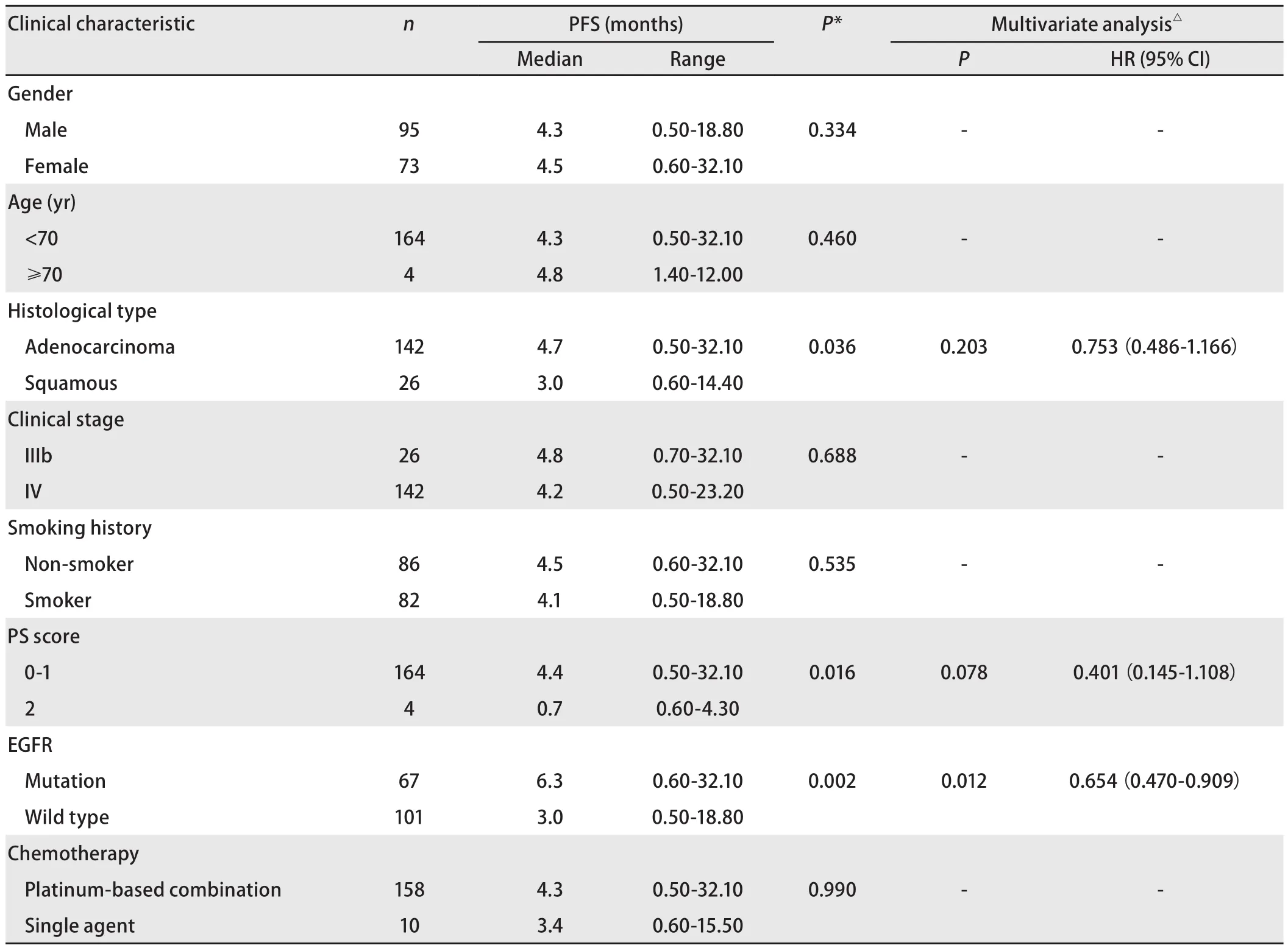
表3 168例NSCLC患者PFS的单因素及多因素分析Tab 3 Univariate and multivariate analysis of PFS in 168 patients with NSCLC
亚组分析结果显示EGFR19外显子缺失突变的患者一线接受化疗的ORR及DCR均高于EGFR野生型组患者,P值分别为0.049、0.002,均有统计学差异。EGFR21外显子L858R突变患者一线化疗的DCR高于EGFR野生型患者,P值为0.010,有统计学差异。EGFR19外显子缺失突变患者与EGFR21外显子L858R突变患者的ORR及DCR均无统计学差异。既往对于EGFR不同突变类型与化疗疗效的研究较少,Shu等[12]的研究结果显示,EGFR19外显子缺失突变患者一线化疗的ORR高于EGFR21外显子突变的患者(37.5%vs24.0%,P=0.124)。Cappuzzo等[15]的研究结果显示EGFR19外显子缺失突变患者一线接受化疗的ORR优于EGFR其他突变类型(46.6%vs0.0%,P=0.02),但仅24例,样本量较小,有待大样本的研究进一步证实。
本研究168例患者的中位PFS为4.3个月。单因素分析显示腺癌、PS评分0-1分、EGFR基因突变的患者中位PFS更佳,而性别、年龄、临床分期、是否铂二联化疗对PFS的影响无统计学意义。其中EGFR突变患者的PFS达6.3个月,长于EGFR野生型患者的3.0个月,差异有统计学意义(P=0.002)。Eberhard等[16]研究结果显示EGFR基因突变患者在化疗的ORR及PFS均优于野生型患者(38.0%vs23.0%,P=0.01;8.0个月vs5.0个月,P<0.001)。多因素分析显示EGFR突变是PFS的独立影响因素,与其他的研究[12,17]结果一致。而2014年发表的一项的meta分析提示晚期NSCLC患者EGFR基因突变可能与更高的化疗客观缓解率有关,并没有带来PFS及OS的获益[18]。本研究正在对后续治疗及OS进行统计分析以探讨EGFR对晚期NSCLC患者预后的影响。
本研究的不足:本研究为一项回顾性分析,纳入的患者存在选择偏倚,样本量不是很大,EGFR基因检测方法及化疗的方案未能统一,这些均有可能对研究的结果产生影响。
本文对181例晚期NSCLC患者一线化疗疗效与EGFR状态的关系进行分析,结果显示EGFR突变患者的DCR显著高于EGFR野生型患者,EGFR突变是影响晚期NSCLC患者一线化疗PFS的独立因素,EGFR突变对晚期NSCLC患者一线化疗的PFS具有预测价值,有待于设计良好的前瞻性临床试验进一步明确EGFR突变与化疗疗效的关系。

