热水浸提法同步提取藤茶中二氢杨梅素和多糖的工艺研究
熊伟,王慧宾,李雄辉,胡居吾,付建平(江西省科学院应用化学研究所,江西南昌 330029)
热水浸提法同步提取藤茶中二氢杨梅素和多糖的工艺研究
熊伟,王慧宾,李雄辉,胡居吾,付建平
(江西省科学院应用化学研究所,江西南昌 330029)
采用热水浸提法,对藤茶中的二氢杨梅素和多糖进行同步提取,通过单因素实验,得到了较佳工艺参数:提取温度90℃,提取时间120m in,料液比1∶20,原料粒度100目,在此条件下,二氢杨梅素得率为21.86%,多糖的得率为5.74%。
二氢杨梅素;多糖;藤茶;提取
藤茶,系葡萄科蛇葡萄属中的一种野生藤本植物,其味甘淡、性凉,夏天泡茶多日不馊,有神茶之称。近代医学研究表明,藤茶及其提取物具有抑菌、降血脂、降血压、抗氧化、降血糖、保肝护肝以及减轻乙醇中毒等功效[1-5]。藤茶的主要活性成分有二氢杨梅素、杨梅素、藤茶多糖等[6-8]。目前,国内外的研究报道以单独提取分离二氢杨梅素居多,而关于多种活性成分的同步提取分离则极少。本研究采用热水浸提法,同步提取藤茶中的二氢杨梅素和多糖,简化了实验流程,提高了原料利用率,实现了资源的综合利用。
1 材料与方法
1.1 主要材料与试剂
藤茶:采自江西抚州黎川,60℃干燥24h备用;二氢杨梅素对照品:中国药品生物制品检定所;甲醇、磷酸(色谱纯),Sigma公司;浓硫酸、苯酚等(分析纯),天津永大化学试剂厂。
1.2 主要仪器与设备
Agilent1100型高效液相色谱仪(美国安捷伦公司);高速万能粉碎机(天津市泰斯特仪器有限公司);RE52CS旋转蒸发仪(上海亚荣生化科技有限公司);JM-10002天平(余姚市纪铭称重校验设备公司)。
1.3 实验方法
1.3.1 二氢杨梅素和多糖的同步提取工艺
准确称取200g藤茶干叶后,粉碎至60目过筛,选取不同的提取温度分别为50、60、70、80、90℃和100℃,按照1∶20的料液比添加水,提取60min后,趁热过滤,冷却后静置24h,过滤,滤渣干燥称重,检测二氢杨梅素含量,计算二氢杨梅素的得率;滤液采用苯酚-硫酸法检测多糖含量,计算多糖的得率。根据提取温度对二者得率的影响,确定适宜的提取温度。
在确定提取温度的基础上,选取不同的提取时间分别为30、60、90、120、150、180min,提取方法同上,通过测定二氢杨梅素和多糖的得率,确定适宜的提取时间。
在确定提取温度和提取时间的基础上,选取不同的料液比分别为1∶5、1∶10、1∶20、1∶30、1∶40和1∶50,提取方法同上,通过测定二氢杨梅素和多糖的得率,适宜的料液比。
在确定提取温度、提取时间、料液比的基础上,选取不同的原料粒度分别为40、60、80、100、120目和140目,提取方法同上,通过测定二氢杨梅素和多糖的得率,确定适宜的原料粒度。
1.3.2 二氢杨梅素和多糖的检测方法
二氢杨梅素的含量采用HPLC法检测[9]。多糖的含量采用苯酚-硫酸法检测[10]。
2 结果与讨论
2.1 提取温度对二氢杨梅素和多糖得率的影响
从图1可知,二氢杨梅素和多糖的得率随着提取温度的升高而逐渐增大。在50~70℃,二氢杨梅素得率增长较为缓慢;而当温度上升到70℃以后,二氢杨梅素的得率显著增长,并在100℃时达到最大值。这可能是由于100℃为溶剂的沸点,在沸点状态下提取,体系为气液共存状态,使溶液分子剧烈碰撞,有利于原料中二氢杨梅素的充分溶出,使得率显著提高;而多糖的得率随着温度升高,得率的增加较为均匀。充分考虑到温度的可操作性和安全性,提取温度取90℃为宜。

图1 提取温度对二氢杨梅素和多糖得率的影响
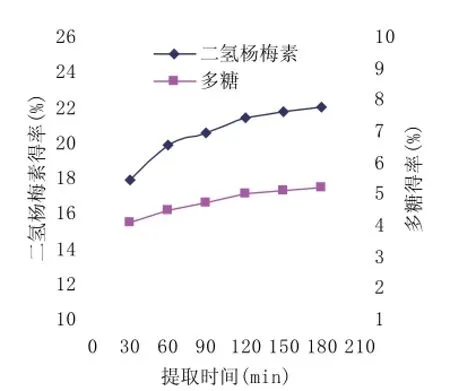
图2 提取时间对二氢杨梅素和多糖得率的影响
2.2 提取时间对二氢杨梅素和多糖得率的影响
从图2可知,二氢杨梅素和多糖得率随着提取时间的延长而表现出逐渐增大的趋势。但当提取时间增加到120min后,二氢杨梅素和多糖得率变化较小,说明此时二氢杨梅素和多糖已基本溶出,再延长提取时间对多糖得率影响并不大,综合考虑能耗等因素,提取时间应取120min左右为宜。
2.3 料液比对二氢杨梅素和多糖得率的影响
从图3可知,随着料液比的增加,二氢杨梅素和多糖得率也随之增大。但当料液比增加到1∶20后,二氢杨梅素和多糖得率变化较小,考虑到料液比的增加,可能会增加杂质的溶出,加大后绪纯化工艺的难度。因此,料液比应取1∶20左右为宜。

图3 料液比对二氢杨梅素和多糖得率得率的影响
2.4 原料粒度对二氢杨梅素和多糖得率的影响
从图4可知,二氢杨梅素和多糖得率随着原料粒度的变化而表现出先增后减的趋势。物料的粒度对得率具有双重影响:一方面,目数增加,颗粒直径变小,与溶剂接触面积增大,使得浸出速度加快;但另一方面,目数增加,颗粒直径变小,导致粉体表面积过大,相互间吸附作用增强,反而影响扩散速度,并不利于浸出。因此,物料粒度取100目左右为宜。

图4 原料粒度对二氢杨梅素和多糖得率的影响
3 结论
3.1 本研究采用热水浸提法
对藤茶中的二氢杨梅素和多糖进行同步提取,通过单因素实验,得到了较佳工艺参数:提取温度90℃,提取时间120min,料液比1∶20,原料粒度100目,经单级提取,其二氢杨梅素得率为21.86%,多糖的得率为5.74%。
3.2 本研究中使用的溶剂主要是水
具有成本低,操作简单、节省试剂、污染小等特点,符合当今绿色化学发展趋势,适合于二氢杨梅素和多糖提取的工业化生产。
[1] 潘利华, 夏云梯. 绿色食品新资源—藤茶[J]. 粮食与食品工业,2001,(2):30-31.
[2] 莫国艳. 藤茶药理作用研究进展[J]. 广西中医学院学报,2003,6(4):66-67.
[3] 刘翠娥, 王海玉, 王亚东,等. 藤茶辅助降血脂作用的研究[J]. 食品科学,2005, 26(11):231-240.
[4] Matsumoto T,Tahara S. Ampelopsin,a major antifungal constitutent from Salix sachalinensis,and its methyl ethers [J]. Nippon nogeikagaku kaishi-journal of the japan society for bioscience biotechnology and agrochemistry, 2001,75(6):659-667.
[5] Oshima Y ,Ueno y..Ampelopsins D, F ,H and cis-ampelopsin E, oligostil benes form Ampelopsis brevipedunculata var hancei roots [J]. Phytochemistry(oxford), 1993, 33(1): 179.
[6] 罗祖友, 付晓芳, 吴谋成. 藤茶的研究进展[J]. 食品科学, 2005,26(8):513-516.
[7] 袁阿兴, 黄筱美, 陈劲. 显齿蛇葡萄化学成分的研究[J]. 中国中药杂志,1998,23(6):359.
[8] 何桂霞, 裴刚, 周天达,等. 瑶族藤茶中杨梅素的分离与结构鉴定[J]. 中国民族医药杂志,2000, 6(1):40-41.
[9] 何桂霞, 裴刚, 杨伟丽,等. HPLC测定藤茶不同采收时期及不同部位的二氢杨梅素含量[J]. 中成药,2004,26(3):210-212.
[10] 李如亮. 生物化学实验[M]. 武汉大学出版社, 1998.
Study on Synchronous Extraction of Dihydromyricetin and Polysaccharide from Ampelopsis Grossedentata by Hot Water Method
XIONG Wei, WANG Hui-bin, LI Xiong-hui, HU Ju-wu, FU Jian-ping
(Institute of Applied Chemistry,Jiangxi Academy of Sciences,Jiangxi Nanchang 330029 PRC)
The synchronous extraction of dihydromyricetin and polysaccharide from Ampelopsis grossedentata was used hot water method .The optimum conditions was determined by the one-factor tests : the extraction temperature was 90 ℃, the extraction time was 120 min, the ratio of material to water was 1∶20, the granularity of material was 100 sieve, under the optimum conditions, the extraction rate of dihydromyricetin was 21.86% , the extraction rate of polysaccharide was 5.74% respectively.
Hydromyricetin; Polysaccharide; Ampelopsis grossedentata; Extraction
TQ91
A
2096-0387(2015)01-0005-02
国家自然科学基金项目(31260400),江西省自然科学基金项目(20122BAB214003),江西省科技支撑计划项目(20132BBG70045)。
熊伟(1982-),男,副研究员,硕士研究生,研究方向:天然产物提取分离与分子修饰。

