穴位局部TLR4在针刺后穴位局部炎症反应中作用的初步研究*
席 强,崔 瑞,金 光,郭永明
·实验研究·
穴位局部TLR4在针刺后穴位局部炎症反应中作用的初步研究*
席强,崔瑞,金光,郭永明
(天津中医药大学实验针灸研究中心,天津300193)
[目的]探讨穴位局部TOLL样受体4(TLR4)在针刺后穴位局部炎症反应中的作用。[方法]将80只健康大鼠随机分为针刺组和空白对照组,每组各40只。每组的40只大鼠再随机分8个时点(即刻、15m in、30min、1 h、2 h、4 h、8 h、24 h),每个时点5只。采用ELISA法检测各时间点穴区皮肤肌肉组织中TLR4、高迁移率族蛋白(HMGB1)、白介素-1β(IL-1β)、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)的浓度。[结果]空白对照组,各指标浓度在各时间点均无明显变化;针刺组针刺后TLR4、HMGB1、IL-6、TNF-α浓度升高,而IL-1β浓度无明显变化。对每只大鼠穴位局部TLR4与其他指标浓度的相关性进行分析发现,针刺后HMGB1、TNF-α与TLR4的相关性增强,IL-6与TLR4的相关性减弱,IL-1β与TLR4的相关性针刺前后则无明显变化。[结论]穴位局部TLR4介导的通路可能是针刺后穴位局部炎症反应产生的通路之一。
针刺;穴位;TOLL样受体4;炎症反应
针刺作为一种物理刺激,其在针刺穴位局部必然引起损伤[1],由此引发的神经、内分泌、免疫互联反应是针刺效应启动的关键节点,因此围绕针刺局部展开一些基础研究对于揭示针刺作用规律及特点是至关重要的[2]。高迁移率族蛋白1(HMGB1)是一种重要的损伤相关模式(DAMP)分子,组织损伤时HMGB1可由坏死的细胞被动释放和(或)激活的免疫细胞主动分泌至细胞外,作为内源性危险信号参与全身或局部的炎症反应。TOLL样受体4(TLR4)是跨膜信号传导受体,在人类所有细胞中表达,不仅可识别外源性病原相关分子模式,还可识别DAMP,与其配体结合后介导的核转录因子(NF-κB)通路是机体内重要的炎症反应通路之一。前期研究发现针刺引起的局部炎症反应是针效产生的始动环节之一[3]。因此,本研究对针刺后穴位局部HMGB1、TLR4及相关炎性因子白介素-1β(IL-1β)、白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)的浓度变化进行研究,以期为穴位局部TLR4可能参与针刺后穴位局部炎症反应提供实验依据。
1 材料与方法
1.1实验动物及分组选用SPF级健康成年Wistar大鼠80只,雌雄不拘,体质量(200±20)g,由中国人民解放军军事医学科学院卫生学环境医学研究所动物实验中心提供,许可证编号:SCXK-(军)2009-003,实验过程中对动物的处置符合相关动物伦理学要求。按随机数字表将大鼠分为空白对照组和针刺组,每组按照干预后取材时间点的不同,随机分为8个时点,分别为干预后即刻、15 min、30 min、1 h、2 h、4 h、8 h、24 h组,每个时点5只。
1.2实验材料酶联免疫吸附法(ELISA)试剂盒(武汉华美生物科技有限公司),低温低速离心机(美国,MICRROLTR)、全自动酶标仪(芬兰,Thermo FisherMK-3)、针刺手法参数测定仪(上海,ATPⅡ型)。
1.3干预方法针刺组针刺大鼠右侧足三里穴,深度约为7 mm(针灸针已固定进针深度),行提插平补平泻法,频率为每分钟120次,行针2min。针刺手法于针刺手法参数测定仪上训练,待手法操作波形示意图持续稳定后方可行针刺干预,见图1。空白对照组采用同针刺组完全相同的大鼠固定方法。
1.4标本制备分别取各组各个时间点穴周大小为0.8 cm×0.8 cm×0.6 cm的皮肤肌肉组织,用磷酸盐缓冲液(PBS)漂洗,放入-20℃的冰箱中保存,待样本收集完后集中匀浆和离心。取100mg组织,用1×PBS洗去血污,剪成小块放入组织研磨器(匀浆管)中,加入1mL 1×PBS,制成匀浆,然后置于-20℃过夜。经过反复冻融2次处理破坏细胞膜后,将组织匀浆于2~8℃5 000×g离心5min取上清。取适量上清液立即进行实验,或将上清分装保存于-20℃或-80℃,解冻后的样品应再次离心,然后检测。
1.5ELISA法检测采用ELISA法对足三里穴区皮肤肌肉组织匀浆中的各指标含量进行检测,严格按照说明书进行操作。
1.6统计学处理采用SPSS18.0统计软件对实验数据进行分析,计量资料用均数±标准差(±s)表示,两组间同时间点的比较,若符合正态分布及方差齐,则采用两独立样本t检验,若偏态分布或方差不齐则采用秩和检验,组内不同时点比较采用单因素方差分析,TLR4与其他各指标进行一元线性相关与回归分析,P<0.05为差异有统计学意义。
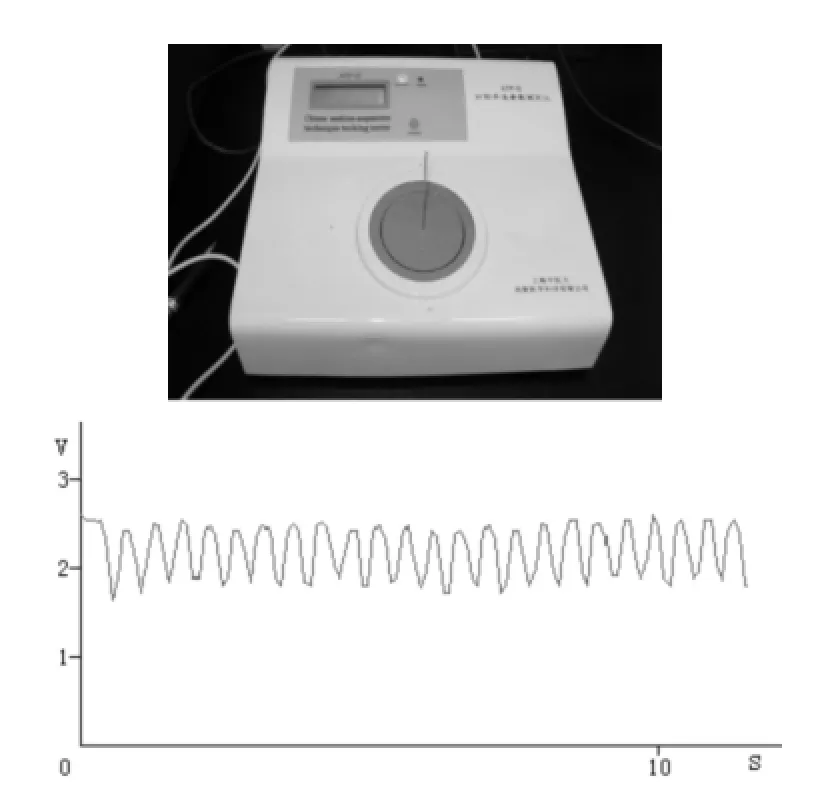
图1 针刺手法参数测定仪和每分钟120次提插手法操作波形示意图Fig.1 Acupuncture technique parameter tester and the wavesofshifting-thrustingacupuncturemanipulation with the frequency of 120 times perm inute
2 结果
2.1穴位局部各指标浓度随时间的变化
2.1.1穴位局部HMGB1浓度随时间的变化空白对照组组内各时间点均无统计学差异(P>0.05),提示正常生理情况下,穴位局部的HMGB-1浓度比较稳定,固定对其无明显影响;针刺组组内各时间点均无统计学差异,但针刺后8 h较其他各时间点有明显升高趋势;针刺后8 h较空白对照组8 h有统计学差异(P<0.05),提示针刺可使穴位局部的HMGB1浓度发生变化,且在所观察的时间段内于针刺后8 h达到高峰。见表1。
表1 不同时间点HMGB1浓度变化(±s)Tab.1 The changesof HMGB1 concentration atdifferent tim epoints(±s)ng/mL
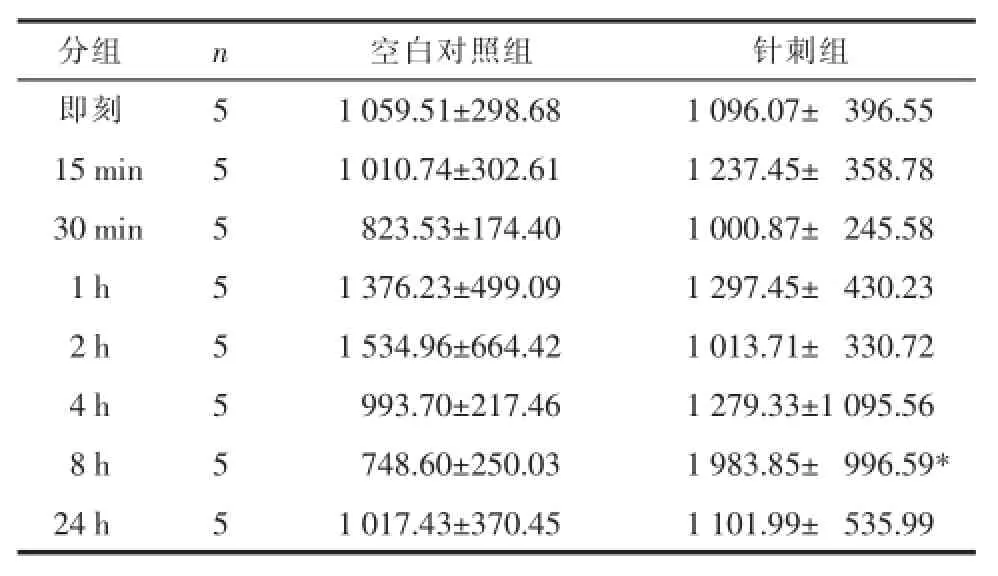
表1 不同时间点HMGB1浓度变化(±s)Tab.1 The changesof HMGB1 concentration atdifferent tim epoints(±s)ng/mL
注:与空白对照组8 h比较,*P<0.05。
分组即刻15min 30min 01 h 02 h 04 h 08 h 24 h n55555555空白对照组 针刺组1 059.51±298.68 1 096.07±0 396.55 1 010.74±302.61 1 237.45±0 358.78 823.53±174.40 1 000.87±0 245.58 1 376.23±499.09 1 297.45±0 430.23 1 534.96±664.42 1 013.71±0 330.72 993.70±217.46 1 279.33±1 095.56 748.60±250.03 1 983.85±0 996.59* 1 017.43±370.45 1 101.99±0 535.99
2.1.2穴位局部TLR4浓度随时间的变化空白对照组组内各时间点均无统计学差异(P>0.05),提示正常生理情况下,穴位局部的TLR4浓度比较稳定,固定对其无明显影响。针刺组组内各时间点均无统计学差异,但针刺后8 h较其他各时间点有明显升高趋势;针刺后8 h较空白对照组8 h有统计学差异(P<0.05),提示针刺可使穴位局部的TLR4浓度发生变化,且在所观察的时间段内于针刺后8 h达到高峰。见表2。
表2 不同时间点TLR 4浓度变化(±s)Tab.2 The changesof TLR4 concentration at different time points(±s)ng/m L

表2 不同时间点TLR 4浓度变化(±s)Tab.2 The changesof TLR4 concentration at different time points(±s)ng/m L
注:与空白对照组8 h相比,*P<0.05。
分组即刻15min 30min 01 h 02 h 04 h 08 h 24 h n55555555空白对照组 针刺组11.31±2.29 10.78±3.29 8.57±3.41 12.86±1.76 8.81±2.60 10.17±3.53 11.47±6.59 12.40±5.03 11.62±6.87 10.61±3.76 10.60±2.48 9.30±6.51 6.90±2.66 14.34±5.52* 9.37±4.72 10.29±5.66
2.1.3穴位局部IL-1β浓度随时间的变化空白对照组组内各时间点之间均无统计学差异(P>0.05),提示正常生理情况下,穴位局部的IL-1β浓度比较稳定,固定对其无明显影响。针刺组组内各时间点之间均无统计学差异(P>0.05)。两组间对应时间点比较均无统计学差异(P>0.05),提示针刺对穴位局部IL-1β浓度无明显影响。见表3。
2.1.4穴位局部IL-6浓度随时间的变化空白对照组组内各时间点之间均无统计学差异(P>0.05),提示正常生理情况下,穴位局部的IL-6浓度比较稳定,固定对其无明显影响;针刺组组内各时间点均无统计学差异,但针刺后15min、8 h较其他各时间点有升高趋势;两组各对应时间点比较均无统计学差异(P<0.05),但针刺后15min、8 h较空白即刻、15min、30min、8 h、24 h有升高趋势,提示针刺后穴位局部IL-6浓度可发生变化,且在所观察的时间段内于针刺后15min、8 h达到高峰。见表4。
表3 不同时间点IL-1β浓度变化(±s)Tab.3 The changesof IL-1βconcentration at different tim e points(±s)ng/mL

表3 不同时间点IL-1β浓度变化(±s)Tab.3 The changesof IL-1βconcentration at different tim e points(±s)ng/mL
分组即刻15min 30min 01 h 02 h 04 h 08 h 24 h n55555555空白对照组 针刺组255.29±98.94 254.78±58.10 299.04±171.38 430.68±147.07 195.61±35.09 277.75±123.23 508.33±368.59 498.75±336.01 538.50±536.58 292.51±110.65 250.73±93.38 328.92±393.55 265.15±203.20 284.54±72.53 292.56±191.49 306.79±223.08
表4 不同时间点IL-6浓度变化(±s)Tab.4 The changesof IL-6 concentration atdifferent tim e points(±s)ng/mL
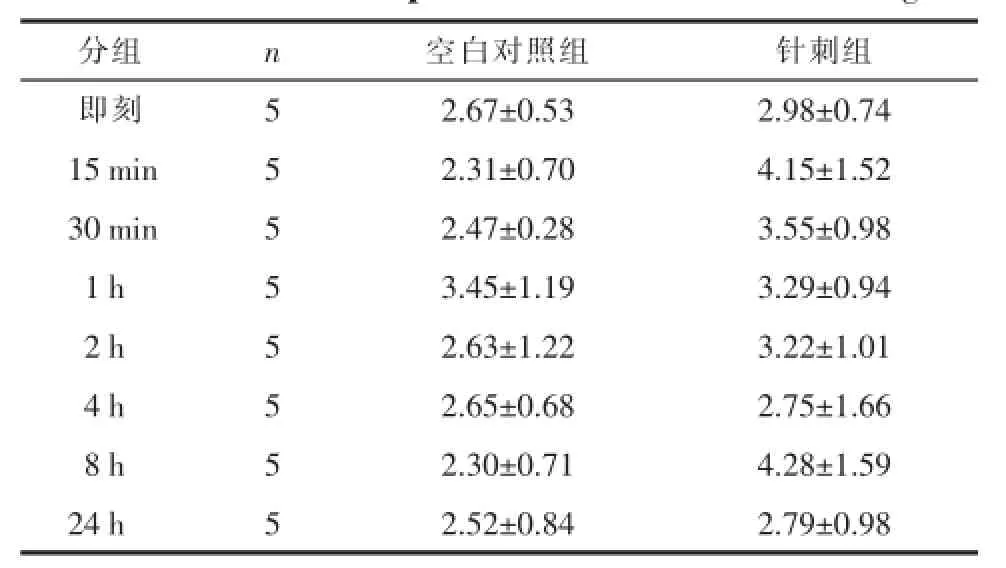
表4 不同时间点IL-6浓度变化(±s)Tab.4 The changesof IL-6 concentration atdifferent tim e points(±s)ng/mL
分组即刻15min 30min 01 h 02 h 04 h 08 h 24 h n55555555空白对照组 针刺组2.67±0.53 2.98±0.74 2.31±0.70 4.15±1.52 2.47±0.28 3.55±0.98 3.45±1.19 3.29±0.94 2.63±1.22 3.22±1.01 2.65±0.68 2.75±1.66 2.30±0.71 4.28±1.59 2.52±0.84 2.79±0.98
2.1.5穴位局部TNF-α浓度随时间的变化空白对照组仅1 h组与15min组有统计学差异(P<0.05),其余各时间点之间均无统计学差异,提示正常生理情况下,穴位局部的TNF-α浓度可维持在一定范围内;针刺组组内各时间点之间均无统计学差异(P>0.05);但针刺后15min较空白对照组15min有统计学意义(P<0.05),针刺后8 h较空白对照组8 h有升高趋势(P<0.05),提示针刺后穴位局部TNF-α浓度可发生变化,且在所观察的时间段内,于针刺后15min、8 h达到高峰。见表5。
表5 不同时间点TNF-α浓度变化(±s)Tab.5 The changesof TNF-αconcentration atdifferent tim e points(±s)ng/m L

表5 不同时间点TNF-α浓度变化(±s)Tab.5 The changesof TNF-αconcentration atdifferent tim e points(±s)ng/m L
注:与空白15m in组相比,*P<0.05。
分组即刻15min 30min 01 h 02 h 04 h 08 h 24 h n55555555空白对照组 针刺组104.43±37.37 120.78±65.11 63.34±45.79 137.42±24.65* 92.46±46.26 93.12±36.82 124.48±54.20* 117.34±45.71 85.05±77.45 85.54±47.17 113.81±27.48 93.74±74.37 75.49±41.50 131.75±54.06* 93.18±51.68 94.12±61.47
2.2TLR4与各指标相关性分析
2.2.1TLR4与HMGB1相关性分析空白对照组和针刺组穴位局部HMGB1与TLR4的表达均呈正相关,而且针刺后穴位局部HMGB1与TLR4的相关性确定系数增大(回归方程及相关系数,见图2),说明针刺后穴位局部HMGB1的表达可能与TLR4关系密切。

图2 空白对照组和针刺组HMGB1与TLR4浓度相关关系图Fig.2 The concentration affinity d iagram betw een HMGB1 and TLR4 in controlgroup and acupuncturegroup
2.2.2TLR4与IL-1β相关性分析空白对照组和针刺组穴位局部IL-1β与TLR4的表达均呈正相关,针刺后穴位局部IL-1β与TLR4的相关性确定系数基本不变(回归方程及相关系数,见图3),提示针刺后穴位局部IL-1β的表达与TLR4关系不明显。
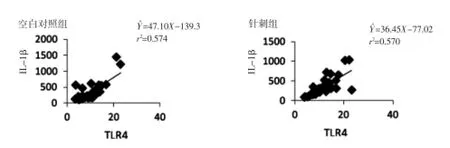
图3 空白对照组和针刺组IL-1β与TLR4浓度相关关系图Fig.3 The concentration affinity diagram betw een IL-1β and TLR4 in controlgroup and acupuncturegroup
2.2.3TLR4与IL-6相关性分析空白对照组和针刺组穴位局部IL-6与TLR4的表达均呈正相关,针刺后穴位局部IL-6与TLR4的相关性确定系数减小(回归方程及相关系数,见图4),提示针刺后穴位局部IL-6的表达与TLR4之间缺乏直接联系。

图4 空白对照组和针刺组IL-6与TLR4浓度相关关系图Fig.4 The concentration affinity diagram between IL-6 and TLR4 in controlgroup and acupuncturegroup
2.2.4TLR4与TNF-α相关性分析空白对照组和针刺组穴位局部TNF-α与TLR4的表达均呈正相关,而且针刺后穴位局部TNF-α与TLR4的相关性确定系数增大(回归方程及相关系数,见图5),说明针刺后穴位局部TNF-α的表达可能与TLR4关系密切。

图5 空白对照组和针刺组TNF-α与TLR4浓度相关关系图Fig.5 The concentration affinity diagram between TNF-α and TLR4 in controlgroup and acupuncturegroup
3 讨论
前期研究发现[4]针刺后穴区肌肉组织可出现肌纤维断裂,且断裂的细纤维间隙有炎性细胞浸润,为针刺后穴位局部可产生炎症反应提供了形态学依据。此外,张迪等[5]研究发现针刺可促进肥大细胞脱颗粒,释放组胺、缓激肽等物质,这些物质可扩张毛细血管及微静脉,使血管内皮基底膜暴露,血管通透性增强,炎性介质渗出,为针刺后穴位局部可产生炎症反应提供了病理学依据。调控穴位局部肥大细胞、相关活性物质对针刺效应有一定的影响,即调控炎症反应的上游环节会影响到针刺效应。因此本研究围绕TLR4的可能上游信号分子(HMGB1)及下游事件促炎性因子(IL-1β、IL-6、TNF-α)的表达展开,以初步明确TLR4在针刺引起局部炎症反应中的作用。
HMGB1作为重要的晚期炎性因子(血液延迟表达6-32 h[6]),与TNF-α、IL-1β等早期炎性因子相互诱生,不断放大炎性信号,造成炎症失控迁延,在风湿关节炎、慢性肝病、恶性肿瘤、动脉粥样硬化等疾病中发挥重要作用。但是新近的研究发现HMGB1还具有组织损伤因子作用,作为核蛋白,在多数组织细胞内含量丰富,而细胞一旦受损伤,膜结构受到破坏,细胞就会以单纯扩散的方式释放HMGB1,释放进入细胞间隙的HMGB1可刺激树突细胞的成熟、增殖,诱导免疫应答,使机体对已经发生的损伤产生防御反应和炎性反应。HMGB1还是致炎细胞因子调控网络中的一个中心环节,不仅能促使TNF-α、IL-1β等表达,还能激活ERK激酶、P38MAPK激酶、JNK激酶并促使核转录因子(NF-κB)发生核移位[7]。因此,HMGB1在组织损伤后适当的时间释放出来,可能参与炎症过程中免疫和内分泌反应的调节[8]。针刺后穴位局部HMGB1的表达及升高可能启动了穴位局部炎症反应发生、发展和自我修复的过程,该过程可能与TLR4密切相关。
已经证实很多受体在HMGB1的信号转导中起作用,包括晚期糖基化终产物受体(RAGE)和某些TOLL样受体家族成员。研究发现TLR2和TLR4可与巨噬细胞、中性粒细胞分泌的HMGB1结合,促使NF-κB活化,诱导炎症发生,提示TLR2和TLR4可能是HMGB1的潜在受体[9]。而且不同TOLL样受体介导产生的炎性因子有所不同,孙立[10]观察HMGB1诱导严重烧伤大鼠枯否细胞(KCs)促炎性细胞因子产生的分子机制,TLR4在HMGB1诱导KCs表达TNF-α的过程中起到更重要的作用,而HMGB1诱导KCs表达IL-1β主要依靠TLR2介导。TLR2和TLR4在烧伤后KCs中HMGB1信号转导引起的细胞因子释放过程中发挥着不同作用。本研究初步发现,TLR4在针刺诱导穴位局部TNF-α表达的过程中关系密切,而针刺诱导穴位局部IL-6的表达可能依赖别的途径。
从穴位刺激到机体效应,两者之间并不是直线性联系,而是由体内复杂网络调节系统介导的。现代研究也认为,生物体作为一个开放的复杂系统,是由无数个大小网络相互联系、整合而形成的[11],针刺穴位局部就存在一个能将针刺物理信息转化为生物信息的启动网络,HMGB1、TLR4、IL-1β、IL-6、TNF-α均是细胞因子网络中的重要成员,具有广泛的生物学活性,是机体神经-内分泌-免疫网络调节的重要因子[12]。局部低浓度的IL-1β主要发挥免疫调节作用,它可直接产生于血管内皮细胞而在血管炎症反应中发挥重要作用[13]。IL-6作为一种多效性因子是宿主对感染和组织损伤所引起反应的主要介质,同时也是参与炎症反应,调节和增强免疫功能的重要细胞因子之一[14-16]。在炎症反应中TNF-α作为重要的始发因子能作用于多种细胞,在细胞和亚细胞水平上激发一系列级联反应,可以诱导IL-1β,IL-6,IL-8等细胞因子的瀑布样释放[17],因此IL-1β、IL-6和TNF-α等除各自独特的生物学作用外,还共同参与机体的免疫反应,并在其中互相补充、互相促进、互相制约[18],在炎症、应激反应中形成细胞因子网络。本研究发现针刺后15min、8 h穴位局部IL-6、TNF-α浓度升高。针刺短时间内细胞因子浓度的升高可能是由于产生这些细胞因子的细胞在受针刺损伤刺激后,立即释放出储存在细胞内的mRNA,并迅速产生相应的细胞因子。8 h后IL-6、TNF-α浓度峰值可能与HMGB1、TLR4 8 h高表达相关,此外针刺后细胞因子的快速释放在诱导和发动炎症反应的同时,还会刺激穴区各种细胞,使之产生更多的细胞因子和其他化学递质,形成各种因子协调工作网,共同完成针刺后炎症的发生、发展和修复过程。
综上所述,针刺后穴位局部产生的HMGB1可能作为穴位局部TLR4的内源性配体,两者结合后通过激活TLR4介导的炎症信号通路,使穴位局部产生以TNF-α表达为主的炎症反应。穴位局部TLR4介导的炎症信号通路可能是针刺后穴位局部炎症反应产生的通路之一,但还有待进一步研究。
[1]Langevin HM,Churchill DL,Cipolla MJ,etal.Mechanical signaling through connective tissue:amechanism for the therapeutic effect of acupuncture[J].The FASEB Journal,2001,15(12):2275-2282.
[2]Park JY,Park JJ,Jeon S,etal.From peripheral to central:The role of ERK signaling pathway in acupuncture analgesia[J].The Journalof Pain,2014,15(5):535-549.
[3]周丹,潘萍,郭义,等.针刺引起的炎性反应是针效产生始动环节之一[J].中国针灸,2009,29(1):32-34.
[4]肖淑华.针刺健康大鼠足三里穴对其穴区组织形态学及IL-1β、IL-6、TNF-α含量影响的研究[D].天津:天津中医药大学,2012.
[5]张迪.肥大细胞功能对针刺镇痛效应的影响及其对中医治疗过程中的物理刺激的敏感性机制研究[D].上海:复旦大学,2007.
[6]Yang H,Wang H,Czura CJ,etal.The cytokine activity of HMGB1[J]. JLeukoc Biol,2005,78(1):1-8.
[7]Fiuza C,Bustin M,Talwar S,et al.Inflammation promoting activity of HMGB1 on human microvascular endothellal cells[J].Blood,2003,101(7):2652-2660.
[8] lliam s JH,Ireland HE.Sensing danger Hsp72 and HMGB1 as candidatesignals[J].JLeukoc Bil,2008,83(3):1-3.
[9]Andersson U,Erlandsson-Harris H,Yang H,et al.HMGB1 as a DNA binding cytokine[J].JLeukoc Biol,2002,72(6):1084-1091.
[10]孙立.HMGB1诱导严重烧伤大鼠枯否细胞(KCs)促炎性细胞因子产生的分子机制[D].合肥:安徽医科大学,2013.
[11]Keelan JA,Khan S,Yosaatmadja F,etal.Prevention ofinflammatory activation of human gestational membranes in annex vivo model using a pharmacologicalNF-KappaB inhibitor[J].JImmunol,2009,183(8):5270-5278.
[12]郭永明.“醒脑开窍”针法对局灶性脑缺血大鼠炎性细胞因子及粘附分子的影响[D].天津:天津中医药大学,2012.
[13]宣兆艳,卢英强,刘东辉,等.IL-1及VEGF在大鼠皮肤切创愈合过程中的免疫组织化学表达[J].吉林大学学报,2007,33(3):460-463.
[14]田中秋,邓立普.TNF-α、IL-6在全身炎症反应综合征表达的研究进展[J].蛇志,2008,20(4):275-278.
[15]Ravaglia G,Forti P,Maioli F,et al.Associations of the 174G/C interleukin-6 gene promoter polymorphism with blood inter leukin-6 and mortality in the elderly[J].Biogerontology,2005,6(6):415-423.
[16]Boniface K,Lecron JC,Bernard FX,et al.Keratinocytes as targets for interleukin-10-related cytokines:aputative role in thepathogenesis ofpsoriasis[J].Eur Cytokine Netw,2005,16(4):309-319.
[17]Yang YL,Li JP,Li KZ,etal.Tumor necrosis factor alpha antibody prevents brain damage of ratswith acute necrotizing pancreatitis[J]. World JGastroenterol,2004,10(19):2898-2900.
[18]张雪,樊小农,王舒,等.针刺对大脑中动脉线栓大鼠海马纹状体的影响[J].天津中医药,2008,25(2):175-176.
(本文编辑:马英,高杉)
Prelim inary research on the role of TLR4 at acupoints in the inflammatory reaction produced by acupuncture
XIQiang,CUIRui,JINGuang,GUOYong-ming
(ExperimentalResearch Center for Acupuncture in Tianjin University of TraditionalChineseMedicine,Tianjin 300193,China)
[Objective]To investigate the role of TLR4 atacupoints in the inflammatory reaction produced by acupuncture.[Methods]The 80 health ratswere divided into acupuncture group and blank control group,each group 40 rats.Each group was random ly divided into8 time points(immediate,15min,30min,1 h,2 h,4 h,8 h,24 h),5 ratsper point.Testing the concentrationsofTLR4,HMGB1,IL-1β,IL-6,TNF-αin point area including skin and muscle tissue with ELISA.[Results]There were no significant changes in the concentration ofeach index ateach time point in controlgroup.Acupuncture could increase the concentrationsof TLR4,HMGB1,IL-6,TNF-α,whereas IL-1βconcentrations did not change.The concentrations of HMGB1,TNF-αhad certain relativity with the concentration of TLR4 respectively after acupuncture.However,the concentration of IL-6 had weaken relativity with TLR4and the concentration of IL-1βhad uncertain relativitywith TLR4.[Conclusion]TLR4 located atacupointsmay play an important part in the inflammatory reaction produced by acupuncture.
acupuncture;acupuncture point;TLR4;inflammatory reaction
R245.9
A
1672-1519(2015)02-0088-05
10.11656/j.issn.1672-1519.2015.02.07
国家自然科学青年基金资助项目(81102641)。
席强(1984-),男,硕士,实验师,研究方向为针刺作用始动机制。
郭永明,E-mail:guoymxr@163.com。
(2014-10-14)

