Hedgehog信号通路在增生性瘢痕中的表达及意义
赵孝开, 潘 姝, 谢有富, 祁少海, 方 力, 戴丽冰
作者单位:510220 广东 广州,暨南大学附属广州市红十字会医院 烧伤整形科
实验研究
Hedgehog信号通路在增生性瘢痕中的表达及意义
赵孝开, 潘 姝, 谢有富, 祁少海, 方 力, 戴丽冰
目的 探讨Hedgehog信号通路分子Shh、Patch、Smo及Gli-1在增生性瘢痕中的表达及意义。方法 增生性瘢痕病患者的瘢痕标本28例,患者手术时取皮修剪后的残余全厚皮片的正常皮肤15例。应用免疫组化、实时荧光定量PCR和Western Blot检测Shh、Patch、Smo及Gli-1在增生性瘢痕及正常皮肤中的表达情况。结果 免疫组化结果显示,Hedgehog信号通路分子Shh、Patch、Smo及Gli-1在增生性瘢痕及正常皮肤中均有表达,表达部位主要位于成纤维细胞及血管内皮细胞的胞浆或胞膜,其在增生性瘢痕中的表达强度均高于正常皮肤,差异具有统计学意义(P<0.05);实时荧光定量PCR和Western Blot检测显示,增生性瘢痕组织中Shh、Patch、Smo及Gli-1在mRNA和蛋白水平的表达均高于正常皮肤组织,差异具有统计学意义(P<0.05)。结论 增生性瘢痕中Shh、Patch、Smo及Gli-1在mRNA和蛋白水平的表达均增高,提示Shh信号通路活性增加可能在增生性瘢痕产生及发展过程中起到重要作用。
增生性瘢痕; Hedgehog信号通路; Shh ; Patch; Smo; Gli-1
增生性瘢痕可导致严重的功能障碍。治疗增生性瘢痕的方法主要有手术切除、加压疗法、类固醇激素等[1-2],但瘢痕增生及复发远没有达到控制。Hedgehog信号通路在胚胎发育过程中的细胞分化增殖和许多器官的创伤愈合中起到重要作用,其与多种肿瘤的再生、侵袭转移密切相关[3]。近年许多研究显示,该通路与肝纤维化和肾脏纤维化等疾病密切相关[4-6]。增生性瘢痕是一种皮肤组织纤维化疾病,该信号通路是否也与增生性瘢痕存在关系,自2014年7月至2015年2月,我们通过观察测定增生性瘢痕与正常皮肤组织中该信号通路关键分子的表达情况,以期为增生性瘢痕的治疗提供新的思路和靶点。
1 对象与方法
1.1 主要试剂 兔抗小鼠Shh、Smo、Gli-1多克隆抗体购自北京博奥森生物公司,兔抗鼠Patch多克隆抗体购自美国ORIGENE公司,免疫组化SP试剂盒与DAB显色剂购自福建迈新生物公司。
1.2 标本来源 增生性瘢痕病患者的瘢痕标本28例,男性15例,女性13例;年龄1~39岁。术前均未行其他治疗。瘢痕处于增生期, 取材部位:上肢12例,躯干3例,面部5例,下肢8例。正常皮肤15例,为患者手术时取皮修剪后的残余全厚皮片。
1.3 标本采集及处理 标本取材后,分为3份,一份标本经固定,脱水,透明,包埋后制成石蜡块,行3 μm切片用于免疫组化染色。另外两份保存于液氮,分别用于Western Blot和RT-PCR检测。
1.4 标本的免疫组织化学染色 免疫组织化学法检测参照试剂盒说明书进行。石蜡切片脱蜡、水化及抗原修复后,PBS冲洗3次,每次3 min,1%BSA室温封闭15 min,加一抗,4 ℃冰箱过夜(各抗体稀释浓度均为1∶200),二抗室温下孵育20 min,滴加DAB,苏木素复染3 min,流水稍冲洗,盐酸乙醇分化,梯度脱水透明,中性树胶封片,PBS代替一抗做阴性对照,光学显微镜下观察染色结果,高倍光学显微镜下取5个观察视野,应用Image-Pro Plus 6.0图像分析软件进行各抗体蛋白面密度(阳性颗粒的总面积及光密度值,然后计算出单位面积的面密度值)。
1.5 实时荧光定量PCR法检测Shh、Patch、Smo和Gli-1 mRNA的表达 按Trizol试剂说明书方法提取总RNA,按Promega反转录试剂盒说明书方法反转录合成cDNA,在GenBank上查找目的基因mRNA序列,在CDS区设计特异性引物,用Primer express 2.0软件设计特异性引物,美国INVITROGEN公司3900型台式高通量DNA合成仪合成,序列如下:Shh (片段长度108 bp) 上游引物: 5′-CAGCGGAAGGTATGAAGGGA-3′,下游引物: 5′-GCTCCGGTGTTTTCTTCATCC-3′;Patch (片段长度110 bp) 上游引物: 5′-CGAGATACAAGCCTGTA-3′,下游引物: 5′-CCTGCTTCACCACCTTCTTG-3′;Smo(片段长度115 bp) 上游引物: 5′-GTGCGAAGTGCCCTTGGTT-3′ ,下游引物: 5′-CATGTCCTGGTGCTCAGCCT-3′;Gli-1(片段长度111 bp) 上游引物: 5′-AGATCCTAGCTCGCTGCGAA-3′,下游引物:5′-GTAGAAATGGATGGTGCCCG-3′;GAPDH(片段长度96 bp)上游引物:5′-GATTCCACCCATGGCAAATT-3′,下游引物:5′-TCTCGCTCCTGG AAGATGGT-3′。采用美国ABI公司7300型全自动荧光定量PCR仪,反应条件为:93 ℃预变性2 min,然后93 ℃15 s,55 ℃25 s,72 ℃25 s,共40循环,采用BioRad CFX Manager软件分析Shh、Gli-1 基因和GAPDH基因的扩增曲线,得到各实验孔的Ct值,分别计算同一个cDNA样本中3个复孔的Ct 均值,并以同一个样本中的GAPDH Ct值作为内参照,并进一步用2-△△CT法计算基因的相对表达水平。
1.6 Western Blot检测Shh和Gli-1蛋白的表达 常规提取组织蛋白,测定其浓度,各组加入20 μg蛋白样本,加入5×上样缓冲液,100 ℃煮沸5 min,十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳,400 mA电流转膜120 min,5%牛血清白蛋白封闭2 h,1×TBST洗涤3次,10 min/次,加入一抗,4 ℃孵育过夜,二抗孵育1 h,1×TBST充分漂洗后用ECL试剂盒显色。所有内参对照均使用小鼠抗GAPDH (稀释度为1∶7000)。所得图像均用image lab软件扫描作灰度分析 (目的蛋白/GAPDH的比值)。
2 结果
2.1 人增生性瘢痕及正常皮肤Shh、Patch、Smo和Gli-1蛋白免疫组化检测结果 免疫组化结果显示,Shh和Gli-1在增生性瘢痕及正常皮肤组织中均有表达,显微镜下Shh的染色主要位于细胞质,染色为均匀棕黄色,既在表皮细胞也在真皮层成纤维细胞及血管内皮细胞中表达;Gli-1阳性染色主要位于胞质或胞核,也为棕黄色(图1~4);Patch蛋白在增生性瘢痕中成纤维细胞及血管内皮细胞呈阳性表达,而在正常皮肤组织中在表皮基底层细胞及血管内皮细胞有少量表达(图5~6);Smo蛋白在增生性瘢痕中的成纤维细胞及血管内皮细胞中均有强阳性表达,主要表达部位位于胞膜及胞质,染色为深棕色,在正常皮肤组织少部分真皮层成纤维细胞胞浆有阳性表达,染色为棕黄色(图7~8)。上述4种蛋白在增生性瘢痕中的表达量均比在正常皮肤组织中高,差异具有统计学意义(P<0.05,表1)。
2.2 荧光定量PCR检测增生性瘢痕和正常皮肤组织中Shh、Patch、Smo和Gli-1 mRNA表达结果 荧光定量PCR结果显示,Shh、Patch、Smo、Gli-1 mRNA在增生性瘢痕中的表达量均较正常皮肤组织中高,差异均具有统计学意义(P<0.05,表2)。
2.3 Western Blot法检测人增生性瘢痕及正常皮肤Shh和Gli-1蛋白表达结果 Shh和Gli-1蛋白在增生性瘢痕及正常皮肤均有表达(图9),在增生性瘢痕中表达量均较正常皮肤高,差异具有统计学意义(P<0.05,表3)。
表1 免疫组化检测Shh、Patch、Smo和Gli-1蛋白在增生性瘢痕和正常皮肤中的表达


组织ShhPatchSmoGli⁃1增生性瘢痕0.245±0.013∗0.259±0.016∗0.334±0.028∗0.232±0.026∗正常皮肤0.161±0.0270.120±0.0170.171±0.0140.163±0.015t值25.0560.4557.6424.27P值0.000.000.000.00
注:*与正常皮肤相比,P<0.05
表2 RT-PCR检测Shh、Patch、Smo、Gli-1 mRNA在增生性瘢痕 和正常皮肤中的表达
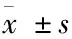

组织ShhPatchSmoGli⁃1增生性瘢痕13.27±2.89∗16.17±1.35∗22.38±5.69∗12.52±2.75∗正常皮肤4.56±0.876.43±1.369.78±1.804.86±1.97t值11.3422.5110.769.52P值0.0340.0170.040.24
注:*与正常皮肤相比P<0.05
表3 Western Blot法检测Shh、Gli-1蛋白在增生性瘢痕和正常 皮肤中的表达


组织ShhGli⁃1增生性瘢痕0.66±0.04∗0.56±0.06∗正常皮肤0.36±0.050.34±0.05t值15.349.12p值0.000.00
注:*与正常皮肤相比P<0.05
3 讨论
Hedgehog是一种可以共价结合胆固醇的分泌性蛋白,Hedgehog信号传导通路由Hh配体、膜蛋白受体复合物、核转录因子和下游靶基因组成[7]。Hh的同源基因有3种,即Shh、Ihh和Dhh。目前对Shh进行的研究较多,Shh信号对靶细胞的作用是通过介导Patch和Smo这2个跨膜蛋白受体来实现的,Patch是由单一肽链构成的,这些肽链拥有12个跨膜区,其发挥着负调控的作用。Smo是由拥有7个跨膜区的单一肽链构成的,是Hedgehog信号通路传递所必须的蛋白受体。在没有Hh、Patch情况下,激活Smo可导致Hedgehog下游相关目的靶基因的活化[8]。Hedgehog通路在动物胚胎发育中起着非常重要的作用[9],在成熟组织器官中,Hedgehog通路的活化在干细胞调控、组织损伤修复和血管再生等方面也发挥着关键作用。Hh蛋白可激活整条通路,它能通过Patch和Smo向细胞内传递信号,激活下游转录因子Gli,激活的Gli又可介导相关目的基因转录和蛋白的合成。在未与Hh结合的情况下,Patch抑制Smo蛋白的活性,从而抑制下游相关靶基因的转录。当Patch和Hh蛋白结合以后,解除Patch对Smo的抑制作用,Smo在细胞表面聚集激活,促使Gli蛋白与PKA形成复合物进入胞核,激活下游相应靶基因转录。同时Hh通路又能够负反馈诱导Patch的转录。当Patch产生突变或者缺失时,或 Smo突变致对Patch抑制作用不敏感,这一系列情况将会造成Hh通路失控,其结果将会造成Gli持续激活,启动下游靶基因转录。
本研究发现,在增生性瘢痕中,Hedgehog通路中关键因子Shh、Patch、Smo和Gli-l在增生性瘢痕和正常皮肤组织中均有表达,实时荧光定量PCR结果显示,Shh、Patch、Smo和Gli-1 mRNA在增生性瘢痕中的表达量高于其在正常皮肤中的表达,差异有统计学意义;Western Blot检测显示,Shh、Gli-1蛋白在增生性瘢痕中表达高于正常皮肤,同样免疫组化结果也显示Shh、Patch、Smo和Gli-1蛋白在增生性瘢痕中的表达量明显高于正常皮肤,这一系列的Hedgehog信号通路分子在增生性瘢痕中高表达,提示我们该信号通路与增生性瘢痕的形成存在一定的联系。早期研究显示,Hedgehog信号通路与肿瘤的转移、侵袭和再生密切相关[3],近年来的研究发现,其调控作用还涉及到组织损伤过程中细胞迁移、增殖、分化及修复[10]。有学者发现,Hedgehog信号通路与HSC活化有关,HSC的异常活化增殖是肝纤维化发生发展的关键环节,过度或持续的Hedgehog通路激活能够导致受损肝脏组织过度再生,进而促进肝纤维化发生[11-12]。Guy等[13]在研究肝脏损伤时发现,损伤的肝脏中Hh 信号通路处于激活状态,且肝脏损伤程度与Hh信号通路活化水平呈正相关,同时Hh信号通路活化可刺激肝脏内成纤维细胞的生长,从而促进肝脏纤维化。章丽娜[14]研究指出,预防性使用环巴胺能有效抑制Hh信号通路的活化,减少α-SMA生成并减轻小鼠肝纤维化程度。Philips等[15]研究指出,给予大鼠肝损伤模型中应用Hh通路特异性抑制剂GDC-0449可以改善大鼠肝纤维化程度。

图1 Shh在增生性瘢痕中的表达(SP ×200) 图2 Shh在正常皮肤中的表达(SP ×200) 图3 Gli-1在增生性瘢痕中的表达(SP ×200) 图4 Gli-1在正常皮肤中的表达(SP ×200) 图5 Patch在增生性瘢痕中的表达(SP ×200) 图6 Patch在正常皮肤中的表达(SP ×200) 图7 Smo在增生性瘢痕中的表达(SP ×200) 图8 Smo在正常皮肤中的表达(SP ×200) 图9 Western Blot 检测Shh和Gli-1蛋白在增生性瘢痕和正常皮肤中的表达
Fig 1 Shh expression in hypertrophic scar (SP ×200). Fig 2 Shh expression in normal skin (SP ×200). Fig 3 Gli-1 expression in hypertrophic scar (SP ×200). Fig 4 Gli-1 expression in normal skin (SP ×200). Fig 5 Patch expression in hypertrophic scar (SP ×200). Fig 6 Patch expression in normal skin (SP ×200). Fig 7 Smo expression in hypertrophic scar (SP ×200). Fig 8 Smo expression in normal skin (SP ×200). Fig 9 Shh and Gli-1 expression in hypertrophic scar and normal skin detected Western Blot.
我们推测Hedgehog信号通路的异常激活可能参与了增生性瘢痕的形成和发展,阻断该通路是否会达到抑制瘢痕增生的效果?我们下一步将在体内实验中进一步研究该通路在增生性瘢痕发生中的作用,以期为增生性瘢痕的早期治疗提供新的思路和方法。
[1] 肖青青, 王一飞, 李 欣, 等. 病理性瘢痕综合治疗临床进展[J]. 中国中西医结合皮肤性病学杂志, 2014,13(1):62-65.
[2] Rabello FB, Souza CD, Farina Junior JA. Update on hypertrophic scar treatment[J]. Clinics (Sao Paulo), 2014,69(8):565-573.
[3] 路景涛, 何 伟, 宋莎莎, 等. Hedgehog-Pat/Smo-Gli 信号通路介导肿瘤的侵袭转移研究进展[J]. 中国药理学通报, 2013,29(5):593-597.
[4] Omenetti A, Choi S, Michelotti G, et al. Hedgehog signaling in the liver[J]. J Hepatol, 2011,54(2):366-373.
[5] Choi SS, Omenetti A, Syn WK, et al. The role of Hedgehog signaling in fibrogenic liver repair[J]. Int J Biochem Cell Biol, 2011,43(2):238-244.
[6] 白永恒, 陆 红, 周 琴, 等. Sonic hedgehog 信号通路在单侧输尿管梗阻大鼠肾组织中的表达变化及意义[J]. 中国病理生理杂志, 2012,28(12):2227-2232.
[7] Robbins DJ, Fel DL, Riobo NA. The Hedgehog signal transduction network[J]. Sci Signal, 2012,5(246):re6.
[8] Briscoe J, Therond PP. The mechanisms of hedgehog signalling and its roles in development and disease[J]. Nat Rev Mol Cell Biol, 2013,14(7):416-29.
[9] 殷和文, 龙颖颖, 段凤英. Hedgehog信号通路的研究进展[J]. 实用医学杂志, 2014,30(2):318-320.
[10] Kool M, Jones DT, Jager N, et al. Genome sequencing of shh medulloblastoma predicts genotype-related response to smoothened inhibition[J]. Cancer Cell, 2014,25(3):393-305.
[11] Hyun J, Choi SS, Diehl AM, et al. Potential role of hedgehog signaling and microrna-29 in liver fibrosis of ikkbeta-deficient mouse[J]. J MolHistol, 2014,45(1):103-112.
[12] Chen Y, Choi SS, Michelotti GA, et al. Hedgehog controls hepatic stellate cell fate by regulating metabolism[J]. Gastroenterology, 2012,143(5):1319-1329.
[13] Guy CD, Suzuki A, Zdanowicz M, et al. Hedgehog pathway activation parallels histologic severity of injury and fibrosis in human nonalcoholic fatty liver disease[J]. Hepatology, 2012,55(6):1711-1721.
[14] 章丽娜. Hedgehog信号通路在肝纤维化小鼠模型中的作用及药物干预探索[D]. 北京:中国医学科学院, 2013.
[15] Philips GM, Chan IS, Swiderska M, et al. Hedgehog signaling antagonist promotes regression of both liver fibrosis and hepatocellular carcinoma in a murine model of primary liver cancer[J]. PLoS One, 2011,6(9):e23943.
Expression of Hedgehog signal pathway in hypertrophic scar and its significance
ZHAOXiao-kai,PANShu,XIEYou-fu,etal.
(DepartmentofBurnsandOrthopedics,GuangzhouRedCrossHospital,Guangzhou510220,China)
Objective To investigate the expression of Shh, Patch, Smo and Gli-1 of Hedgehog signal pathway in hypertrophic scar and its significance. Methods Twenty-eight specimens of hypertrophic scar from the patients who underwent plastic surgery and 15 specimens of normal skins from the same patients were collected in our hospital. Immunohistochemistry, Real-time PCR and Western Blot were applied to detect the mRNA and protein expressions of Shh, Patch, Smo and Gli-1 in both hypertrophic scars and normal skins. Results Shh, Patch, Smo and Gli-1, the elements of Hedgehog signal pathway, were mainly detected in cell membrane and cytoplasm of fibroblast and endothelial cells of hypertrophic scars and normal skins. The expressions of them in hypertrophic scars were significantly higher than those in normal skins (P<0.05). The expressions of Shh, Patch, Smo and Gli-1 were significantly increased in hypertrophic scars at both mRNA and protein levels. Conclusion The expressions of Shh、Patch、Smo and Gli-1 mRNA and protein were elevated in hypertrophic scars which indicated that the abnormal activity of Hedgehog signal pathway plays an important role in the occurrence of the hypertrophic scar.
Hypertrophic scar; Hedgehog signal pathway; Shh; Patch; Smo; Gli-1
广州市医药卫生科技重点项目基金资助项目(20121A021010)
作者单位:510220 广东 广州,暨南大学附属广州市红十字会医院 烧伤整形科
赵孝开(1987-),男,河南人,硕士研究生.
潘 姝,510220,暨南大学附属广州市红十字会医院 烧伤整形科,电子信箱:lionps@163.com
10.3969/j.issn.1673-7040.2015.07.018
R619.6
A
1673-7040(2015)07-0432-04
2015-05-29)

