罗格列酮调控光老化成纤维细胞周期阻滞的研究
陈 亮, 毕 波, 曾继平, 杨清建, 贾传龙, 卢勇舟, 周轶群, 杨 平, 郭 妤, 朱晶晶, 刘天一
作者单位:200040 上海,复旦大学附属华东医院 整形外科
罗格列酮调控光老化成纤维细胞周期阻滞的研究
陈 亮, 毕 波, 曾继平, 杨清建, 贾传龙, 卢勇舟, 周轶群, 杨 平, 郭 妤, 朱晶晶, 刘天一
目的 探讨罗格列酮对光老化成纤维细胞的周期及相关蛋白的影响。方法 采用cck-8法检测罗格列酮对成纤维细胞增殖的影响。罗格列酮预处理成纤维细胞48 h,采用UVB 120 mJ/cm2反复照射4次,照射间隔时间12 h,诱导产生细胞光老化模型,继续培养48 h,流式细胞技术检测成纤维细胞周期,Western Blot检测周期相关蛋白p53和p21。结果 低剂量罗格列酮对成纤维细胞的活性无影响。40 μM罗格列酮预处理的光老化成纤维细胞与单纯UVB照射组相比,S期的比例下降了15.9%。与对照组相比,40 μM罗格列酮预处理组中成纤维细胞周期相关蛋白p53和p21的表达分别下降了35.7%和27.7%。 结论 罗格列酮可降低光老化成纤维细胞周期的相关蛋白p53和p21的表达,缓解UVB引起的光老化成纤维细胞的S期阻滞,可能对光老化成纤维细胞具有某种保护作用。
罗格列酮; 过氧化物酶体增殖物激活受体γ; 光老化; 成纤维细胞; 细胞周期
与其他器官不同,皮肤在受到内源性老化调控的同时,也受到外界环境因素和生活方式的影响。紫外线辐射作为主要的外源性促衰老因素,可引起暴露处皮肤的外源性老化,又称为光老化[1]。成纤维细胞(fibroblasts, FBs) 是皮肤的主要组成细胞成分,在分泌、维持皮肤细胞外基质平衡,保持细胞弹性等方面具有重要作用,其在光老化进程中的作用也日益受到重视[2-3]。我们的前期研究发现,在UVB引起的光老化FBs中,出现明显的S期阻滞,使细胞复制生长受限,进而影响功能发挥[4]。最近许多研究发现,过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor-γ, PPAR-γ)作为细胞核激素受体家族中的配体激活受体成员,在体内外的细胞衰老进程中起调节作用[5-6]。为了了解PPAR-γ对光老化FBs细胞的生物学作用,自2014年3~7月,我们使用罗格列酮(rosiglitazone, RO)作为PPAR-γ的激动剂,研究其对光老化FBs细胞S期阻滞及周期相关蛋白表达的影响,并对产生的结果作出相应分析。
1 材料与方法
1.1 小鼠皮肤细胞的获取 取新生SPF级C57 BL/6小鼠,乙醚麻醉处死,浸泡于75%乙醇中10 min,用DMEM洗去残留乙醇,置于培养皿中,分离背部皮肤,取皮肤组织块约1 cm×1 cm,立即置于2%中性蛋白酶中,37 ℃恒温消化4 h;将皮肤取出,分离表皮和真皮,将真皮剪碎后,置于0.1%胶原酶中,37 ℃恒温摇床消化2 h,至组织块基本消失。1500 r/min离心5 min,收集沉淀;弃上清,用DMEM+10%FBS制成细胞悬液,吹打均匀后以约2×105/cm2的密度接种于培养皿,于37 ℃、5%CO2、100%饱和湿度的条件下培养;接近80%融合时进行传代,比例约为1∶4。
1.2 药物处理及光老化模型的建立 选用P2代细胞,首先探索应用含不同RO浓度DMEM +10% FBS处理48 h。cck-8检测细胞活性,选取合适浓度用于后续实验。将细胞随机分成4组:正常组(无RO预处理, 无UVB照射),RO组(RO预处理,无UVB照射),UVB组(无RO预处理,UVB照射),UVB+RO组(RO预处理,UVB照射)。然后采用此前本研究小组确立的方法[4],移去培养液,覆盖薄层PBS缓冲液,置于UVB灯管(Philips TL 20 W/01RS lamp)正下方,打开盖子,进行照射,照射剂量(使用Lutron UV light meter测量)为120 mJ/cm2。照射完毕后,吸去PBS,加入10 ml DMEM+1% FBS继续培养,每隔12 h照射1次,120 s/次,共4次;末次照射完成后改成DMEM+10%FBS培养。
1.3 细胞周期检测 正常细胞或光老化细胞末次照射48 h后,移去培养液,预冷PBS洗涤1次,胰酶消化细胞,离心去上清,PBS洗2次,-20 ℃预冷的70%乙醇重悬,4 ℃保存过夜后,PBS洗2次,重悬于0.5 ml PBS中。加入50 μg/ml的碘化丙啶和1 mg/ml的RNA酶,避光室温30 min后流式细胞仪检测。各细胞周期分布使用ModiFit LT v2.0软件分析。
1.4 周期相关蛋白表达检测 正常细胞或光老化模型(stress-induced premature senescence, SIPS)细胞末次照射48 h后,移去培养液,预冷PBS洗涤3次,加入蛋白裂解液500 μl,用1 ml针头反复吹打,转移至1.5 ml EP管中,冰上静置15 min。12 000 r/min,4 ℃离心15 min,取上清,用BCA法测定蛋白浓度,取各个处理组蛋白提取液,调整蛋白浓度,和等体积2×上样缓冲液混合,煮沸并离心,电泳分离蛋白并将蛋白质转移至PVDF膜上,孵育袋中加入TEST稀释的p53、p21( abcam 1∶500) 和 GAPDH(boster 1∶2000),4 ℃孵育过夜。采用辣根过氧化物酶(HRP)标记的羊抗兔二抗(Jack-son 1∶2000)室温孵育2 h。ECL化学发光法显影和定影。
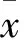
2 结果
2.1 RO对小鼠FBs活力的影响 为选择适合的RO浓度处理细胞,进行后续试验检测,我们分别使用梯度RO浓度的DMEM +10%FBS处理小鼠FBs,发现较低浓度的(0~40 μM)RO对FBs的活性无影响,而较高浓度(80 μM)的RO会产生细胞毒性(图 1),对细胞的正常增殖产生不利影响。因此,我们选择40 μM的RO作为后续细胞处理的药物浓度。
2.2 RO可缓解光老化FBs的S期阻滞 为了检测RO对光老化FBs周期的影响,以120 mJ/cm2UVB照射4次,继续培养48 h,流式检测细胞周期,结果显示UVB模型组与正常组相比,细胞发生明显S期阻滞,S期细胞比率为正常组的5.2倍。加入40 μM RO预处理可明显抑制S期阻滞的发生,细胞周期流式检测显示,UVB+RO组的S期细胞数为正常组的3.1倍,与UVB模型组相比却下降15.9%,表明RO处理可明显缓解光老化FBs的S期阻滞,而单纯RO处理并不会对FBs细胞周期产生影响(图2)。
2.3 RO可降低光老化FBs的周期相关蛋白p53和p21的表达 细胞周期相关蛋白p53、p21作为细胞衰老的常用指标[4],会随着细胞的老化而表达增加。用UVB以120 mJ/cm2共照射4次后,继续培养48 h,从蛋白水平检测p53和p21的变化。Western Blot结果显示,与正常组相比,UVB模型组中细胞p53和p21的表达量分别增加2.8倍和2.7倍,UVB+RO组细胞p53与p21的蛋白表达亦升高,分别为2.0倍和1.7倍,但升高程度不如UVB模型组,P<0.05,差异有统计学意义,表明RO的预处理可明显降低光老化FBs的p53与p21的表达。而单纯RO处理的RO组细胞与正常组细胞相比,差异无统计学意义(图3)。
3 讨论
紫外线辐射会损害人体暴露处的皮肤,影响皮肤颜色和弹性并导致光老化,表现为皮肤粗糙、增厚、松弛、深而粗的皱纹、局部色素沉着或毛细血管扩张,甚至可能出现各种良性或恶性肿瘤[1,7]。FBs作为真皮中的主体细胞成分,不仅能合成胶原纤维、弹性纤维等基质成分,还分泌细胞因子和基质金属蛋白酶(matrix metalloproteinases, MMPs),参与细胞外基质(extracellular matrix, ECM)重塑[8],起到了维持ECM平衡和调节局部微环境的功能[9]。许多报道指出,外源性促衰老因素UVB可通过诱发 DNA 链内交联形成嘧啶二聚体而直接损伤 DNA 双链,亦可通过氧自由基间接影响DNA的结构和功能,对皮肤成纤维细胞造成损害,从而诱发细胞周期阻滞、凋亡,甚至坏死等[10-11]。我们的前期研究使用低细胞毒性剂量UVB成功建立体外FBs SIPS[4],发现光老化的FBs细胞周期发生改变,出现明显的S期阻滞现象,使细胞复制生长受限,影响其功能的发挥。
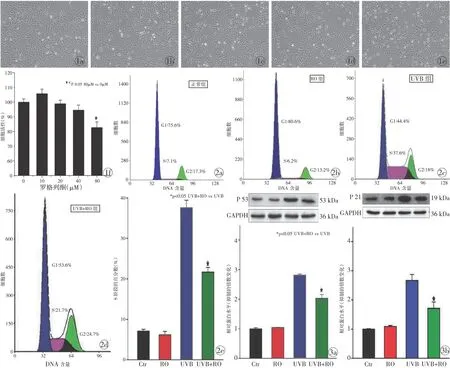
图1 不同浓度的罗格列酮处理小鼠成纤维细胞48 h后的细胞活性 a.0 b.10 μM c.20 μM d.40 μM e.80 μM f.cck-8检测结果 图2 流式检测各组成纤维细胞周期 a.正常组 b.RO组 c.UVB组 d.UVB+RO组 e.各组细胞S期数据 图3 Western Blot检测罗格列酮对UVB诱导的成纤维细胞周期相关蛋白表达的影响 a.p53的表达 b.p21的表达
Fig 1 Cell activity of fibroblasts treated with different concentrations of RO at 48 h. a.0. b. 10 μM. c. 20 μM. d. 40 μM.e. 80 μM. f. the result of cck-8 test. Fig 2 Cell cycle of fibroblasts detected by flow cytometry. a. normal group. b. RO group.c. UVB group. d. UVB+RO group. e. data of S phase of cell cycle in each group. Fig 3 Effect of RO on UVB-induced alteration of cell cycle regulatory proteins in MDFs tested by Western Blot. a. the expression of p53. b. the expression of p21.
过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptors, PPARs)作为核激素受体家族中的配体激活受体,参与许多细胞内代谢过程的调控,目前已发现PPAR-α,PPAR-γ和 PPAR-δ[12]3种亚型。其中,PPAR-γ在脂肪组织中表达较高,可激活组织细胞中一系列基因的表达,增加葡萄糖氧化,增加葡萄糖和脂质吸收,减少游离脂肪酸浓度和降低胰岛素抵抗等功能[13]。针对此生物学功能,临床上已经选择具有强烈PPAR-γ激动活性的化合物噻唑烷二酮类(thiazolidinediones, TZDs)药物,成功应用于Ⅱ型糖尿病的治疗。PPAR-γ除了具有上述功能之外,还可通过改善氧化应激损伤、调节慢性炎症反应等参与生物体内老化[6],以及体外细胞的老化过程[5,14]。近年来,对PPAR-γ在皮肤疾病和老化中具体生物学作用的研究越来越多,Kim等[15]研究发现,一种山柰属植物中的提取物5,7-DMF可激活PPARα/γ,有抗炎作用并能减少UVB辐射后人皮肤成纤维细胞中MMPs的表达。Flori等[16]实验证明,一种共轭多烯醛结构的脂溶性色素衍生物Octa能通过激活PPAR-γ来促进皮肤中黑素的合成,缓解皮肤的日光晒伤。Mastrofrancesco等[17]研究发现,壬二酸可以缓解UV引起的人皮肤中角质形成细胞的炎症反应,起到细胞保护作用,这可能也与PPAR-γ的激活有关。这些都表明了RRAR-γ在光老化中存在保护作用的可能性,为此,本研究探讨利用PPAR-γ的特异性强效激动剂RO作为影响因素,观察其对光老化的FBs的生物学作用,尤其是要了解对于UVB诱导所致的FBs中S期阻滞的影响。
在细胞周期中,S期是周期循环的中心环节,主要进行细胞DNA的解旋和复制,我们前期实验发现,120 Jm/cm2的4次UVB照射使小鼠FBs发生显著的S期阻滞现象[4],大量细胞堆积于S期,使发生DNA复制、重排、碱基配对错误等概率增加,这既影响细胞正常增殖能力,又容易引起基因表型改变,最终影响FBs在皮肤中正常功能的发挥。本研究检测结果显示,40 μM RO可明显缓解UVB诱导光老化FBs出现的S期阻滞现象,至少使我们更加确认UVB诱导的体外FBs模型的主要靶点之一是S期阻滞,也提示我们针对S期阻滞的干预措施可能是有效逆转或者缓解细胞老化的措施。
细胞周期阻滞,受到诸多调控因子以及包括p53、p21和p16在内的多种抑癌基因复杂而精确的控制,而导致细胞周期阻滞的因素又激活细胞衰老信号通路,造成细胞衰老或凋亡。p19/p53/p21通路作为经典的衰老信号通路之一[18],在细胞的老化和凋亡中起着重要作用。活化的p53蛋白能与DNA接合,促使包括p21蛋白编码基因WAF1/CIP1在内的多个基因的表达,进一步诱导细胞发生周期阻滞甚至凋亡[19],使衰老细胞增殖能力下降[20-21]。本研究中,光老化FBs发生了S期阻滞,衰老通路蛋白p53和p21表达显著升高也符合细胞衰老的生物学特征[9],进一步验证了UVB对SIPS的成功诱导。Western Blot检测显示,40 μM RO可明显降低UVB诱导光老化FBs中p53和p21的高表达,但究竟这两种蛋白成分只是细胞衰老的结果,还是一些作用因子尚需深入研究。
总之,通过本实验笔者发现,RO可下调UVB引起的周期相关蛋白p53和p21的高表达,改善光老化FBs的S阻滞,为了解皮肤光老化的途径和机制提供了一个指标和现象,有可能为临床治疗提出了一种手段。但RO调节周期相关蛋白p53和p21的具体机制及其对光老化细胞其他方面的影响仍需进一步地研究。
[1] Kohl E, Steinbauer J, Landthaler M, et al. Skin ageing[J]. J Eur Acad Dermatol Venereol, 2011,25(8):873-884.
[2] Fisher GJ, Varani J, Voorhees JJ. Looking older: fibroblast collapse and therapeutic implications[J]. Arch Dermatol, 2008,144(5):666-672.
[3] 刘天一, 曾继平. 脂肪来源干细胞在创面愈合和衰老皮肤中的应用[J]. 中国美容整形外科杂志, 2012,23(6):321-324.
[4] Zeng JP, Bi B, Chen L, et al. Repeated exposure of mouse dermal fibroblasts at a sub-cytotoxic dose of UVB leads to premature senescence: a robust model of cellular photoaging[J]. J Dermatol Sci, 2014,73(1):49-56.
[5] Lee YH, Lee NH, Bhattarai G, et al. PPARgamma inhibits inflammatory reaction in oxidative stress induced human diploid fibloblast[J]. Cell Biochem Funct, 2010,28(6):490-496.
[6] Chung JH, Seo AY, Chung SW, et al. Molecular mechanism of PPAR in the regulation of age-related inflammation[J]. Ageing Res Rev, 2008,7(2):126-136.
[7] Gilchrest BA. Photoaging[J]. J Invest Dermatol, 2013,133(E1):2-6.
[8] Varani J. Fibroblast aging: intrinsic and extrinsic factors[J]. Drug Discovery Today: Therapeutic Strategies, 2010,7(3-4):65-70.
[9] 杨清建, 刘天一, 毕 波. 光老化过程中皮肤成纤维细胞的生物学改变[J]. 中国美容整形外科杂志, 2014,25(8):480-483.
[10] Ichihashi M, Ueda M, Budiyanto A, et al. UV-induced skin damage[J]. Toxicology, 2003,189(1-2):21-39.
[11] Svobodova A, Walterova D, Vostalova J. Ultraviolet light induced alteration to the skin[J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2006,150(1):25-38.
[12] Semple RK. PPAR and human metabolic disease[J]. J Clin Invest, 2006,116(3):581-589.
[13] Ahmadian M, Suh JM, Hah N, et al. PPAR gamma signaling and metabolism: the good, the bad and the future[J]. Nat Med, 2013,19(5):557-566.
[14] Blanquart C, Barbier O, Fruchart JC, et al. Peroxisome proliferator-activated receptors: regulation of transcriptional activities and roles in inflammation[J]. J Steroid Biochem Mol Biol, 2003,85(2-5):267-273.
[15] Kim JK, Mun S, Kim MS, et al. 5,7-Dimethoxyflavone, an activator of PPARalpha/gamma, inhibits UVB-induced MMP expression in human skin fibroblast cells[J]. Exp Dermatol, 2012,21(3):211-216.
[16] Flori E, Mastrofrancesco A, Kovacs D, et al. 2,4,6-Octatrienoic acid is a novel promoter of melanogenesis and antioxidant defence in normal human melanocytes via PPAR-gamma activation[J]. Pigment Cell Melanoma Res, 2011,24(4):618-630.
[17] Mastrofrancesco A, Ottaviani M, Aspite N, et al. Azelaic acid modulates the inflammatory response in normal human keratinocytes through PPARgamma activation[J]. Exp Dermatol, 2010,19(9):813-820.
[18] Sperka T, Wang J, Rudolph KL. DNA damage checkpoints in stem cells, ageing and cancer[J]. Nat Rev Mol Cell Biol, 2012,13(9):579-590.
[19] Peters AC, Young LC, Maeda T, et al. Mammalian DNA mismatch repair protects cells from UVB-induced DNA damage by facilitating apoptosis and p53 activation[J]. DNA Repair (Amst), 2003,2(4):427-435.
[20] James A, Wang Y, Raje H, et al. Nucleolar stress with and without p53[J]. Nucleus, 2014,5(5):402-426.
[21] Pietenpol JA, Stewart ZA. Cell cycle checkpoint signaling: cell cycle arrest versus apoptosis[J]. Toxicology, 2002 Dec 27:181-182: 475-481.
Regulation of rosiglitazone in the cell cycle arrest of photoaging fibroblasts
CHENLiang,BIBo,ZENGJi-ping,etal.
(DepartmentofPlasticSurgery,theEastChinaHospitalofFudanUniversity,Shanghai200040,China)
Objective To investigate the influence of rosiglitazone in cell cycle and associated proteins. Methods The influence of rosiglitazone on fibroblasts proliferation was measured by cck-8 assay. After rosiglitazone pretreatment for 48 h, fibroblasts were irradiated by a series of 4 UVB exposures at the dose of 120 mJ/cm2with an interval time of 12 h. The influence of rosiglitazone on fibroblasts cycle was analyzed by flow cytometry and the expressions of cell cycle regulatory proteins p53 and p21 were evaluated by Western Blot 48 h after the last exposure. Results No modification in the proliferative activity of MDFs was observed at any dose tested up to 80 μM after 48 h (P<0.01). The cell cycle arrest in S phase of fibroblasts pretreated with rosiglitazone was 15.9 % less than the UVB group. The expressions of cell cycle regulatory proteins p53 and p21 were decreased by 35.7% and 27.7% respectively compared with UVB group. Conclusion Rosiglitazone could decreased the expressions of p53 and p21, cell cycle regulatory proteins of photoaging fibroblasts, relieve the cell cycle arrest of photoaging fibroblasts caused by UVB, so its application may have some protective effect on photoaging fibroblasts.
Rosiglitazone; Peroxisome proliferator-activated receptor-γ; Photoaging; Fibroblasts; Cell cycle
国家自然科学基金资助项目(81272125;81301642);上海市卫生系统优秀学科带头人培养计划资助项目(XBR2011033);863项目资助项目(SS2014AA020705)
作者单位:200040 上海,复旦大学附属华东医院 整形外科
陈 亮(1988-),男,山东淄博人,硕士研究生.
刘天一,200040,复旦大学附属华东医院 整形外科,电子信箱:tianyiliucn@163.com
10.3969/j.issn.1673-7040.2015.07.019
R977
A
1673-7040(2015)07-0436-05
2015-04-10)

