自然干旱胁迫对米槁生理生化的影响
文爱华 刘济明 王军才 高攀 李丽霞
摘要:以贵州省罗甸县米槁为研究对象,进行盆栽控水自然干旱22 d及复水15 d处理,研究米槁叶片的相对含水量、水分饱和亏、游离脯氨酸含量、可溶性蛋白质含量、可溶性糖含量、淀粉含量、丙二醛(MDA)含量、过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性的变化趋势。结果表明:随着干旱时间的延长,米槁叶片的游离脯氨酸、可溶性蛋白质、可溶性糖、MDA含量在一定范围内都呈明显升高趋势,复水后降低;SOD、POD、CAT变化趋势比较一致,都呈先上升后下降趋势。可见土壤含水量直接影响植物各项生理指标,从而影响植物的正常生长发育。
关键词:米槁;干旱胁迫;生理生化
中图分类号: S567.1+91.1 文献标志码: A 文章编号:1002-1302(2015)07-0257-03
水是植物生长发育重要的环境因子,水分过多或过少对植物生长都不利。据统计,全球每年由旱涝所造成的损失约占自然灾害总损失的60%以上,其中干旱造成的损失量超过其他逆境造成的损失量总和[1]。土壤有效水分匮乏对植物生长影响显著[2-4],因此植物耐旱潜力是植物生理生态学领域的研究热点[5]。研究表明,植物体内可溶性蛋白质大多是参与各种代谢的酶类,在植物受到干旱胁迫时会发生变化;当植物遭受水分胁迫造成生理性缺水时,植物体内脯氨酸(Pro)大量积累;植物细胞内自由基的产生与清除处于动态平衡,一旦该平衡遭到破坏,则自由基积累,丙二醛(MDA)含量增加;超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)等能够有效地清除自由基,是酶促防御系统的重要组成成分[6-11]。米槁(Cinnamomum migao H. W. Li)别称大果木姜子,为樟科樟属高大乔木常绿植物。米槁是贵州省苗族民间常用药物,其名字来源于苗语,异名有麻槁、大果樟等[12]。米槁有逐寒、镇痛、健脾、消饱胀等功效,常用于治疗腹胀、腹痛、晕车呕吐及牛马腹胀等人畜疾病[13-18]。目前对米槁的研究主要集中于其化学成分的分离与鉴定,有关干旱胁迫对米槁生理生化指标影响的研究尚未见报道。笔者以贵州省罗甸县米槁幼苗为研究对象,采用盆栽控水方法对米槁耐旱潜力进行研究,探究干旱胁迫与米槁生理生化指标的相关性,旨在为在贵州省大面积种植米槁提供依据。
1 材料与方法
1.1 材料
选用罗甸县1年生米槁幼苗,带回贵州大学林学院苗圃,采用盆栽方式种植备用(盆口直径为29 cm,深度为40 cm)。盆栽土壤一致,选择长势一致的幼苗进行干旱胁迫试验。
1.2 试验设计
2014年7月将长势一致、无病虫害的30盆幼苗移入隔绝降水的透明大棚,浇透水后采用自然干旱的方法进行干旱胁迫。第2天开始,每次从不同植株上选取中上部同一位置的成熟叶片,将叶片去叶脉后剪碎混合,测定叶片各项生理生化指标。每处理重复3次,设置停水0、7、12、17、22 d自然干旱胁迫处理和复水15 d处理,同时测定叶片各项生理生化指标。
1.3 方法
利用烘干称量法测定叶片相对含水量(RWC)和水分饱和亏(WSD)。采用铝盒环刀法测定土壤含水量。采用硫代巴比妥酸法测定叶片丙二醛)含量[19]。采用酸性茚三酮显色法测定叶片脯氨酸含量。采用蒽酮比色法测定叶片可溶性糖、可溶性淀粉含量。采用考马斯亮蓝G-250与可溶性蛋白质结合染色方法测定可溶性蛋白质含量。分别采用氮蓝四唑(NBT)光还原法、高锰酸钾滴定法[19]、愈创木酚法[20]测定叶片超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)活性。RWC、WSD计算公式如下:
RWC=(叶片鲜质量-叶片干质量)/(叶片饱和鲜质量-叶片干质量)×100%;(1)
WSD=1-RWC=(叶片饱和鲜质量-葉片鲜质量)/(叶片饱和鲜质量-叶片干质量)×100%。(2)
1.4 数据统计与分析
采用SPSS 19.0软件处理数据。
2 结果与分析
2.1 不同干旱胁迫时间米槁叶片含水量的变化
从表1可见,随着胁迫时间的延长,土壤含水量逐渐降低;不同胁迫时间处理下土壤含水量与对照均差异显著;胁迫7 d的土壤含水量与胁迫12 d的土壤含水量差异显著。随着土壤含水量的下降,米槁叶片相对含水量也呈逐渐下降趋势,从98.38%逐渐降至49.25%;胁迫前7 d叶片相对含水量下降趋势较平缓,8~22 d呈显著下降趋势,说明胁迫7 d后土壤含水量已影响植株正常生长,为适应土壤水分减少,叶片相对含水量也相应减少。胁迫7 d水分饱和亏与对照差异不显著,说明土壤含水量可以满足植物的正常需求;胁迫12 d,叶片相对含水量为88.63%,叶片水分饱和亏达11.37%,均与胁迫7 d差异显著;胁迫22 d,叶片严重萎蔫枯黄。进行胁迫后复水发现,复水15 d植株长出新叶片,恢复正常生长,叶片相对含水量达96.21%,水分饱和亏达3.80%。
2.2 不同干旱胁迫时间米槁叶片可溶性糖、淀粉含量变化
干旱条件下,植物可溶性糖含量通常增加,这是植物对干旱胁迫的适应性反应[21]。从图1可见,随着干旱胁迫时间的延长,植物可溶性糖含量呈上升趋势,并且明显高于对照。胁迫22 d,叶片可溶性糖含量达到最大值6.541 mg/g。复水 15 d 叶片可溶性糖含量与对照接近。从图1可以看出,随着胁迫时间的延长,淀粉含量变化呈现先下降后缓慢上升的趋势,胁迫7 d,淀粉含量达到最低值0.243 mg/g,与对照差异明显,复水后叶片淀粉含量与对照基本一致,这可能与淀粉水解酶活性升高、淀粉合成关键酶ADPGPPase活性降低有关[23]。
2.3 不同干旱胁迫时间下米槁叶片可溶性蛋白质、游离脯氨酸含量变化
植物体内可溶性蛋白质主要是指参与代谢的酶类,其含量是衡量植物总体代谢强弱的重要指标。由圖2可见,随着干旱胁迫时间的延长,米槁叶片可溶性蛋白含量呈先上升后下降趋势,胁迫17 d达到最高值460.00 mg/g,随后缓慢下降。复水15 d,叶片可溶性蛋白质含量比对照稍高,此现象与前人研究结果[23]一致。这可能是由于恢复水分后,植物虽有所恢复但可溶性蛋白质参与的部分代谢反应没有彻底恢复。植物在逆境条件脯氨酸会大量积累,其积累指数与植物抗逆性有关[25]。随着干旱胁迫时间的延长,游离脯氨酸含量呈上升趋势。胁迫22 d,叶片游离脯氨酸含量达到最高值 133.09 mg/g;胁迫17~22 d明显上升,这可能与米槁在重度胁迫下的耐受能力有关。胁迫后复水15 d,游离脯氨酸含量基本达到未胁迫时水平。
2.4 不同干旱胁迫时间米槁叶片MDA含量变化
MDA是植物细胞膜脂过氧化作用的最终产物,是膜系统伤害的重要标志之一。由图3可知,随着胁迫时间的延长,米槁叶片MDA含量升高,并且均明显高于未胁迫,胁迫22d,MDA含量达到最高值545.88 nmol/g。胁迫12~22 d,叶片MDA含量明显上升,表明植株受胁迫强度增大,膜的正常功能遭到更严重破坏。复水后,MDA含量有所下降,但比未胁迫时含量高。研究表明,干旱胁迫下,水稻体内MDA含量明显增加[25-26]。
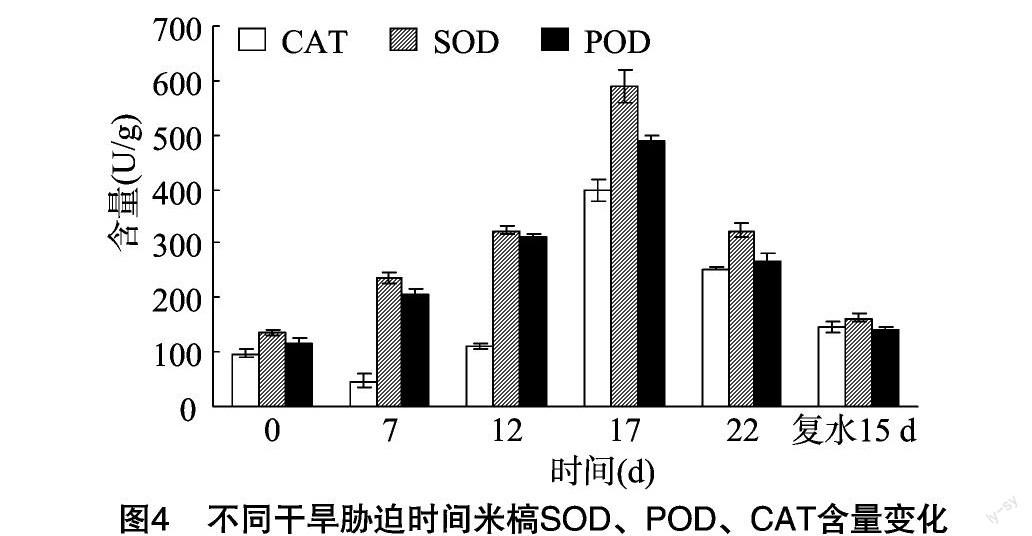
2.5 不同米槁叶片SOD、POD、CAT活性变化
干旱胁迫下,植物抗氧化酶可以通过催化植物体内的活性氧,防止发生过氧化反应。由图4可见,随着胁迫时间的延长,米槁叶片SOD、POD活性变化趋势基本一致,均呈先升高后下降趋势。干旱胁迫17 d之前,随着水分减少,植物体内超氧自由基也会增加,这时植株会通过提高体内SOD、POD活性来保护植株免受伤害。随着胁迫时间的延长,SOD、POD活性达到峰值后又开始下降,表明随着土壤水分的减少,超氧自由基在植物机体内的含量已经超过了植物自身能够清除的范围,因此SOD、POD活性降低,说明米槁对干旱胁迫的抗逆性是有限的。在一定水分胁迫范围内,米槁可通过产生更多的保护酶抵抗干旱胁迫造成的伤害,但当胁迫超出了植物本身所能忍耐的范围时,植物体内的保护酶活性反而会下降。复水15 d,SOD、POD活性均高于对照,这可能是因为经过了一定程度的干旱胁迫后,机体产生了一定的的抵抗能力,抗旱能力提高。CAT活性与SOD、POD活性变化趋势略有不同,CAT活性先下降后上升再下降,胁迫7d出现最低值,随着干旱时间的延长,CAT活性增加。复水后,CAT活性高于未胁迫,这与前人研究结论[27-29]一致。
3 结论与讨论
研究表明,在一定干旱胁迫范围内,随着土壤水分含量的下降,植物叶片各项生理指标也随之改变,在一定程度上反映了植物对干旱胁迫的抗逆性。RWC、WSD能够较好反映植株受胁迫时体内水分状况。本研究结果表明,RWC随着土壤水分含量降低呈现下降趋势。当植物遇到干旱胁迫时,体内会产生一定数量低分子量的代谢产物,以便体内的细胞质渗透压能够维持在较高水平,有利于植物在缺乏水分时吸收水分,植物这种自身调节被称为渗透调节。渗透调节物质主要包括脯氨酸、可溶性糖、可溶性蛋白等[30-31]。本研究结果表明,胁迫17 d,叶片可溶性糖、可溶性蛋白质、游离脯氨酸含量随着胁迫程度的加剧都呈现上升趋势;胁迫22 d,可溶性糖游离、脯氨酸含量均达到峰值,可溶性蛋白质在胁迫17 d达到峰值。植物遭受干旱胁迫时,细胞膜会因发生过氧化作用而受到损伤,膜脂过氧化作用产物之一是MDA,当胁迫超过机体所承受的范围时,植物MDA含量会增加且与细胞内各种成分发生反应,从而使各种酶、膜遭受严重伤害[32]。本研究结果表明,叶片MDA含量随胁迫时间的延长而呈上升趋势;复水后,含量虽有一定程度下降,但较未胁迫前差异明显。这说明在水分胁迫下,植物体内代谢紊乱,导致细胞膜受到损害,MDA积累,一定复水时间内无法恢复到胁迫前水平。植物遭受干旱胁迫时,细胞内会产生造成细胞受伤甚至死亡的生物活性氧,细胞内的保护酶系统等能够清除植物体内的活性氧,使细胞免于受伤,保护酶系统活性增强有利于提高植物抗逆性[33]。胁迫17 d以内,植物SOD、POD活性随胁迫时间延长而提高,以增强植物的抗逆性,随后活性开始下降,说明胁迫程度超出了植物耐受范围,保护酶活性反而下降,说明米槁的耐胁迫能力有限。复水后的酶活性较胁迫前有所提高,这可能是因为经历了一段时间干旱胁迫后,植物产生了一定适应能力,从而提高了其抗旱能力。植物的抗旱能力是复合性状,不但受多个基因控制,而且通过多个途径来实现。本试验是在盆栽环境中进行的,与实际生境有一定差异。因此,对米槁抗旱性进行全面评价时,应当结合实际生境,从生态、生理2个方面考虑,为米槁合理栽培与管理提供准确详细的依据。
参考文献:
[1]华北平原作物水分胁迫与干旱研究课题组. 作物水分胁迫与干旱研究[M]. 郑州:河南科学技术出版社,1991:98-103.
[2]惠竹梅,房玉林,郭玉枝,等. 水分胁迫对葡萄幼苗4种主要生理指标的影响[J]. 干旱地区农业研究,2007,25(3):146-149.
[3]利容千,王建波. 植物逆境细胞及生理学[M]. 武汉:武汉大学出版社,2002:64-67.
[4]张志良,翟伟菁. 植物生理学实验指导[M]. 北京:高等教育出版社,2003:46-48.
[5]张正斌. 作物抗旱节水的生理遗传育种基础[M]. 北京:科学出版社,2003:36-39.
[6]史玉炜,王燕凌,李文兵,等. 水分胁迫对刚毛柽柳可溶性蛋白、可溶性糖和脯氨酸含量变化的影响[J]. 新疆农业大学学报,2007,30(2):5-8.
[7]王云龙,许振柱,周广胜.水分胁迫对羊草光合产物分配及其气体交换特征的影响[J]. 植物生态学报,2004,28(6):803-809.
[8]Ray E A. Molecular response to water delicit[J]. Plant Physiology,1993,103:1035-1040.
[9]Bosabalidis A M,Kofidis G. Comparative effects of drought stress on leaf anntomy of two olive cultivars[J]. Plant Science,2002,163:375-379.
[10]赵家梅,谢双喜. 干旱胁迫和复水对道真润楠幼树生理特性的影响[J]. 贵州农业科学,2013,41(3):116-118,125.
[11]桑子阳,马履一,陈发菊. 干旱胁迫对红花玉兰幼苗生长和生理特性的影响[J]. 西北植物学报,2011,31(1):109-115.
[12]邱德文,杜茂瑞. 贵州苗药大果木姜子研究及产业化[C]//第二次世界中西医结合大会论文摘要集,2002:470-474.
[13]冉先德. 中华药海[M]. 上海:东方出版社,2010:47-50.
[14]梁光义,魏惠芬. 大果木姜子挥发油和脂肪油的研究[J]. 贵阳中医学院学报,1989,5(4):55-60.
[15]梁光义,邱德文,魏慧芬,等. 大果木姜子精油化学成分的研究[J]. 天然产物研究与开发,1992,4(2):67-70.
[16]梁光义,邱德文,魏慧芬,等. 大果木姜子的甘油三酯组成[J]. 天然产物研究与开发,1992,4(4):19-22.
[17]魏慧芬,任永全,贺祝英,等. 大果木姜子精油无机元素的研究[J]. 微量元素与健康研究,1994,12(2):30,18.
[18]Wang H,Nair M G,Strasburg G M,et al. Antioxidant polyphenols from tart cherries (Prunus cerasus)[J]. Journal of Agricultural and Food Chemistry,1999,47(3):840-844.
[19]鄒 琦. 植物生理学实验指导[M]. 北京:中国农业出版社,2000:33-35.
[20]张立军,樊金娟. 植物生理学实验教程[M]. 北京:中国农业大学出版社,2007:26-28.
[21]《植物生理学通迅》编辑部. 植物生理学专题讲座——纪念罗宗洛教授[M]. 北京:科学出版社,1987:323.
[22]陈立松,刘星辉. 水分胁迫对荔枝叶片糖代谢的影响及其与抗旱性的关系[J]. 热带作物学报,1999,20(2):31-36.
[23]池 馨,廖小峰,刘济明,等. 自然干旱胁迫下艾纳香的生理生化特性[J]. 贵州农业科学,2014,42(8):48-51.
[24]党云萍,李春霞,刘东雄. 水分胁迫对植物生理生化研究进展[J]. 陕西农业科学,2012,58(5):89-93,122.
[25]孙骏威,杨 勇,黄宗安,等. 聚乙二醇诱导水分胁迫引起水稻光合下降的原因探讨[J]. 中国水稻科学,2004,18(6):539-543.
[26]晏 斌,戴秋杰,刘晓忠,等. 玉米叶片涝渍伤害过程中超氧自由基的积累[J]. 植物学报,1995,3(9):738-744.
[27]张文辉,段宝利,周建云,等. 不同种源栓皮栎幼苗叶片水分关系和保护酶活性对干旱胁迫的响应[J]. 植物生态学报,2004,28(4):483-490.
[28]范苏鲁,苑兆和,冯立娟,等. 干旱胁迫对大丽花生理生化指标的影响[J]. 应用生态学报,2011,22(3):651-657.
[29]谢志玉,张文辉,刘新成.干旱胁迫对文冠果幼苗生长和生理生化特征的影响[J]. 西北植物学报,2010,30(5):948-954.
[30]孙 群,胡景江.植物生理学研究技术[M].杨凌:西北农林科技大学,2006.
[31]何 淼,李文鹤,卓丽环.野菊幼苗对自然干旱胁迫的生理响应[J]. 草业科学,2011,28(8):1456-1460.
[32]张朝阳,许桂芳,向佐湘.干旱胁迫对4种常绿藤本植物抗性生理生化指标的影响[J]. 江西农业学报,2008,20(12):42-45.
[33]孙国荣,彭永臻,阎秀峰,等. 干旱胁迫对白桦实生苗保护酶活性及脂质过氧化作用的影响[J]. 林业科学,2003,39(1):165-167.

