南方红豆杉假种皮变异品系的鉴定及生理生化特性
徐敏 王忠 秦亚龙 何树兰 朱波风 陆波 仲秀林 彭峰

摘要:以假种皮自然变异为黄色的南方红豆杉及其原种为对象,结合ITS序列分析变异品系与近缘类群的亲缘关系,并对变异品系和原种的部分生理生化指标进行比较。ITS序列比对结果显示,变异品系和原种的遗传距离最近,且在遗传进化树上聚为一类,表明黄色假种皮的南方红豆杉由红色假种皮的南方红豆杉自然变异而来。除可溶性糖含量外,变异品系叶片中紫杉醇和丙二醛的含量,SOD、CAT、POD、PAL等酶的活性均显著或极显著高于原种,其中变异品系中紫杉醇的含量是原种的1.7倍。研究结果可为红豆杉属植物品种的鉴定以及红豆杉新品种的选育提供重要依据。
关键词:南方红豆杉;原种;变异品系;生理生化特性
中圖分类号:S791.490.4 文献标志码: A 文章编号:1002-1302(2015)07-0193-04
南方红豆杉别称美丽红豆杉,是亚热带常绿阔叶林、常绿与落叶阔叶混交林的特征种,为我国特有的树种且是分布面积最广的红豆杉[1-2]。南方红豆杉木材结构细腻且坚实耐腐[3];种子出油率高且含大量蛋白质、脂肪、总糖等,可作工业用途[4];其枝、叶、根均可提取紫杉醇等生物原料,对卵巢癌、肺癌等癌症有较好的疗效[5];此外,南方红豆杉外观造型独特,是四季常青的鲜艳绿色,种子成熟时鲜红饱满,鲜红色的假种皮与绿叶相映成趣,美观异常,是不可多得的高档绿化树种和盆栽植物材料[6]。可以说南方红豆杉是集药用、材用、观赏于一身的重要资源植物和珍稀树种,具有极高的开发利用价值。
红豆杉属植物有9个种[7],虽然其原种数量有限,但由于栽培历史悠久,目前世界范围内已选育200余个品种。其中,欧洲红豆杉的栽培品种最多,有近100种,另外杂种红豆杉的栽培品种也比较多,有50余种,剩余9种红豆杉的栽培品种之和有50余种,很多红豆杉种没有选育出栽培品种[8]。与世界各国相比,我国红豆杉属植物的新品种选育进程缓慢,可以说在红豆杉属植物的品种选育研究方面我国尚属空白。笔者所在的课题组在江苏无锡近2 000 hm2的南方红豆杉群体中发现一自然变异品系,该品系成熟后的假种皮为金黄色,经过多年观察发现该性状表现稳定。因此,笔者对其进行了系统的研究,以期为南方红豆杉的新品种选育奠定基础。
1 材料与方法
1.1 供试材料
红色及黄色假种皮的南方红豆杉试材取自江苏省无锡市红豆杉生物科技股份有限公司红豆杉种质资源圃,所取试材的变异品系与原种南方红豆杉有相同的生境和株龄;其他红豆杉树种(包括曼地亚红豆杉、须弥红豆杉、密叶红豆杉、欧洲红豆杉、东北红豆杉)的试材均取自南京中山植物园红豆杉种质资源圃。
1.2 ITS序列的分离与分析
总DNA提取采用植物基因组快速提取试剂盒(北京百泰克生物技术有限公司),1.0%琼脂糖凝胶电泳检测DNA纯度,-20 ℃保存备用。
1.2.1 ITS序列的分离与测定 PCR扩增反应总体积 20 μL,反应体系为:10 ng DNA模板、50 ng正反向引物、2.5 mmol/L dNTPs、10×PCR buffer、0.25 U/μL Taq DNA聚合酶。扩增程序为:94 ℃预变性5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,共35个循环;72 ℃延伸10 min,10 ℃保温。引物为上海生物工程技术有限公司合成的ITS通用引物,ITS-5:5′-GGAAGTAAAAGTCGTAACAAGG-3′,ITS4:5′-TCCTCCGCTTATTGATATGC-3′。扩增产物经Biotek多功能 DNA纯化回收试剂盒纯化后送往上海美吉生物医药科技有限公司测序。
1.2.2 ITS序列比对 测序结果通过软件MEGA 5.05分子进化遗传分析软件中的CLUSTALW 对序列进行排列并人工校正,采用邻接法构建NJ系统树,其中各个分支的置信度用自展检验法检验,共进行2 000次循环,评价各分支系统学意义与可靠性。以红豆杉科穗花杉为外类群(GenBank 序列号为AF259285.1)进行分析。
1.3 生理指标的测定
参考王学奎的方法[9]进行SOD、POD、CAT活性和MDA含量的测定,参照李乃伟等的方法[10]进行可溶性糖和紫杉醇含量的检测,参照Yuan等的方法[11]测定PAL活性。以上各项生理生化指标的测定均进行3次重复,取平均值,数据用Graphpad Prism 5.0软件分析作图完成。
2 结果与分析
2.1 基于ITS序列分析变异品系与近缘类群的亲缘关系
取样品的新鲜枝叶提取总DNA,用ITS的通用引物进行PCR扩增(图1)。由电泳结果可以看出,所得到的ITS区长度在1 200 bp左右(包括全部的ITS1、ITS2、5.8S rDNA和部分18S rDNA、28S rDNA)。根据GenBank中已报道的须弥红豆杉rDNA的ITS序列(GenBank中编号为EF660577.1)确定各个红豆杉ITS序列(ITS1、5.8S、ITS2)的边界。ITS1区长727~730 bp、5.8S区长162 bp、ITS2区长224~225 bp。其中,ITS1含有21个可变位点,5.8S区高度保守,ITS2区含有
15个可变位点。综合考虑到ITS1区的信息量较大,因此最终用ITS1区构建NJ系统树,并计算各个种之间的遗传距离。
从表1可以看出,红豆杉科红豆杉属内的遗传距离较小,与外类群穗花杉的遗传距离较大。其中,黄色假种皮南方红豆杉与南方红豆杉原种的遗传距离为0,与中国红豆杉遗传距离为0.010,与须弥红豆杉遗传距离较远,其次是曼地亚红豆杉。从图2的NJ聚类图中可以看出,黄色假种皮与红色假种皮南方红豆杉分支的置信度高达98%。以上分析结果均表明,黄色假种皮南方红豆杉系由南方红豆杉原种自然变异而成。
2.2 生理分析
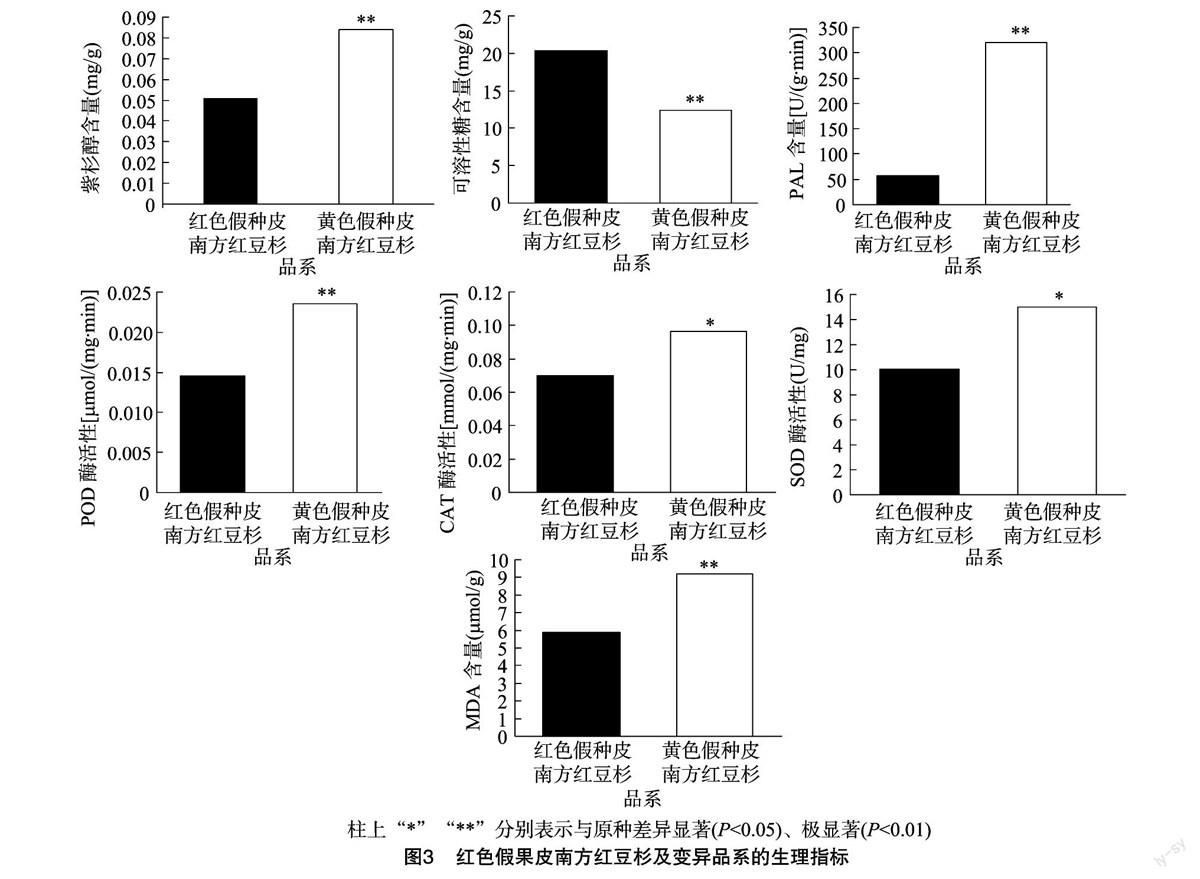
2.2.1 紫杉醇及可溶性糖含量的比较 紫杉醇是Wani等首次从短叶红豆杉树皮中分离得到的一种重要的次生代谢产物[12]。临床可用于治疗卵巢癌、肺癌、膀胱癌、子宫癌及AIDS相关的Karposis肉瘤等,是目前应用最广泛的天然抗癌药物之一[5]。笔者用HPLC方法测定了新鲜叶片中紫杉醇的含量,结果发现南方红豆杉变异品系的紫杉醇含量是南方红豆杉原种中紫杉醇含量的1.7倍(图3)。
可溶性糖在植物体内属于初级代谢产物,对细胞膜和原生质胶体有稳定作用,也是合成某些有机溶质的碳架和能量来源,还可在细胞内无机离子浓度高时起保护酶类的作用[13]。植物进行光合作用合成可溶性糖等有机物质,首先在植物葉片中积累,为自身营养物质的形成做准备。在本研究中,南方红豆杉原种中可溶性糖的含量是变异品系的1.6倍,达到了极显著的差异水平。
2.2.2 酶活性及MDA含量的分析 过氧化物酶、过氧化氢酶、超氧化物歧化酶一起构成了生物体内重要的抗氧化保护系统,从而维护生物体内正常的生理代谢和生化反应[14]。苯丙氨酸解氨酶是植物体内苯丙烷类代谢途径中的关键酶,与植物体内的木质素、异黄酮类植保素和黄酮类色素等多种次生物质的生物合成有密切关系[15]。而MDA是膜脂过氧化的主要产物之一,它的含量可以反映脂膜过氧化作用水平和膜的受损情况[16]。在本研究中,南方红豆杉原种的POD、CAT、SOD、PAL的活性和MDA的含量均明显低于变异品系,其中PAL和POD的活性以及MDA的含量达到极显著的差异水平。
3 结论与讨论
红豆杉属植物成熟的种皮颜色一般为红色,迄今为止,在红豆杉属下的11个种中仅在欧洲红豆杉中发现了黄色假种皮的变异品种Taxus baccata var. lutea。笔者所在的课题组在近 2 000 hm2的南方红豆杉种群中经过多年的观测,发现了6株黄色假种皮变异品系且其性状稳定。目前关于假种皮的研究多集中于姜、象牙参及拟豆蔻等作物上,且主要集中在解剖
学和组织化学层面,红豆杉假种皮色素的研究尚未见有系统报道。在种皮的色素研究中,Theander等认为影响种皮色泽的主要原因是可溶性花色素的积累,而凝聚多酚是引起黄籽、黑籽种皮差异的主要原因[17];还有研究认为,黄籽、黑籽种皮颜色的差异主要与多酚、类黄酮和花色素有关,而黑色素对成熟种子的种皮颜色有决定作用[18-20];此外,梁银等认为,PAL、PPO、SOD是种皮呈现不同颜色的关键因素[21-22]。这些机理初步解释了种皮色素差异的原因,但是否与红豆杉假种皮色素的形成有关还有待于进一步研究证实。
ITS是核糖体rDNA中介于18S与5.8S之间的ITS1、5.8S 与28S之间的ITS2的非编码转录间隔区,由于其片段长度适中、进化速率快且在基因组不同重复单元间高度一致的特点,已被广泛用作研究系统发育、进化及分类鉴定的分子指标来分析较低分类单元层次上的植物系统发育问题[23-24]。本研究以红豆杉属植物的7个种为材料,扩增得到了其相应的ITS序列。系统进化树结果表明,ITS的序列信息能很好地分辨出不同的红豆杉树种。遗传进化树显示,黄色假种皮与红色假种皮南方红豆杉分支的置信度最高,表明两者亲缘最近,从分子水平上进一步证明其属于同一个种,即黄色假种皮南方红豆杉由南方红豆杉原种自然突变而来。另外,须弥红豆杉原变种与南方红豆杉和红豆杉并没有聚为一类,这与经典分类的结果不一致,须结合其他方法进一步研究。
紫杉醇作为红豆杉最重要的次生代谢产物,其研究在生物合成、代谢调控等方面取得了很多成果。研究已证实,在不同种的红豆杉植株中紫杉醇含量存在差异。王玉震认为,密叶红豆杉枝叶的紫杉醇含量最高,其次为红豆杉和东北红豆杉,南方红豆杉枝叶的紫杉醇含量最低[25]。但研究的结果也存在很多不同,主要是因为树龄、地理位置、环境条件以及测定方式的不同会直接影响到紫杉醇含量的差异。本研究结果显示,黄色假种皮南方红豆杉枝叶中的紫杉醇含量是南方红豆杉原种中的1.7倍,这与前人研究曼地亚红豆杉不同品种的紫杉醇含量有差异是一致的,但紫杉醇在植株体内代谢的复杂性使得目前尚未能清楚解释原因。可溶性糖在植物中主要以蔗糖、葡萄糖、果糖和半乳糖等形式存在,是植物进行光合作用后的初级代谢产物。鲍思伟等研究发现,较高强度的光照有利于曼地亚红豆杉叶片可溶性糖的积累,并增加植株体内紫杉醇的含量[26]。但在本研究中,可溶性糖含量却与紫杉醇含量刚好相反,这与李乃伟等“紫杉醇含量与可溶性糖含量呈极显著负相关”的结果[27]一致。
植物体内各种酶的活性在生长发育过程中是不断发生变化的,酶活性的强弱直接反映了代谢能力及植株抗逆性能力的大小[28]。在油橄榄、梨树、小麦等植物上已经证实,不同的种和品种之间的酶活性存在差异,最终造成产量及抗性不同[16,29-30]。关于红豆杉方面的研究主要是集中在不同光照强度、水肥条件及UV-B辐射处理后的酶活性变化上[13,26-27,31],有关红豆杉种和品种的酶活性比较尚未见报道。本试验结果发现,假种皮自然变异为黄色的南方红豆杉叶片的酶(包括POD、CAT、SOD、PAL)活性以及MDA含量均显著或极显著高于红色假果皮南方红豆杉,说明黄色假种皮南方红豆杉的代谢速度快于红色假种皮南方红豆杉,并使得紫杉醇的含量也呈现较高水平。鲍思伟等研究发现,遮阴(70%透光率)条件下的红豆杉幼苗叶片中的SOD、POD、CAT活性均较自然光高,紫杉醇的含量也高[26,32];Hector等则认为,PPO和POD的活性直接影响紫杉醇的代谢[33-34];余龙江等发现,紫杉醇产量随着PAL活性上升而相应提高,PAL活性迅速升高可作为与紫杉醇是否被诱导大量合成的生理指标[35]。本试验的结果与上述研究结果较一致,即酶的活性高,紫杉醇的含量也呈现较高的水平。但也有不同的研究结果显示,紫杉醇含量与MDA含量呈极显著负相关[27]。UV-B 辐射处理后,紫杉醇含量显著增加,SOD、POD活性不变,而CAT活性显著减弱[31]。笔者推测,这是因为影响植物体内酶活性的因素较多,如酶易失活,提取检测的方式方法的差异,外界环境因素如pH值条件、温度等对酶的活性也有较大的影响。此外,这些结果也再次表明紫杉醇在植株体内代谢步骤繁多且机理复杂。在后续的研究中,将集中在色素代谢途径是否对紫杉醇代谢途径有影响,这有助于从一个新的角度理解紫杉醇代谢的分子机理。
参考文献:
[1]吴家森,张立钦,吴进才,等. 南方红豆杉幼苗营养元素质量分数与分布[J]. 浙江林学院学报,2008,25(2):195-199.
[2]Bao W K,Chen Q H. Present status,problems,and further development strategies on natural Taxus resource and their exploitation in China[J]. Journal of Natural Resources,1998,13(4):375-380.
[3]张宏意,陈月琴,廖文波. 南方红豆杉不同居群遗传多样性的RAPD研究[J]. 西北植物学报,2003,23(11):1994-1997.
[4]章旭红,章碎新. 文成县野生南方红豆杉资源保护与可持续利用探讨[J]. 安徽农学通报,2010,16(10):183,194.
[5]余响华,邵金华,袁志辉,等. 植物细胞工程技术生产紫杉醇研究进展[J]. 西北植物学报,2013,33(6):1279-1284.
[6]蒲恩利,蒲格霞. 红豆杉盆景养护与室内环境改善[J]. 吉林林业科技,2010,39(2):43-44.
[7]Fu L G,Li N,Robert R M. Taxaceae[M]//Flora of China:4. Beijing:Science Press,1999:89-96.
[8]杨玉林,宋学东,董京祥,等. 红豆杉属植物资源及其世界分布概况[J]. 森林工程,2009,25(3):5-10.
[9]王学奎. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2000:167-280.
[10]李乃伟,束晓春,张明霞,等. 土壤含水量对红豆杉紫杉醇含量及相关生理指标的影响[J]. 南京林业大学学报:自然科学版,2011,35(3):75-78.
[11]Yuan Y J,Li C,Hu Z D,et al. Signal transduction pathway for oxidative burst and taxol production in suspension cultures of Taxus chinensis var. mairei induced by oligosaccharide from Fusarium oxysprum[J]. Enzyme and Microbial Technology,2001,29(6/7):372-379.
[12]Wani M C,Taylor H L,Wall M E,et al. Plant antitumor agents. Ⅵ. The isolation and structure of taxol,a novel antileukemic and antitumor agent from Taxus brevifolia[J]. Journal of the American Chemical Society,1971,93(9):2325-2327.
[13]龐海河. 增强UV-B辐射下南方红豆杉形态、结构及代谢的研究[D]. 哈尔滨:东北林业大学,2010:52-54.
[14]郭盈添,范 琨,白 果,等. 金露梅幼苗对高温胁迫的生理生化响应[J]. 西北植物学报,2014,34(9):1815-1820.
[15]张继栋,曹锦萍,乔爱民,等. 香石竹DcPAL1基因的克隆及其原核表达[J]. 西北植物学报,2012,32(4):657-664.
[16]李自龙,徐雪风,焦 健,等. 不同品种油橄榄离体叶片对渗透胁迫的生理响应及其抗旱机制[J]. 西北植物学报,2014,34(9):1808-1814.
[17]Theander O,Aman P,Miksche G E,et al. Carbohydrates, polyphenols, and lignin in seed hulls of different colours from tumip rapeseed[J]. J Agric Food Chem,1977,25(2):270-273.
[18]Ana M J,Ankica K S,Dejana S P,et al. Phenotypic and molecular evaluation of genetic diversity of rapeseed (Brassica napus L.) genotypes[J]. African Journal of Biotechnology,2009,8(19):4835-4844.
[19]曲存民. 甘蓝型油菜种皮色泽形成机理研究[D]. 重庆:西南大学,2012:1-4.
[20]史仕军,吴江生. 甘蓝型油菜黄籽粒色性状研究[J]. 华中农业大学学报,2003,22(6):608-612.
[21]梁 颖,李加纳. 甘蓝型油菜种皮色泽形成与相关酶及蛋白质含量的关系[J]. 中国农业科学,2004,37(4):522-527.
[22]罗体英,唐 容. 甘蓝型黄籽油菜种皮色素分析研究[J]. 种子,2010,29(7):95-98.
[23]何 文,张 静,黄智林,等. 基于ITS序列对栽培中国樱桃遗传多样性及其群体遗传结构的分析[J]. 西北植物学报,2014,34(3):463-472.
[24]狄红艳,骆 凯,张吉宇,等. 基于ITS和trnL-trnF序列的草木樨种群遗传多样性研究[J]. 西北植物学报,2014,34(2):265-269.
[25]王玉震. 叶面和根部施肥对南方红豆杉针叶紫杉醇和10-DAB含量的影响[D]. 福州:福建师范大学,2009:7-12.
[26]鲍思伟,谈 锋. 不同光强对曼地亚红豆杉生长及生理代谢的影响[J]. 江西林业科技,2009,2(1):11-13,26.
[27]李乃伟,汪 庆,束晓春,等. 营养胁迫对曼地亚红豆杉生长与生理指标及紫杉醇含量的影响[J]. 江苏农业科学,2010(4):193-195.
[28]黄夕洋,李翠兰,李 锋,等. 曼地亚红豆杉春梢生长过程生理生化变化研究[J]. 广西植物,2009,29(6):842-845,805.
[29]李甲明,杨志军,张绍铃,等. 不同梨品种果实有机酸含量变化与相关酶活性的研究[J]. 西北植物学报,2013,33(10):2024-2030.
[30]马 丽,康 洁. 2个小麦新品种生理生化特性的研究[J]. 中国农学通报,2012,28(12):39-43.
[31]Zu Y G,Pang H H,Yu J H,et al. Responses in the morphology,physiology and biochemistry of Taxus chinensis var. mairei grown under supplementary UV-B radiation[J]. Journal of Photochemistry and Photobiology B-Biology,2010,98(2):152-158.
[32]蘆站根,周文杰,赵昌琼. 不同光强对曼地亚红豆杉抗寒性的影响[J]. 植物研究,2003,23(3):285-289.
[33]Hector B,Yue L Z,Consuelo S,et al. Increase of taxol production in Taxus globosa shoot callus by chlorocholine chloride[J]. Open Nat Prod J,2009,2:33-37.
[34]Ajikumar P K,Xiao W H,Tyo K E,et al. Isoprenoid pathway optimization for taxol precursor overproduction in Escherichia coli[J]. Science,2010,330(60):70-74.
[35]余龙江,蔡永君,兰文智. 红豆杉细胞周期时相与紫杉醇诱导合成的关系初探[J]. 武汉植物学研究,2001,19(6):509-512.

