植物土传疾病拮抗菌的筛选及其生防潜力评价
王雅雅 付瑞敏 于烽 陈五岭


摘要:通过筛选出对植物土传疾病具有良好拮抗效果的菌株BS-17,对其生防效果进行测定,旨在为开发植物土传疾病广谱抗菌生物制剂提供一定依据。采用平板对峙法,筛选出对9种常见植物土传疾病具有拮抗效果的拮抗菌,抑菌率均在80%以上。利用形态学、生理生化及分子生物学的方法对其进行了鉴定,并对拮抗物质产生的位置以及性质进行初步研究;通过土壤定殖试验对其生防潜力作出评价。通过形态学、生理生化及分子生物学的方法鉴定菌株BS-17为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。该菌产生的主要抗菌物质分布于胞外,拮抗物质对热、pH值、紫外线以及蛋白酶均不敏感。此外,菌株BS-17具有较好的产纤维素酶及蛋白酶的能力。土壤定殖试验证明,该菌表现出良好的定殖能力以及抑制病原菌生长的能力。菌株BS-17作为生防菌用于防治植物土传疾病,具有较好的开发和利用价值。
关键词:土传疾病;拮抗菌;生防制剂;纤维素酶;蛋白酶;土壤定殖
中图分类号:Q939.92 文献标志码: A 文章编号:1002-1302(2015)07-00102-05
土传病害种类很多,目前已经发现的病害有100多种,其中危害比较严重的有50余种[1]。土传病害发生严重时难以控制会导致作物减产甚至绝收[2-3]。目前,对于土传病害主要采用轮作倒茬和化学农药的方法进行防治[4]。但由于土地资源有限以及化学农药防效差,因而寻求新的防治土传病害的途径已变得尤为重要。利用拮抗微生物防治作物土传疾病病原菌生长繁殖,不仅能从源头有效防治土传病害,也是一种符合微生态原理的安全可靠的方法[5]。
生物防治由于其对人畜安全,环境友好,并且不易引起病菌抗药性的产生,因而备受人们的关注[6]。目前,已报道的作为生防菌的主要微生物有芽孢杆菌、假单胞菌和链霉菌等[7-9]。生防细菌能够通过自然竞争实现低毒、无污染、高效、稳定的生物防控[10]。目前,用于抑制常见土传疾病的广谱抗菌效果的生防菌报道并不多见,通过筛选出具有广谱高效抑制土传疾病的生防菌并应用于实际防治中,具有十分重要的意义。从陕西阎良大棚甜瓜种植区以及陕西周至、眉县猕猴桃田间所取的根际土壤样品中分离出对常见的植物土传疾病病原菌均具有良好拮抗效果的菌株,通过对其拮抗物质产生部位以及性质、土壤定殖情况研究来评价其生防潜力,旨在为开发各种生防制剂用于土传疾病的实际防控奠定一定基础。
1 材料与方法
1.1 菌种
拮抗菌:从陕西阎良地区甜瓜种植大棚及陕西周至、眉县猕猴桃田间所取的植物根际土壤样品中分离筛选出。
病原菌:葡萄灰霉病(Botrytis cinerea Pers)、甜瓜叶枯病(Alternariacucumerina (Ell. et Ev.) Elliott.)、辣椒疫病(Phytophthora capsici)、黄瓜枯萎病(Cucumber fusarium Wilt)、番茄青枯病(Ralstonia solanacearum)、桃根霉病菌(Rhizopus sp.)、小麦曲根霉(Rhizopustritici sp.)、甘蓝黑腐病(Xanthomonas campestris pv. campestris)、猕猴桃白纹羽病(Dematophora nectatrix),西北大学农业及环境微生物技术工程实验室保存。
1.2 培养基
PDA培养基、牛肉膏蛋白胨培养以及LB培养基配方参照《微生物学实验》[11]。纤维素培养基:MgSO4·7H2O 0.25 g、KH2PO4 0.5 g、琼脂 20.0 g、羧甲基纤维素钠(CMC-Na)2.0 g、刚果红染料 0.2 g、蒸馏水1 000 mL,pH值7.0。酪素培养基:干酪素 4.0 g、ZnCl2 0.14 g、NaCl 0.16 g、CaCl2 0.002 g、MgSO4·7H2O 0.5 g、FeSO4 0.002 g、Na2HPO4·7H2O 1.07 g、酪素水解液0.05 g、KH2PO4 0.36 g、琼脂 20.0 g、蒸馏水1 000 mL,pH值 6.5~7.0。
1.3 菌株分离与拮抗菌筛选
将取自各地的植物根际土壤样本混合均匀,采用平板稀释涂布法[12]进行分离,32 ℃倒置培养,将分离的菌株编号保存。采用平板对峙法,以甜瓜叶枯病为靶标筛选拮抗菌,相距2.5 cm处接种待筛菌株,28 ℃倒置培养3 d,重复3次试验,以抑菌圈的大小作为筛选标准。待对照组未接拮抗菌的平板长满病原菌,测量各试验组的病原菌生长半径r2,以对照组生长半径为r1,则抑菌率=(r1-r2)/r1×100%。以抑菌率大小作为平板拮抗菌拮抗能力强弱的标准,保存所得复筛菌株。
1.4 拮抗菌的鉴定
1.4.1 形态学鉴定及生理生化鉴定 通过对拮抗菌进行显微镜下形态、菌落形态的观察,以及生理生化指标测定,参照《常见细菌系统鉴定手册》[13]对拮抗菌进行鉴定。
1.4.2 分子生物学鉴定 细菌基因组总DNA的提取参照《微生物学实验》,PCR扩增引物序列正向引物为:5′-AGAGTTGATCCTG-GCT-CAGAACGAACGCT-3′,反向引物为:5′-TACGGCTACCTTGTTAC-GACTTCACCCC-3′。扩增条件:95 ℃预变性5 min;95 ℃ 1 min,56 ℃ 1 min,72 ℃ 2 min,30个循环;72 ℃ 10 min,然后送生物公司进行测序。将所得序列在NCBI利用Blast进行序列相似性比对分析,然后利用MEGA 5.0软件构建系统发育树。
1.5 抑菌谱的测定
以9种土传疾病的病原为靶标,采用平板对峙法,测定拮抗菌的抑菌谱。每组试验重复3次,28 ℃恒温培养,待对照组病原菌铺满平板,计算各组抑菌率大小。
1.6 拮抗物质存在位置的确定
1.6.1 无菌发酵液的检测 将分离筛选得到的拮抗菌 BS-17 接种到NA液体培养基中,32 ℃ 170 r/min培养72 h,12 000 r/min 离心10 min,收集上清液。以0.22 μm过滤器过滤即为无菌发酵液,以杯碟法对无菌发酵液的拮抗活性进行检测。
1.6.2 细胞提取物的检测 将拮抗菌BS-17接种到NA液体培养基中,32 ℃ 170 r/min培养48 h,备用。采用康为世纪生物科技公司革兰氏阳性菌蛋白抽提试剂盒(目录号:CW0890)对拮抗菌BS-17进行胞内物质提取。提取过程:拮抗菌发酵液3 000 g、4 ℃下离心5 min,以500 mg菌体加入500 μL抽提试剂使菌体重悬,冰上孵育20 min,12 000 r/min离心10 min,取上清。0.22 μm过滤器过滤,以杯碟法对细胞提取物的拮抗活性进行检测。
1.7 抑菌物质的性质研究
1.7.1 拮抗物质对热稳定性 按照“1.6.1”节的方法制备无菌发酵液,取10 mL于7支试管中,分别在温度为0、20、40、60、80、100、121 ℃下处理30 min,然后以0.22 μm过滤器过滤。以杯碟法检测其拮抗活性,以抑菌率作为指标。
1.7.2 拮抗物质对酸碱稳定性 按“1.6.1”节方法制备无菌发酵液,取10 mL于7支试管中,分别在pH值3、4、5、6、7、8、9下处理2 h,再调节发酵液为初始pH值,以 0.22 μm 过滤器过滤。以杯碟法检测其拮抗活性,以抑菌率作为指标。
1.7.3 拮抗物质对紫外线敏感性 按照“1.6.1”节的方法制备无菌发酵液,取10 mL于7支试管中,分别在40 W紫外灯下照射0、2、4、6、8、10、12 h,然后以0.22 μm过滤器过滤。以杯碟法检测其拮抗活性,以抑菌率作为指标。
1.7.4 拮抗物质对蛋白酶的稳定性 按照“1.6.1”节的方法制备无菌发酵液,取10 mL于4支试管中,分别加入蛋白酶K、胰蛋白酶、胃蛋白酶、木瓜蛋白酶在恒温37 ℃下处理1 h,然后以0.22 μm过滤器过滤。以杯碟法检测其拮抗活性,以抑菌率作为指标。
1.8 BS-17产纤维素酶、蛋白酶活性研究
1.8.1 BS-17产纤维素酶及蛋白酶平板检测 纤维素酶平板检测:将拮抗菌BS-17接种于纤维素平板上,32 ℃培养 72 h,观察有无透明圈,若出现透明圈,则说明有纤维素酶的存在,反之,则说明无纤维素酶。
蛋白酶平板检测:将拮抗菌BS-17接种于酪素培养基平板上,32 ℃培养72 h,观察有无透明圈,若出现透明圈,则说明有蛋白酶的存在,反之,则说明无蛋白酶。
1.8.2 BS-17产纤维素酶及蛋白酶活力检测 粗酶液的制备:将拮抗菌BS-17接种于NA液体培养基,放置于37 ℃、170 r/min摇床中培养,发酵液4 000 r/min离心取上清,为粗酶液。分别从2 d开始,每隔1 d测定一次直至7 d。
纤维素酶活力测定采用3,5-二硝基水杨酸比色定糖法(DNS)测定酶解液中还原糖含量。具体如下:加入含1%CMC-Na柠檬酸缓冲液稀释酶液,每0.5 mL粗酶夜加入 1.5 mL 缓冲液,50 ℃水浴30 min,加入3 ml DNS试剂,沸水浴5 min,迅速冷却并于540 nm处测定其吸光度。在上述条件下,每分钟酶液催化纤维素水解生成1 μg葡萄糖所需的酶量为1个酶活性单位(U)。葡萄糖标准曲线见图1。
蛋白酶活性测定:采用福林法测定蛋白酶的活性,参照SB/T 10317—1999《蛋白酶活力测定法》,酶活定义为:1 mL 发酵液在40 ℃ 和 pH 值7.2条件下,1 min水解酪蛋白产生 1 μg 酪氨酸为1个酶活单位。酪氨酸标准曲线见图2。
1.9 土壤定殖能力测定
1.9.1 双抗法标记菌株 采用抗利福平和抗病原菌双抗法标记拮抗菌BS-17,将菌株BS-17接种到含5 μg/mL利福平的NA培养基上,逐步筛选出能够在300 μg/mL利福平的NA培养基稳定生长且对病原菌拮抗效果较之前相同的BS-17突变菌株。
1.9.2 定殖试验 孢子悬液制备:以甜瓜叶枯病病原菌为靶标,接种于PDA培养基上,倒置于28 ℃恒温培养箱中培养 4 d,以无菌水冲洗菌落表面,经双层灭菌纱布过滤,利用血球计数板计数,以无菌水配置成8.0×104 CFU/mL的病原菌孢子悬液,备用[14]。
菌悬液制备:将BS-17突变株接种于装有5 mL生理盐水的比浊管中,振荡均匀,采用麦氏比浊仪测定其菌体浓度,取0.5麦氏的菌悬液备用,即浓度为1×108 CFU/mL。
将取自甜瓜大棚种植区内同一地点的健康土分成3组,分别做如下处理:接种甜瓜叶枯病病原菌,病原菌孢子悬液接种量为 1×108 CFU/g;接种拮抗菌BS-17突变株,接种量为 1×108 CFU/g;未接种病原菌以及拮抗菌BS-17的健康土。
试验组设置如下:将200 g接种病原菌的病土与BS-17突变菌菌悬液进行混合,使BS-17菌体接种量为1×108 CFU/g;以加入相同体积的生理盐水的病土为对照组;拮抗菌BS-17浓度为1×108 CFU/g健康土。放置于温度为 30 ℃ 恒温培养箱,每试验组平行3次,测定初始各实验组中病原菌以及拮抗菌BS-17的菌体浓度,然后每3.5 d测定1次菌体数目的变化情况。
1.9.3 定殖情况检测 每隔3.5 d取各试验组10 g土于 90 mL 装有灭菌玻璃珠的无菌水中,震荡均匀,采用梯度稀释法,配制不同浓度菌悬液,分别取1 000 μL涂布于含 300 μg/mL 利福平的NA培养基,对菌株BS-17数量进行统计,以血球计数法对病原菌进行统计,观察BS-17菌的定殖情况。
2 结果与分析
2.1 菌株分离与拮抗菌筛选
从采集的土样中分离出了289株菌,其中43株菌具有拮抗效果,抑菌圈直径较明显的有18株菌,分别命名为BS-1至BS-18。抑菌率在50%以上的拮抗菌有9株,其中BS-17抑菌效果最佳,并且性质稳定(表1)。经过10次传代培养后,抑菌效果无明显变化;因此,将BS-17用作后续研究。
2.2 拮抗菌BS-17的鉴定
2.2.1 形态学及生理生化鉴定 利用梯度稀释法获取菌株单菌落,BS-17单菌落形态表现为菌落呈白色不透明、边缘不整齐、表面褶皱,中间可形成近圆形褶皱。革兰氏染色呈阳性,杆状,产芽孢,菌株的淀粉反应呈阳性。
2.2.2 BS-17菌株16S rDNA序列分析 将BS-17菌株16S rDNA测序序列与GenBank数据库中数据进行比对,利用MEGA 5.0软件构建系统发育树(图3)。结果表明,菌株BS-17与已知解淀粉芽孢杆菌的同源性为99%,结合形态学及生理生化鉴定,将菌株BS-17鉴定为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
2.3 抑菌谱的测定
采用平板对峙法,以常见的9种植物土传疾病的病原菌为靶标,以菌株BS-17为拮抗菌的抑菌谱的测定,结果表明,BS-17 对9种土传疾病的病原菌均具有良好的抑制效果(表2)。
2.4 拮抗物质存在位置
由图4可以看出,BS-17无菌发酵液对病原菌抑菌作用远远大于细胞提取物,细胞提取物对病原菌抑制作用不明显,说明抑菌物质主要存在于菌株BS-17胞外分泌物中。
2.5 抑菌物质的性质研究
2.5.1 拮抗物质对热稳定性 以杯碟法分别对温度为0、20、40、60、80、100、121 ℃处理的无菌发酵液抑菌活性进行检测。由图5可知,抑菌物质对热稳定性好,经过高温100 ℃处理,抑菌活性降低,而在121 ℃时仍有一定活性。
2.5.2 拮抗物质对酸碱稳定性 以杯碟法分别对pH值为3、4、5、6、7、8、9处理的无菌发酵液拮抗活性进行检测。由图6可知,拮抗物质对酸碱稳定性好, 在较广pH范围内均具有拮抗活性。
2.5.3 拮抗物质对紫外线敏感性 以杯碟法分别对紫外灯照射0、2、4、6、8、10、12 h处理的无菌发酵液进行拮抗活性检测。由图7可知,拮抗物质对紫外线不敏感。
2.5.4 拮抗物质对蛋白酶稳定性 以杯碟法分别检测拮抗物质对蛋白酶K、胰蛋白酶、胃蛋白酶、木瓜蛋白酶的稳定性。由图8可知,拮抗物质对蛋白酶不敏感。
2.6 BS-17产纤维素酶、蛋白酶活性研究
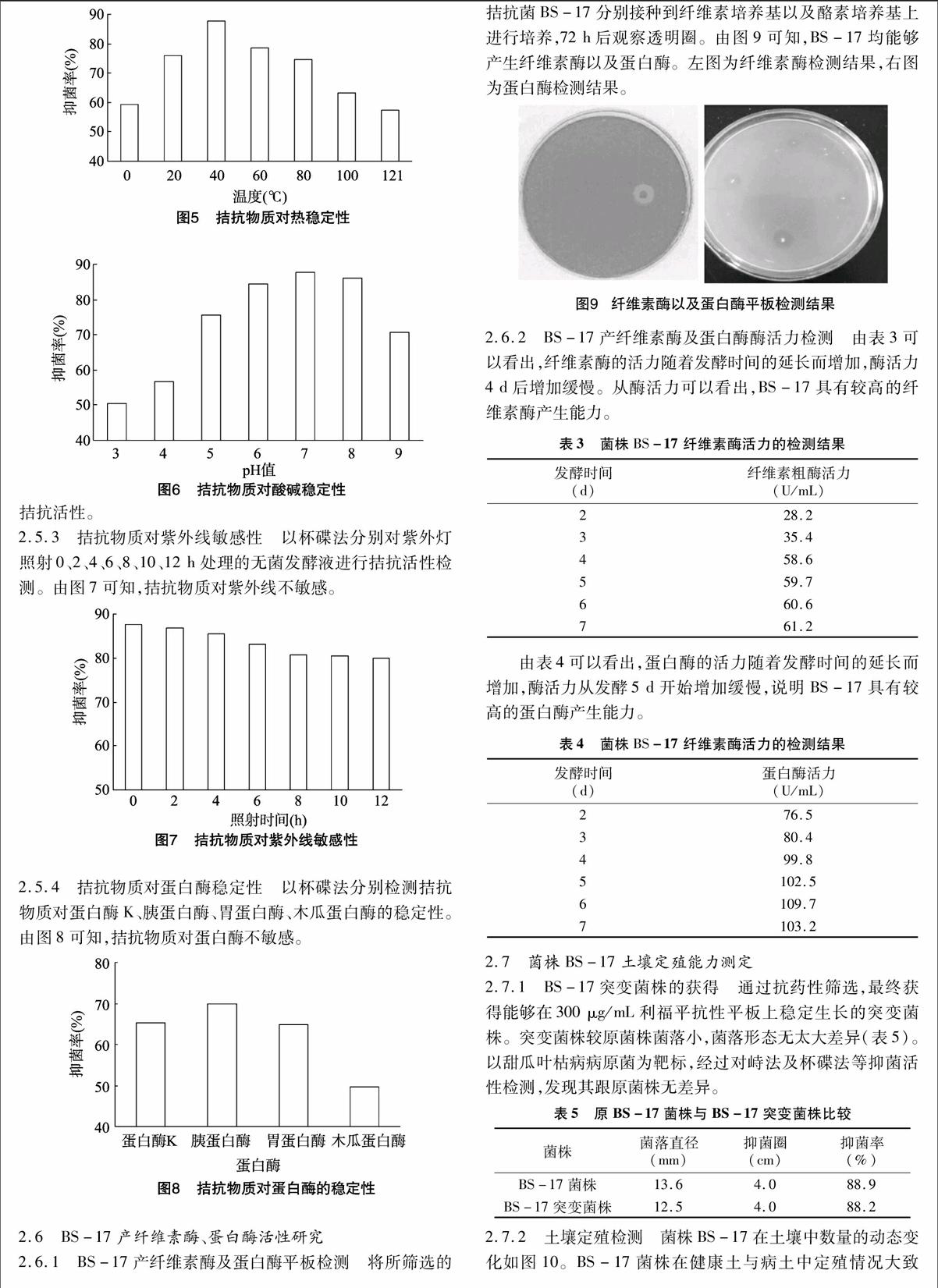
2.6.1 BS-17产纤维素酶及蛋白酶平板检测 将所筛选的拮抗菌BS-17分别接种到纤维素培养基以及酪素培养基上进行培养,72 h后观察透明圈。由图9可知,BS-17均能够产生纤维素酶以及蛋白酶。左图为纤维素酶检测结果,右图为蛋白酶检测结果。
2.6.2 BS-17产纤维素酶及蛋白酶酶活力检测 由表3可以看出,纤维素酶的活力随着发酵时间的延长而增加,酶活力4 d后增加缓慢。从酶活力可以看出,BS-17具有较高的纤维素酶产生能力。
2.7 菌株BS-17土壤定殖能力测定
2.7.1 BS-17突变菌株的获得 通过抗药性筛选,最终获得能够在300 μg/mL利福平抗性平板上稳定生长的突变菌株。突变菌株较原菌株菌落小,菌落形态无太大差异(表5)。以甜瓜叶枯病病原菌为靶标,经过对峙法及杯碟法等抑菌活性检测,发现其跟原菌株无差异。
表5 原BS-17菌株与BS-17突变菌株比较
菌株菌落直径(mm)抑菌圈(cm)抑菌率(%)
BS-17菌株13.64.088.9
BS-17突变菌株12.54.088.2
2.7.2 土壤定殖检测 菌株BS-17在土壤中数量的动态变化如图10。BS-17菌株在健康土与病土中定殖情况大致为:先降低,再上升,再降低,最后趋于平稳。在14.5 d之后,病土中BS-17菌株的数目高于健康土,这可能是因为病原菌生长代谢产物刺激了拮抗菌的快速繁殖。
由图11可知,未接拮抗菌的对照组病原菌在土壤中呈波浪线趋势变化,菌悬液处理的病土中病原菌数量大幅度下降,说明拮抗菌对病原菌具有抑制效果。在21 d以后,对照组病原菌的数目逐渐趋于稳定,菌悬液处理的病土中病原菌数量逐渐增加,说明在35 d时拮抗菌的数目不足以抑制病原菌的生长。
3 讨论与结论
本研究分离筛选出对常见植物土传疾病具有较好拮抗效果的菌株BS-17,通过鉴定该拮抗菌为解淀粉芽孢杆菌。菌株BS-17的主要拮抗活性物质存在于胞外物质中,经过试验研究发现拮抗物质对热、pH值、紫外线以及蛋白酶的稳定性好,说明该菌具有开发研制成生防菌剂的潜力。
另外,该拮抗菌有较高的产纤维素酶及蛋白酶的能力,够抑制多种病原菌以及土壤中的病虫害。例如纤维素酶对卵菌纲真菌具有重要的抑制作用[15],蛋白酶对土壤中多种病害以及线虫都具有显著抑制和杀灭的作用[16-18]等。经过利福平及抗病原菌双抗标记法,筛选出的突变株用于土壤定殖试验,结果表明,菌株BS-17的定殖能力强,在土壤中表现出较高的抑菌活性。由于在实际大田应用中,自然田间差别很大,生防菌在施用过程中受多种条件的影响,因此,在生防菌应用于实际田间抗病试验时,需进一步确定生防菌在土壤中的定殖情况以确定最佳的施用量。
本研究筛选出的拮抗菌不仅具有广泛的抑制植物土传疾病病原菌的效果,并且其拮抗物质性质稳定,对热、酸碱、紫外线以及蛋白酶均有良好的耐性。该拮抗菌具有较好的产纤维素酶及蛋白酶的能力,因此,具有广泛抑制土壤中多种病菌的潜力。
参考文献:
[1]陈丽园,詹 凯,鲁恒星,等. 土传病害生防菌的分离筛选及鉴定[J]. 中国农学通报,2014,30(29):8-14.
[2]李萍萍. 设施园艺中的土壤生态问题分析及清洁生产对策[J]. 农业工程学报,2011,27(增刊2):346-351.
[3]刘宏军. 关于我国设施农业、设施园艺业发展现状与对策研究[J]. 农业与技术,2007,27(4):5-8.
[4]Atkinson D,Thornton M K,Miller J S. Development of rhizoctonia solani on stems,stolons and tubers of potatoes Ⅰ. Effect of inoculum source[J]. American Journal of Potato Research,2010,87(4):374-381.
[5]陈 杰,汤 琳,郭天文,等. 马铃薯土传病原真菌拮抗放线菌的抗病促生作用[J]. 西北农林科技大学学报:自然科学版,2014,4(1):111-119.
[6]梁雪杰,张婷婷,乔俊卿,等. 番茄土传病害拮抗菌的筛选、评价及鉴定[J]. 西南农业学报,2014,27(3):1096-1103.
[7]Tan S Y,Jiang Y,Song S,et al. Two Bacillus amyloliquefaciens strain isolated using the competitive tomato root enrichment method and their effects on suppressing Ralstonia solanacearum and promoting tomato plant growth[J]. Crop Protection,2013,43:134-140.
[8]Zhou T T,Chen D,Li C Y,et al. Isolation and characterization of Pseudomonas brassicacerum J12 as an antagonist against Ralstonia solanacearum and identification of its antimicrobial components[J]. Microbiological Research,2012,167(7):388-394.
[9]Kberl M,Ramadan E M,Adam M,et al. Bacillus and Streptomyces were selected as broad-spectrum antagonists against soil-borne pathogens from arid areas in Egypt[J]. FEMS Microbiology Letters,2013,342(2):168-178.
[10]de Boer W,Verheggen P,Klein Gunnewiek P J,et al. Microbial community composition affects soil fungistasis[J]. Applied and Environmental Microbiology,2003,69(2):835-844.
[11]范秀容,沈 萍. 微生物学实验[M]. 北京:人民教育出版社,1980:241-249.
[12]陈 雪,万 科,张传萍,等. 烟草赤星病拮抗细菌的筛选、鉴定及机制初步研究[J]. 生物学通报,2013,48(7):51-54,封3.
[13]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社,2001:58-64.
[14]牛春艳,喻国辉,程 萍,等. 枯草芽胞杆菌TR21叶腋喷施防治巴西蕉枯萎病[J]. 热带作物学报,2010,31(11):1986-1990.
[15]臧超群. 葡萄霜霉病生防细菌SY286及控病机理研究[D]. 沈阳:沈阳农业大学,2014:1-101.
[16]黎 波,魏学军,李亚宁,等. 解淀粉芽孢杆菌X-278菌株抗菌蛋白初步分析[J]. 河南农业科学,2013,42(7):68-71,83.
[17]肖同建. Bacillus cereus X5的杀线活性及其生物有机肥对南方根结线虫的防治作用研究[D]. 南京:南京农业大学,2011:1-123.
[18]李 娟,彭德良,廖金铃,等. 农作物重要病原线虫生物防控的研究进展[J]. 生命科学,2013,25(1):8-15.

