血红蛋白在壳聚糖/纳米金/APS/普鲁士蓝复合膜修饰电极上的直接电化学
□单彩霞 □赵飞燕
(1濮阳水文水资源勘测局 2安阳水文水资源勘测局)
0 引言
本法基于Hb-Chit/AuNPs/APS/PB多层膜修饰的玻碳电极为工作电极,研究了其制作、表征及对该修饰电极多层膜为基础的生物传感器的性能分析。通过电沉积的方法将PB修饰到GCE电极表面,制得PB/GCE电极;将带正电荷、含有大量氨基的3-氨丙基三乙烯硅烷(APS)修饰到电极表面,并通过相反电荷之间的静电相互作用将含有大量负电荷的纳米金(AuNPs)固附于电极表面形成复合膜,最后,将Hb和壳聚糖溶液固载于多层膜修饰的电极上。由于PB特殊的催化特性,AuNPs和Hb分子的协同影响,这种生物传感器具有良好的性能,即具有高的灵敏度、较强的稳定性和选择性、响应时间短、线性范围宽的优点,这种新型的修饰方法为研究蛋白质电化学提供了有效的功能界面,成功地用于测定H2O2。
1 实验部分
1.1 传感器的构制
玻碳电极依次用1.00,0.50,0.05μm的Al2O3浆在麓皮纸上抛光成镜面以去除表面吸附有机物,每次抛光后先洗去表面污物,再用去离子水超声清洗,重复三次,最后依次用HNO3溶液(1:1),乙醇溶液(1:1),去离子水超声清洗(每次3-5min),将清洗好的电极晾干待用。
将含有2mmol/LFeCl3+2mmol/LK3[Fe(CN)6]+0.10mol/LKCl+0.10mol/LHCl的溶液通氩气除氧10min,在氩气氛围内,将处理好的裸GCE置于此溶液中,以恒电压+0.4 V进行电化学聚合120 s,即得到PB/GCE修饰电极。经过条件优化,将PB/GCE修饰电极置于含0.10mol/LKCl和0.10mol/LHCl的电解液中,并以50mV/s的扫描速率在-0.05V~+0.35 V范围内扫描20圈,随着聚合圈数增加,PB/GCE上的聚合峰电流逐渐增大,到一定程度时不再变化(见图1),这表明电极表面形成了导电膜。由此产生的PB薄膜修饰电极用清水洗净,并在氮气氛围下干燥。

图1 PB修饰电极的循环伏安图
用以上方法修饰电极处理后,将修饰电极浸泡在2%的APS溶液中30min,以促使电极表面引入大量的氨基基团。然后,该修饰电极用二次水彻底冲洗并在4℃条件下在纳米金溶液中浸泡10 h。为得到Hb-Chit复合膜的最佳响应,对Hb和Chit混合溶液修饰体积进行了优化。将Hb和Chit混合溶液滴涂到修饰电极表面,在电极上方罩上小烧杯,后将该修饰薄膜在空气中干燥过夜,以便形成均匀的复合膜。
2 Hb-Chit/AuNPs/APS/PB复合膜的光谱表征
2.1 紫外可见吸收光谱表征

图2 Hb(a),Hb-Chit/AuNPs/APS/PB修饰膜(b)的UV-vis光谱图
图2显示了Hb(见图2a曲线)及Hb在复合膜中(见图2b曲线)的紫外可见光谱图,对于包埋于Chit/AuNPs/APS/PB复合膜内的Hb,在413 nm处出现了明显的Soret吸收带,仅比Hb Soret吸收带红移了4 nm。Soret吸收带轻微的移动及吸收率减小归结于复合膜与蛋白质的交互作用,这种作用既不会破坏蛋白质结构,也不会破坏生物分子基本的微水环境。在Chit/AuNPs/APS/PB复合膜(见图2b曲线)中大约在535 nm处出现了一个相对突出的吸收峰,而在Hb中(见图2a曲线)却未曾出现此类吸收峰,主要是纳米金的特征吸收峰峰值大概在535 nm附近。
2.2 红外光谱表征

图3 Hb(a),Hb-Chit/AuNPs/APS/PB修饰膜(b)的红外谱图
Hb-Chit/AuNPs/APS/PB复合膜红外光谱图显示了其组成部分的组合形状(见图3b曲线),可以看出复合膜中的酰胺I和酰胺II基团与天然Hb的酰胺I和酰胺II基团结构非常相似,说明在复合膜中,Hb的主要部分基本上保留了其天然结构,构象没有发生大的变化。
3 修饰电极的直接电化学
3.1 循环伏安法测不同修饰电极的直接电化学行为

图4 不同修饰电极的循环伏安图
图4显示了在0.10mol/L pH7.00PBS中,在扫速100mV/s条件下,不同修饰电极的循环伏安行为。Hb-Chit/AuNPS/APS/PB/GCE电极得到了一对稳定而明确的氧化还原峰(见图4e曲线),阳极峰电位(Epa)和阴极峰电位(Epc)分别位于160mV和250mV,式电势Eo’=(Epa+Epc)/2=205mV。然而,在修饰膜中没有Hb存在的条件下,只有PB/GCE电极得到一对可逆的氧化还原峰(见图4b曲线),阳极峰电位和阴极峰电位分别位于210mV和276mV,式电势为243mV,裸电极没有任何氧化还原峰出现(见图4a曲线),显然,Hb-Chit/AuNPS/APS/PB/GCE电极反应的原因在于固载于电极表面的Hb的电化学氧化还原中心。另一方面,Hb-chit/PB修饰电极也出现了一对氧化还原峰(见图4c曲线),然而,这对氧化还原峰较之Hb-Chit/AuNPS/APS/PB/GCE修饰电极出现的氧化还原峰小的多,AuNPS在Hb电极反应动力学中产生了巨大影响,在蛋白质与底层电极之间的电子转移方面,AuNPS提供一个适宜的微环境。当不用PB修饰电极时,峰值电流范围变得较为广泛,波峰间隔值增大且峰电流较小(见图4d曲线),可能是PB的存在促进了Hb与电极之间的电子转移。
文章所用复合膜材料的生物相容性为Hb提供了一个与Hb本体天然状态环境相似的微环境,Hb所处的微环境对其电子传递有较大的影响,电子传递过程与Hb在电极表面的取向有关,由于复合膜材料所带电荷属性不同,可以调节Hb在电极表面的取向,使其朝着利于电子受体或供体的方向进行,极大地促进了血红蛋白与电极间的电子转移过程。
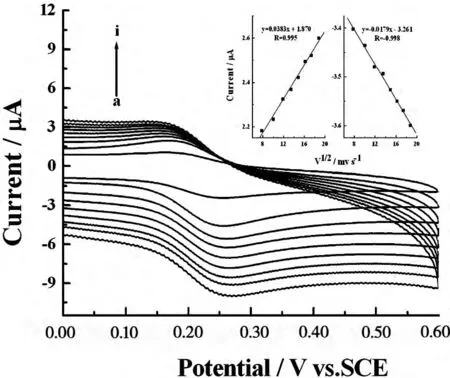
图5 Hb-Chit/AuNPs/APS/PB修饰电极的峰电流与扫速的关系图
3.2 Hb-Chit/AuNPs/APS/PB修饰电极电化学行为的影响因素
3.2.1 电极峰电流与扫速的关系
图5研究了Hb-Chit/AuNPS/APS/PB/GCE电极峰电流与扫速的关系,扫速在20~350mV/s范围内,随着扫速的增加,氧化还原峰电流也随之增加,氧化还原峰电位分别略有移动(还原峰正移,氧化峰负移),且式电势变大,说明随着扫速增加,电极电子转移过程更加不可逆。在此扫速范围内,峰电流与扫速成正比,表明电极反应受表面影响。在已选择的扫速范围内,氧化还原峰电流值几乎相等,说明在复合材料修饰膜中的电活性HbFe(Ⅲ)在阴极扫描过程中转化为HbFe(Ⅱ),而在阳极扫描过程中还原态的HbFe(II)又全部转化为氧化态的HbFe(Ⅲ)。
当扫速在20~350mV/s范围内时,峰电流与扫速呈良好的线性关系,结果如图5所示。氧化还原峰电流Ip和扫描速度υ的线性回归方程为Ipa(μA)=1.87+3.83×10-2υ(mV/s)(R=9.95×10-1)和Ipc(μA)=-3.26-1.79×10-2υ(mV/s)(R=9.98×10-1),所有这些结果与表面控制或单电子薄层电化学行为相符合。
3.2.2 溶液pH对生物传感器电化学行为的影响
实验研究了pH4.0-9.0范围内Hb-Chit/AuNPS/APS/PB/GCE修饰电极的循环伏安行为,结果表明,随着pH的增加,阴极峰和阳极峰均发生负移。此外阳极峰电势Epa、阴极峰电势Epc及式电势Eo’(Epa/2+Epc/2)均与pH值呈线性关系,直线斜率分别为-48.00mV/pH、-44.50mV/pH和-46m V/pH,接近于1质子1电子可逆电极反应的理论值-59.00mV/pH,表明Hb和电极之间的电子传递过程伴随有1质子的传递,质子参与主要是中和电化学还原过程中界面上积累过剩电荷,从而使靠近亚铁血红素的基团发生质子化作用,该过程可表示为:HbFe(III)+H++e-→HbHFe(II)。
阳极峰电势Epa、阴极峰电势Epc及式电势Eo’(Epa/2+Epc/2)与pH值线性关系的直线斜率均与理论值59.00mV/pH有些偏离,可能是由于质子化是一个复杂的过程,受Hb配位基团和周围的血红素氨基酸共同影响。此外,在pH值为7.00左右时,在修饰电极上Hb氧化还原峰电流最大,其原因主要是Hb在pH值为7.00的PBS缓冲溶液中保持了高度的活性,故选择pH值为7.00作为最佳底液pH值。
4 Hb-chit/AuNPS/APS/PB/GCE电极的重现性和稳定性
在pH7.00PBS中,于-0.10V-0.60V范围内,对Hb-chit/AuNPS/APS/PB/GCE电极连续循环伏安扫描时,峰值电流基本保持不变,连续扫描80圈,氧化还原峰电流减小4.80%。该电极在4℃保存20 d,进行循环伏安扫描时发现电流没有明显的变化,仅比初始氧化还原电流降低6%左右,由此可见此修饰电极有较好的稳定性。比较8支不同的Hb-chit/AuNPS/APS/PB/GCE电极(制备方法相同)对10μmol/LH2O2的响应电流值,考察电极的重现性,测得RSD为5.20%,表明电极具有良好重现性。
5 结论
文章成功制备了一种新型的chit/AuNPS/APS/PB复合材料,并将其用于Hb的直接电化学研究。这一复合膜有极好的生物适应性和稳定性,能在电极表面为Hb提供合适的仿生微环境,保持了膜中Hb的活性,极大地促进Hb与电极间的电子转移。该修饰膜修饰电极制备简单、便捷且有良好稳定性和重现性。制备的Hb-chit/AuNPS/APS/PB/GCE复合膜修饰玻碳电极对H2O2有明显的电催化活性,催化电流与较宽浓度范围内的H2O2呈良好线性关系,且无需额外的电子介体,这将为电化学传感和生物传感提供一个优良的平台。

