在IVF-ET 中低剂量长效GnRH-a与短效GnRH-a长方案降调节的评价
李洁,詹雪君,高军,王琼,钟依平,欧建平,周灿权,庄广伦
(中山大学附属第一医院生殖医学中心,广州 510080)
随着GnRH-a降调节联合促卵泡生成激素控制性卵巢刺激(COS)方案在IVF-ET 中广泛应用,越来越多的资料显示GnRH-a剂量与剂型在COS中的作用差异,降低GnRH-a剂量与减轻垂体卵巢轴抑制和COS强度相关。超排卵治疗中适当降低卵巢刺激强度(Mild or Minimal COS)有利于减少中-重度OHSS发生、促进卵母细胞成熟、改善卵母细胞受精、胚胎质量和子宫内膜对胚胎接受性,提高移植周期胚胎种植率和临床妊娠率。也有作者认为其能减少与排卵治疗相关的卵巢癌和乳腺癌。
减少COS强度(Mild or Minimal COS)方法主要包括:递减(Step down)方案、中断FSH(Coasting)治疗和低剂量GnRH-a降调节。前两者作用机理主要是减少成熟卵泡数目、降低血清E2水平。实施Step down方案的困难是确定FSH 减量时机和剂量需要个体化。Coasting治疗的问题是卵泡成熟后期E2水平快速下降可能影响卵母细胞质量,并且不能够限制重度OHSS的发生。低剂量GnRH-a降调节理论是在抑制内源性LH 峰基础上,利用体内低水平LH 维持卵泡发育和促进卵母细胞成熟,同时减少使用Gn剂量和时间达到降低卵巢刺激程度。
目前低剂量GnRH-a降调节方案包括:(1)降低GnRH-a剂量;(2)缩短使用GnRH-a时间。为了评价低剂量GnRH-a降调节方案在COS中的作用,我们在前期工作基础之上回顾性分析本中心2011年7 月至2011年12 月1 928个低剂量长效GnRH-a降调节IVF-ET 治疗周期资料,比较长效低剂量与短效GnRH-a 方案参数,评估低剂量GnRH-a长方案降调节在IVF-ET 中的应用。
资料与方法
一、一般资料
2011年7月~12月在本院生殖中心进行IVFET 治疗的不孕症夫妇共1 928个周期。不育原因包括输卵管因素、男方因素、盆腔粘连、子宫内膜异位症、排卵障碍及不明原因不育。女性患者年龄23~43岁,平均(34.3±5.2)岁,不育年限为(5.02±3.53)年。
二、COS方案
黄体中期使用长效或短效GnRH-a(达菲林,Triptorelin,博福-益普生,法国)肌肉注射进行垂体降调节,根据GnRH-a剂量与剂型分为短效组、长效0.375mg、0.8mg、1.0mg组。月经第5~7天开始肌肉注射FSH(150~300 U/d)诱导卵泡发育,采用阴道超声检查和血、尿激素测定监测卵泡发育,当2个主导卵泡径线≥18mm,于当日21时给予HCG 6 000-10 000IU或重组HCG 250μg注射触发卵母细胞成熟。获卵数<5 个视为低反应组,≥20个为高反应组。
三、IVF-ET
HCG 注射36h后取卵进行体外培养和授精,卵母细胞受精第3 天进行ET。采用HCG 2 000 IU,Q3D×4或黄体酮40mg/d肌肉注射或阴道栓剂支持黄体。移植胚胎第14天测定尿妊娠实验,第21~28天进行阴道超声检查,B 超显示有胚囊和胎心者确定为临床妊娠。
四、血清激素测定
采用雅培12000全自动免疫发光仪化学发光分析法测定FSH、LH、孕酮(P)、E2水平。
五、统计学处理
采用SPSS 13.0软件包进行分析,数据以平均值±标准差(±s)形式表达,计量资料采用t检验,P<0.05表示差异有统计学意义。
结 果
一、各方案组患者基本情况比较
0.375mg组患者年龄、不育年限、FSH 水平显著高于其余3组(P<0.005)(表1)。
二、各方案组垂体-卵巢轴的降调节程度比较
0.375mg组HCG 日LH 水平显著高于其余3组(P<0.005)。短效GnRH-a组HCG 日P 水平显著低于其余3组(P<0.005)(表2)。
三、各方案组IVF-ET 周期卵巢反应性与Gn使用情况比较
短效GnRH-a 组Gn 使用天数、Gn 总剂量、HMG 天数、HMG 总量和平均获卵数均低于其余3组(P<0.005)(表3)。
四、各方案组患者IVF-ET 周期促排情况及妊娠结局比较
4组间MⅡ卵母细胞率、正常受精率比较无统计学差异(P>0.05);长效GnRH-a 0.8mg组卵母细胞利用率显著高于其它3组(P<0.005);长效GnRH-a 1.0mg组临床妊娠率和种植率高于长效GnRH-a 0.375mg组和短效方案组(P<0.005)(表4)。
表1 各方案组患者基本情况比较(±s)
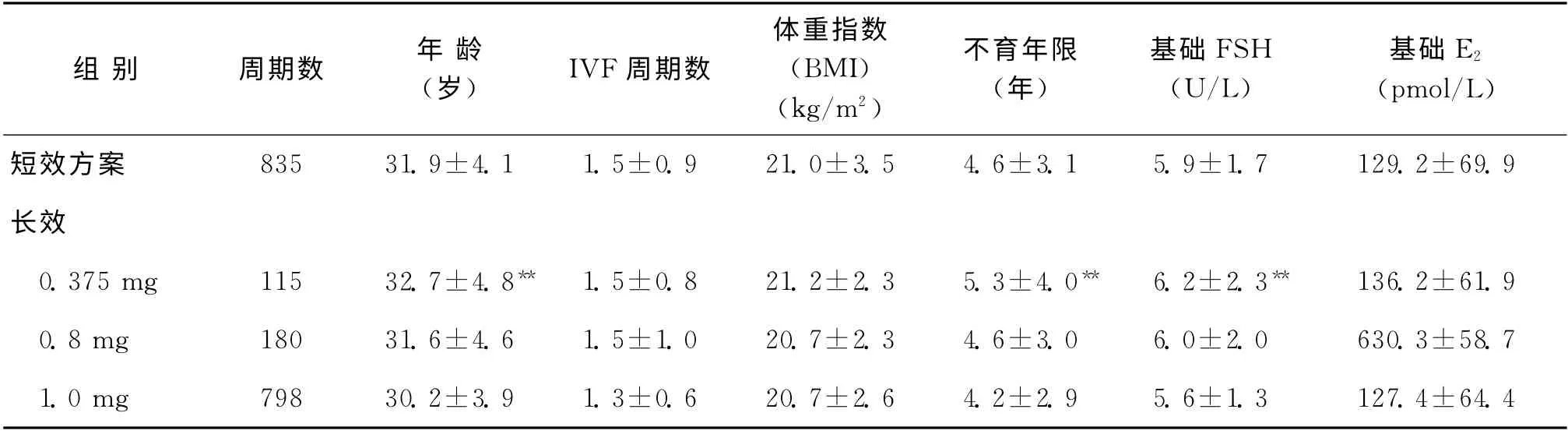
表1 各方案组患者基本情况比较(±s)
注:与其他3组比较,**P<0.005
组别 周期数 年龄(岁) IVF周期数体重指数(BMI)(kg/m2)不育年限(年)基础FSH(U/L)基础E2(pmol/L)短效方案 835 31.9±4.1 1.5±0.9 21.0±3.5 4.6±3.1 5.9±1.7 129.2±69.9长效 0.375mg 115 32.7±4.8** 1.5±0.8 21.2±2.3 5.3±4.0** 6.2±2.3** 136.2±61.9 0.8mg 180 31.6±4.6 1.5±1.0 20.7±2.3 4.6±3.0 6.0±2.0 630.3±58.7 1.0mg 798 30.2±3.9 1.3±0.6 20.7±2.6 4.2±2.9 5.6±1.3 127.4±64.4
表2 各方案组患者血清激素水平比较(±s)

表2 各方案组患者血清激素水平比较(±s)
注:与其他3组相比,**P<0.005
组 别 周期数 启动日FSH(U/L)启动日LH(U/L)启动日E2p(mol/L)HCG 日FSH(U/L)HCG 日LH(U/L)HCG 日E2(pmol/L)HCG 日P(nmol/L)**短效方案 835 2.9±1.3 0.8±0.7 49.8±26.7 12.9±6.0 0.8±0.6 10 866.2±7 515.1 1.9±1.0长效 0.375mg 115 2.9±1.5 1.0±0.5 45.8±18.7 14.0±5.3 1.0±0.6** 11 401.0±5 086.7 2.2±1.3 0.8mg 180 1.7±1.1 0.9±0.5 41.4±13.5 12.9±5.9 0.6±0.5 11 093.5±5 597.6 2.5±1.6 1.0mg 798 1.6±0.9 0.9±0.5 41.0±17.9 11.4±5.9 0.5±0.5 10 778.0±5 825.3 2.2±1.6
表3 各方案组卵巢反应性与Gn使用情况比较(±s)
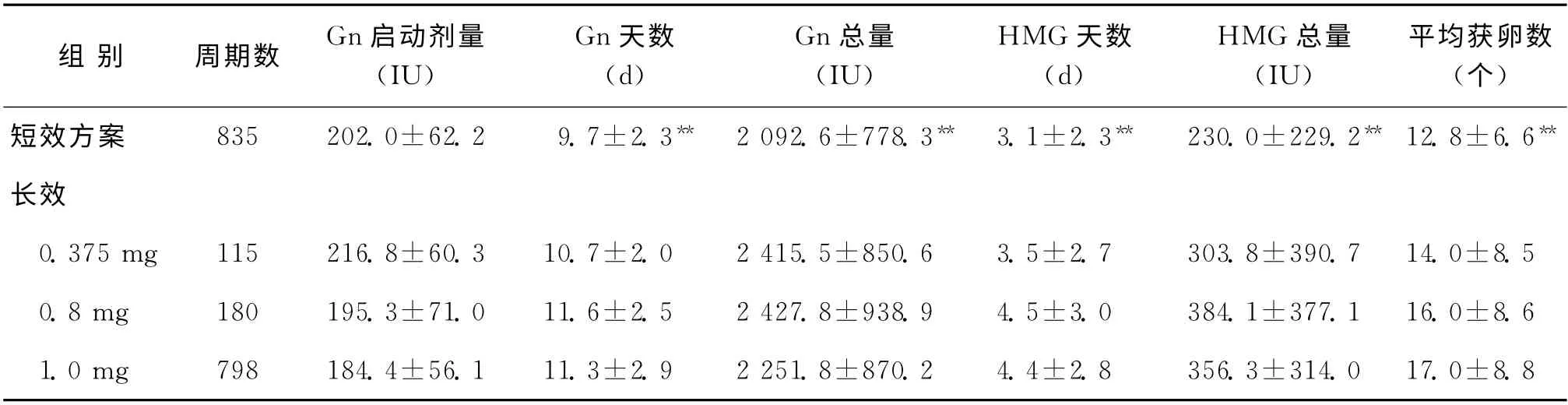
表3 各方案组卵巢反应性与Gn使用情况比较(±s)
注:与其他3组比较,**P<0.005
组 别 周期数 Gn启动剂量(IU)Gn天数(d)Gn总量(IU)HMG 天数(d)HMG 总量(IU)平均获卵数(个)短效方案 835 202.0±62.2 9.7±2.3** 2 092.6±778.3** 3.1±2.3** 230.0±229.2** 12.8±6.6**长效 0.375mg 115 216.8±60.3 10.7±2.0 2 415.5±850.6 3.5±2.7 303.8±390.7 14.0±8.5 0.8mg 180 195.3±71.0 11.6±2.5 2 427.8±938.9 4.5±3.0 384.1±377.1 16.0±8.6 1.0mg 798 184.4±56.1 11.3±2.9 2 251.8±870.2 4.4±2.8 356.3±314.0 17.0±8.8
表4 各方案组患者IVF-ET 周期促排情况及妊娠结局比较[(±s),n(%)]

表4 各方案组患者IVF-ET 周期促排情况及妊娠结局比较[(±s),n(%)]
注:与其他3组比较,**P<0.005;与0.375mg组和短效方案组比较,#P<0.005
组 别 周期数 MⅡ卵母细胞数(个)MⅡ卵母细胞率(%)正常受精数(个)正常受精率(%)移植胚胎数(个)短效方案 835 10.7±6.3 80.7±17.1 7.5±4.7 67.4±21.6 2.4±0.6长效 0.375mg 115 11.8±8.7 78.2±17.0 8.3±5.8 67.2±22.9 2.3±0.6 0.8mg 180 12.4±8.3 77.3±26.2 9.0±6.4 65.6±22.4 2.4±0.6 1.0mg 798 14.1±7.1 81.8±14.2 9.9±6.3 67.8±22.6 2.2±0.5组 别 周期数 可用胚胎数(个)卵母细胞利用率(%)临床妊娠率 种植率短效方案 835 5.3±3.8 43.8±21.6 299/662(45.2) 437/1 583(27.6)长效 0.375mg 115 5.9±4.5 43.0±21.2 44/95(46.3) 59/216(27.3) 0.8mg 180 5.6±4.7 56.4±25.4** 59/116(50.9) 77/274(28.1) 1.0mg 798 6.8±5.2 41.3±21.5 284/520(54.6)# 408/1 154(35.4)#
五、不良反应与并发症
长效GnRH-a 1.0mg组卵巢低反应(获卵数≤5个)率和取消移植率均显著低于其余3 组(P<0.005);长效GnRH-a 1.0mg组和0.8mg组卵巢高反应(获卵数≥20 个)率显著高于长效GnRH-a 0.375mg组和短效方案组(P<0.005)(表5)。
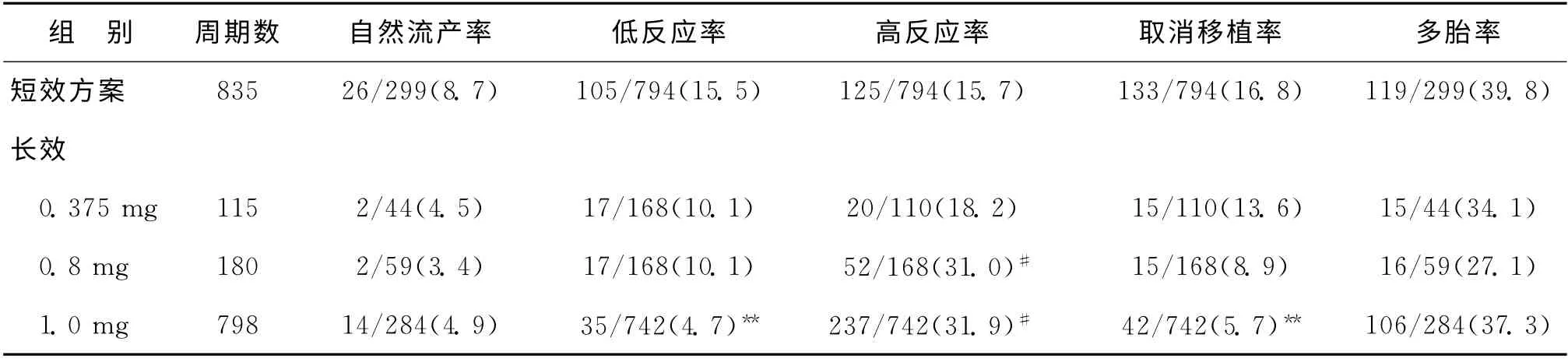
表5 各方案组患者IVF-ET 周期不良反应与并发症发生情况[n(%)]
讨 论
在COS治疗中,基于GnRH-a短时给药对垂体激发作用引起的血清LH 和FSH 升高有利于增加卵泡募集,而长期给药导致垂体局部受体脱敏和消耗能够有效地抑制排卵前LH 峰出现和降低晚卵泡期血清LH 水平,从而具有减少卵泡过早黄素化和取消周期、改善卵母细胞质量的优点。GnRH-a联合Gn方案成功应用于体外受精-胚胎移植(IVFET)的控制性超排卵治疗已20 余年。但是随着GnRH-a不同剂型、剂量和方案应用数据的积累,文献报道[1-2]和我们的前期研究[3]都显示:GnRH-a对垂体-卵巢轴的降调节作用呈现剂量依赖性;当垂体-卵巢轴出现过度抑制时可能导致卵巢反应性降低,临床表现为卵巢反应不良(获卵数≤4个,HCG日血清E2≤3 670pmol/L)或使用Gn 剂量增加和时间延长。此外人群中还存在个体差异导致的对GnRH-a同一剂量或剂型垂体-卵巢轴降调节程度不同、卵巢对后续Gn 刺激反应不一。
一、垂体-卵巢轴的降调节作用
经典的GnRH-a降调节标准指在Gn启动治疗前卵巢达到静息状态:血清E2≤50 pg/ml(183pmol/L),卵泡直径≤5~10 mm 或子宫内膜厚度<5mm。文献报道在IVF-ET 中GnRH-a短效剂型的全量、半量和长效剂型的全量、半量与1/3量的应用均能满足上述降调节标准[3-5]。早期实验研究表明长效GnRH-a全量、半量单次给药和短效GnRH-a 0.1mg/d连续给药后GnRH-a血药浓度分别在0.23、0.11和0.11ng/ml水平,并可维持在50~60d,而0.11ng/ml的GnRH-a血药浓度已足以有效地抑制血清LH 水平[6]。我们前期报道短效GnRH-a制剂全量和半量方案、长效GnRH-a制剂全量、半量与1/3量方案在降调节2~3周或Gn启动治疗时血清LH 水平存在显著差别,LH 水平恢复时间也存在显著差异[3]。本研究中短效方案组与长效0.375 mg 组 血 清LH 水 平 相 似,Gn 启 动 日LH 水平[(0.8±0.7)vs.(0.9±0.5)U/L]和HCG 日LH 水平[(0.8±0.6)vs.(0.5±0.5)U/L]分别低于和高于0.8mg和1.0mg组,但E2水平无差别,提示随剂量降低长效GnRH-a也呈现出对垂体的不完全抑制作用,而在卵巢水平对E2合成没有显著影响。
二、卵泡发育同步性
文献报道在COS中卵巢反应不良发生率为5%~22%,差别较大,提示与使用的GnRH-a/Gn方案有关。尽管GnRH-a的早期激发作用有利于卵泡募集,增加同步化。但是降调节作用阶段的极低LH 水平和外源性Gn剂量不足时都会造成卵泡发育与成熟的不同步现象。目前,垂体-卵巢轴降调节程度与GnRH-a存在量效关系和IVF-ET治疗周期中不需要完全降调节作用的观点已得到公认。临床实践也证明了长效GnRH-a全量存在垂体-卵巢的过度抑制。长效GnRH-a全量、半量与1/3量方案在Gn启动日和HCG 日LH 水平存在显著差别,卵巢异常反应率增加[3,7-8]。有研究证实长效GnRH-a全量、半量单次给 药 和 短 效GnRH-a 0.1mg/d连 续7d 给 药 后GnRH-a血药浓度分别为0.23ng/ml、0.11ng/ml和0.11ng/ml,并可维持40d。而GnRH-a血药浓度达0.11ng/ml已足以有效地抑制LH 合成与分泌[4]。因此有必要探讨能够满足IVF-ET 治疗要求的GnRH-a最低剂量或方案。
由于不同GnRH-a存在生物学效价和半衰期的差别以及不同个体对GnRH-a敏感性的差异导致卵巢对后续诱导排卵药物反应的不同[9]。本研究回顾性分析发现长效方案中随剂量增加获卵数增多,高反应率在0.8 mg和1.0 mg组显著增高,而低反应率明显下降,均与短方案存在显著差异,提示长方案中卵母细胞发育同步性较好。目前认为这种现象主要与GnRH-a降调节后卵泡期血清FSH、LH、E2水平有关。导致部分患者出现卵泡发育不均一性,在临床上表现为获卵数减少,使用Gn剂量增加、时间延长,但E2水平没有显著下降,与卵巢储备下降或者反应不良存在差别。本研究的不足是回顾性分析,4组间年龄和基础FSH 水平存在差异,未能根据窦前卵泡计数和抗苗勒管激素(AMH)水平等评估后再选择方案和Gn启动剂量,尚不足以说明COS治疗中卵巢反应性差异的真实原因。
三、IVF-ET 相关参数与结局
IVF-ET 周期中成功的COS治疗包括:获得足够数目的高质量卵母细胞或胚胎、最低限度的黄体功能缺陷和较低的不良反应发生率。本研究资料表明3个长效低剂量方案组获卵数、MⅡ卵母细胞数和可用胚胎数均显著高于短效组,但MⅡ卵母细胞率、正常受精率无显著差异;短效组卵母细胞利用率、妊娠率和种植率显著低于长效组,流产率高于长效组,可能与胚胎质量受到影响有关。由于4组间存在年龄、移植胚胎数目和黄体支持方案的差异,同时还缺乏累计临床妊娠率和冷冻胚胎周期资料,不足以说明对IVF-ET 结局的影响。
垂体-卵巢轴的降调节作用与GnRH-a剂型和剂量有关,短效方案组Gn启动日血清LH 水平低于1.0mg和0.8mg组;0.375mg组HCG 日高于1.0mg和0.8mg组,提示随剂量降低长效GnRHa也呈现对垂体的不完全抑制作用,在卵巢水平对E2合成没有显著影响。综合考虑COS与IVF-ET相关因素与结局关系,从这部分较大样本的资料中可以初步看到GnRH-a降调节的剂型与剂量对卵巢反应性、后续使用Gn 启动剂量与时间、血清FSH、LH、E2水平和IVF-ET 结局密切相关。长效低剂量方案组具有卵泡发育同步性较好、胚胎种植率、临床妊娠率高、患者依从性好,治疗过程简单、方便、没有多次局部注射的痛苦等优势,与传统的长方案明显不同,是值得推荐的COS方案。但低剂量长效GnRH-a对IVF-ET 结局的影响还有待于前瞻随机对照研究进一步阐明。
[1] Dal PL,Borini A,Maccolini A,et al.Pituitary suppression in IVF:half dose depot triptorelin.Human Reproduction Volume 17abstract book 1O-004[C].Vienna:18thEuropean Society of Human Reproduction and Embryology annual meeting,2002.
[2] Dor J,Bider D,Shulman A,et al.Effects of gonadotrophinreleasing hormone agonists on human ovarian steroid secretion in vivo and in vitro-results of a prospective,randomized in-vitro fertilization study[J].Hum Reprod,2000,15:1225-1230.
[3] 李洁,周灿权,钟依平,等.不同小剂量GnRH-a在IVF-ET中应用的比较[J].中华妇产科杂志2006,4:41-42.
[4] Janssens RMJ,Vermeiden JPW,Lambalk CB,et al.Gonadotrophin-releasing hormone agoinst dose-dependency of pituitary desensitization during controlled ovarian hyperstimulation in IVF[J]. Hum Reprod,1998,13:2386-2391.
[5] Porter RN,Smith W,Craft IL,et al.Induction of ovulation for in vitro fertilization using buserelin and gonadotrophins[J].Lancet,1984,2:1284-1285.
[6] Janssens RM,Lambalk CB,Vermeiden JP,et al.Study of triptorelin acetate for prevention of a premature LH surge in IVF:a prospective,randomized,double-blind,placebocontrolled study[J].Hum Reprod,2000,15:2333-2340.
[7] Tesarik J, Mendoza C.Effects of exogenous LH administration during ovarian stimulation of pituitary downregulated young oocyte donors on oocyte yield and developmental competence[J].Hum Reprod,2002,17:3129-3137.
[8] Yim SF,Lok IH,Cheung LP,et al.Dose-finding study for the use of long-acting gonadotrophin-releasing hormone analogues prior to ovarian stimulation for IVF[J].Hum Reprod,2001,3:492-494.
[9] Choi JH,Gilks CB,Leung PC,et al.Immunolocalization of Gonadotropin-Releasing Hormone(GnRH)-I,GnRH-II,and Type I GnRH Receptor during follicular development in the human ovary[J].J Clin Endocrinol Metab,2006,91:4562-4570.

