水稻纹枯病菌PGs产生与其活性调控及稳定性研究
张瑜
摘 要 胞壁降解酶是水稻纹枯病菌的一个重要致病因子,在众多胞壁降解酶中以PGs(多聚半乳糖醛酸酶)的活性最高。实验条件下,纹枯病菌PGs的产生受培养时间、温度、振荡条件、C源、葡萄糖浓度及培养液pH的影响,而活性受缓冲液pH和温度的调控。以葡萄糖为最适碳源,但在高浓度葡萄糖(≥5%)条件下,PGs的产生受到抑制;在50 ℃,缓冲液pH为5的条件下,PGs活性最高。稳定性测定表明,其对强酸、强碱、高热、氯仿、紫外线、胰蛋白酶和蛋白酶K等均不稳定。
关键词 水稻纹枯病菌;多聚半乳糖醛酸酶;活性调控;稳定性
中图分类号:S435.111.4 文献标志码:B 文章编号:1673-890X(2015)18-0-03
植物病原真菌在侵入寄主植物过程中可以产生胞壁降解酶(Cell-wall degrading enzymes,CWDEs),这些胞壁降解酶不仅可以分解寄主细胞壁以提供给真菌生长足够的养分,还有助于真菌侵入和在寄主体内扩展。据其分解底物的不同,胞壁降解酶可分为果胶酶(Pectic enzyme)、纤维素酶(Cellulase)、半纤维素酶(Hemicellulase)和其它酶类。果胶酶根据作用方式不同,又可分为水解酶和裂解酶两大类,水解酶包括:多聚半乳糖醛酸酶(Polygalacturonase,PG)、果胶甲基半乳糖醛酸酶(Pectin methylgalacturonase,PMG)、果胶甲酯酶(Pectin methylesterase,PME)和一些其它酶,而PG是病菌接触寄主后产生的第一个胞壁降解酶。
水稻纹枯病菌在人工培养条件和水稻病组织内均能产生多种胞壁降解酶,如PG、PMG、Cx、PGTE和PMTE等,其中以PG的活性最高。陈夕军[1]等认为,水稻纹枯病菌产酶的最适条件为在改良的Marcus培养液中,pH为5.0,28 ℃条件下,培养6 d。陈捷[2]等研究了玉米纹枯病菌的产酶种类发现,除形成上述几种胞壁降解酶外,该菌还可产生PME,但各种酶的活性与水稻纹枯病菌胞壁降解酶活性均处于同一数量级。本研究对水稻纹枯病菌PG的产生与活性调控以及稳定性进行进一步研究,旨在为研究其性质及病害的控制提供理论依据。
1 材料与方法
1.1 供试材料
水稻纹枯病菌:YN-7,由本实验室从江苏水稻纹枯病病株分离保存。
1.2 RsPG的生物活性测定[3]
1.2.1 粗酶的制备
用内径5.0 mm打孔器在PSA培养基上生长的病菌菌落边缘打孔,挑取5块菌丝块至50 mL改良的Marcus培养液中,28 ℃下培养6 d。双层纱布过滤除去菌丝,4 ℃下12 000 rpm离心20 min,上清即为粗酶液。将粗酶液冰浴,慢慢加入等体积的冷丙酮(-20 ℃),轻轻搅拌,1 h后4 ℃下10 000 rpm离心15 min,收集沉淀,并用0.02 mol/L,pH为8.0的Tris-HCl透析(截留分子量8.0 kDa,下同)过夜后,冷冻干燥,即得粗酶。
1.2.2 标准糖曲线的绘制
精确称取1.000 g多聚半乳糖醛酸,用pH为5.0的磷酸-柠檬酸缓冲液(磷酸盐液:Na2HPO4·12H2O 71.62 g溶于蒸馏水,并容至1 000 mL;柠檬酸液:C6H8O7·H2O 21.01 g溶于蒸馏水,并定容至1 000 mL;将磷酸盐液与柠檬酸液按10.3∶9.7 混合,即得pH为5.0的磷酸—柠檬酸缓冲液)溶解并定容至1 000 mL,即得1 mg/mL多聚半乳糖醛酸溶液[4]。
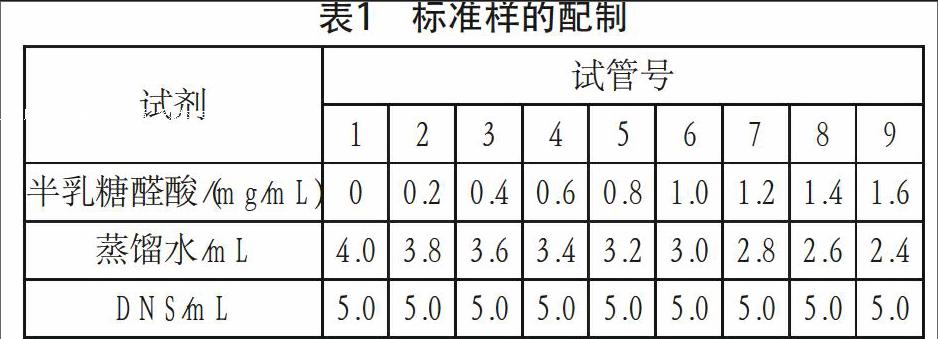
取9支试管编号,按表1加入各种试剂,在混合振荡器上振荡均匀,在沸水浴中加热5 min。取出后立即用流水冷却,加蒸馏水定容至25 mL(以1号试管作为空白调零)。在540 nm处测定各管吸光度。以OD540纵坐标,多聚半乳糖醛酸含量为横坐标,绘制标准曲线。
表1 标准样的配制
试剂 试管号
1 2 3 4 5 6 7 8 9
半乳糖醛酸/(mg/mL) 0 0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6
蒸馏水/mL 4.0 3.8 3.6 3.4 3.2 3.0 2.8 2.6 2.4
DNS/mL 5.0 5.0 5.0 5.0 5.0 5.0 5.0 5.0 5.0
1.2.3 RsPG酶活力测定
于甲、乙两支25 mL比色管中分别加入果胶底物5 mL,在50 ℃水浴中预热5 min。
于甲、乙管中分别加4 mL磷酸-柠檬酸缓冲液,甲管中加入1 mL酶液(10 mg/mL,下同),立即摇匀,在50 ℃水浴中准确反应30 min,立即给乙管中加1 mL酶液,立即放入沸水浴中煮沸5 min,终止反应,冷却。
分别取甲、乙管中反应液2 mL于两支25 mL比色管中,再分别给甲、乙管加2 mL蒸馏水,5 mL DNS 试剂,混合,沸水浴煮沸5 min,取出,立即冷却。加蒸馏水定容到25 mL。3 600 rpm离心8 min,取上清液,以标准空白为基准调零,在540 nm处测吸光度(吸光度要在0.025~0.843,否则重新稀释)。酶活力单位为1 mg酶液在50 ℃、pH为5.0条件下,1 h分解果胶产生1 mg半乳糖醛酸为一个酶活单位。酶活力计算:
式中:A甲为酶样吸光度;A乙为酶空白样的吸光度;K为标准曲线斜率; Dr为稀释倍数;t为反应时间/h。
1.3 RsPG产生的调控
1.3.1 糖种类对RsPG产生的调控
分别以1.0%果胶、多聚半乳糖醛酸、葡萄糖、淀粉和石耳素等为碳源,测定不同碳源条件下水稻纹枯病菌产生RsPG的能力。
1.3.2 不同浓度葡萄糖对RsPG产生的调控
在改良的Marcus培养液中加入0.1%、0.2%、0.5%、1.0%、2.0%、5.0%、10.0%的葡萄糖,测定不同葡萄浓度下水稻纹枯病菌产生RsPG的能力。
1.3.3 不同pH对RsPG产生的调控
将培养液pH分别调为2、3、4、5、6、7、8、9、10,测定不同pH条件下水稻纹枯病菌产生RsPG的能力。
1.4 RsPG反应的最适条件
1.4.1 不同温度下的酶反应活性
分别在20、30、40、50、60 ℃反应条件下,测定RsPG酶活力,除温度外,其它操作同1.2.1。
1.4.2 不同pH条件下的酶反应活性
分别调节反应液pH为2、3、4、5、6、7、8、9和10,测定RsPG酶活力,其它操作同1.2.1。
1.5 RsPG的稳定性测定
1.5.1 对热稳定性测定
取5 mL 蛋白液于小试管中,分别置于40、60、80、100 ℃条件下水浴20 min,以室温处理为对照。用DNS法在540 nm处测定酶活,设对照的酶活性为100%。
1.5.2 对酸碱稳定性测定
将蛋白液调至不同的pH值,用DNS法在540 nm处分别测定各处理的酶活,设对照的酶活性为100%。
1.5.3 对紫外线稳定性测定
将20 mL蛋白液置于无皿盖的培养皿中,在20 W紫外光下,距离40 cm照射12 h,以不照射为对照。用DNS法在540 nm处测定酶活,设对照的酶活性为100%。
1.5.4 对氯仿稳定性测定
将蛋白液与等量氯仿混合振荡1 h,分层后取上层水相,待残留氯仿挥发后,用DNS法在540 nm处测定酶活,以未处理蛋白液为对照,设对照的酶活性为100%。
1.5.5 对蛋白酶稳定性测定
取5 mL蛋白液于小试管中,分别加入胰蛋白酶和蛋白酶K,终浓度均为1 mg/mL,37 ℃水浴处理1 h,以不加蛋白酶为对照。用DNS法在540 nm处测定酶活,设对照的酶活性为100%。
2 结果与分析
2.1 RsPG产生的调控
2.1.1 不同糖种类对RsPG产生的调控
在改良的Marcus培养液中加入不同糖作碳源,水稻纹枯病菌产生PG的量有明显差异。其中,以1%葡萄糖作碳源产酶量最高,为402.42 U/mL;魔芋粉和多聚半乳糖醛酸次之;而以果胶和淀粉作碳源产量最低,仅为146.06 U/mL和121.82 U/mL。
2.1.2 不同葡萄糖浓度对RsPG产生的调控
向改良Marcus培养液中分别加入0.1%、0.2%、0.5%、1.0%、2.0%、5.0%、10.0%的葡萄糖作碳源,结果表明,葡萄糖浓度变化对水稻纹枯病菌PG的产生有显著影响。当葡萄糖浓度<2.0%时,随着葡萄糖浓度的增加,PG的产生量增大;2.0%时,病菌产酶量最高,酶活为404.85 U/mL;当葡萄糖浓度>2.0%时,随着葡萄糖浓度的增加,PG的产生量急剧降低,这与前人发表的高浓度葡萄糖抑制病原真菌产生PG的观点一致。
2.1.3 培养液不同pH对RsPG产生的调控
配制改良Marcus培养液时,将其原始pH分别调为2、3、4、5、6、7、8、9、10,灭菌后接入菌丝块。结果表明,培养液的pH对水稻纹枯病菌产生PG的能力有显著影响。pH为5.0时,水稻纹枯病菌产生的PG酶活性最高,为412.73 U/mL;低于或高于pH为5.0对其酶活均有较大影响。
2.2 RsPG反应的最适条件
2.2.1 温度对RsPG活性的影响
不同温度条件下,RsPG分解果胶产生还原糖的能力不同。在50 ℃时,酶活性最高,达407.88 U/mL,温度过高或过低都会影响酶的活性。
2.2.2 pH对RsPG活性的影响
不同pH缓冲液条件下,RsPG分解果胶产生还原糖的能力不同。在pH为5时,酶活性最高,达403.64 U/mL,增加或降低溶液的pH均会降低酶的活性。
2.3 RsPG的稳定性
2.3.1 RsPG对温度的稳定性
以未经处理的PG为对照,经40、60、80 ℃水浴处理的蛋白其活性均有显著下降,当处理温度为100 ℃时,PG活性完全丧失,说明该蛋白不耐高温 。
2.3.2 RsPG对酸碱的稳定性
PG在pH为4~12范围内均表现有活性,但不同pH值下活性差异极显著,pH为5时活性最大,pH为3以下活性丧失,表明该蛋白主要存在于酸性条件,但对强酸极敏感。
2.3.3 RsPG对蛋白酶、紫外线和氯仿的稳定性
PG对胰蛋白酶、蛋白酶K、紫外线和氯仿均敏感。处理后蛋白活性均有显著下降,最高只有原来活性的50%左右。
3 结论与讨论
植物病原真菌在致病过程中可产生胞壁降解酶以分
(下转第页)
(上接第页)
解植物细胞壁,PG是病菌接触寄主后产生的第一个胞壁降解酶。多数学者研究表明,PG是一类诱导酶,其在寄主植物体内与实验室离体条件下的表达情况完全不同,主要是由于寄主组织中存在的一些诱导因子,在合成培养基中并不存在。实验室条件下,病菌产生PG的能力受培养基组分、外界环境及分解代谢产物的调节。本实验室研究表明,水稻纹枯病菌在改良Marcus培养液中,28 ℃,pH为5条件下,静置培养6 d产PG量最大;同时,PG的产生受底物种类、代谢产物浓度以及培养基起始pH等因子影响。
一般认为,真菌PG在pH在3~6的范围内(酸性条件下)活性最大,有些甚至更低。在研究核盘菌与大豆互作过程中病菌产生的PG和草酸之间的关系时发现,由于病菌在侵染寄主过程中产生草酸,使大豆胚轴组织的pH降低(pH为3.8),从而提高了病菌PG对寄主细胞壁的分解能力。另外,除个别植物病原真菌PG需求较低或较高的温度外,其发挥最佳活性的适宜温度范围一般为40~60 ℃。水稻纹枯病菌PG正与其它真菌PG一样,在偏酸性条件(pH为5)下50 ℃时活性最高。
研究表明,植物病原真菌PG多为单一肽链的糖蛋白,其含糖量为5%~10%,少数含糖量较高。这些糖基化可使PG的蛋白结构更加稳定,提高了其对周围环境的抵抗能力,甚至对其酶活都起着关键的作用。寄生疫霉的endo-PG和黑曲霉的exo-PG在去糖基化后,其活性完全丧失,说明糖基化位点可能靠近或就是酶的活性位点。分离纯化的水稻纹枯病菌PG的含糖量仅为1.48%,这也可能是其对高温、强酸强碱、蛋白酶、紫外线和氯仿等比较敏感的主要原因。
参考文献
[1]陈夕军,张 红,徐敬友,等.水稻纹枯病菌胞壁降解酶的产生及致病作用[J].江苏农业学报,2006,22(1):24-28.
[2]陈捷,唐朝荣,邹庆道,等.玉米纹枯病菌致病因子的研究[J].沈阳农业大学学报,1999,30(3):189-194.
[3]张飞,岳田利,费坚,等.果胶酶活力的测定方法研究[J].西北农业学报,2004,13(4):134-137.
[4]范文艳,陈瑾,文景芝,等.水稻纹枯病菌胞外蛋白酶分离纯化及部分特性分析[J].安徽农业科学.2010(15).
(责任编辑:赵中正)