HMGB1、TLR4和NF-B在子痫前期患者胎盘组织及血浆中升高
吴建波,吴秀燕,胡继芬
(福建医科大学 附属第一医院 妇产科,福建 福州 350005)
研究论文
HMGB1、TLR4和NF-B在子痫前期患者胎盘组织及血浆中升高
吴建波,吴秀燕,胡继芬*
(福建医科大学 附属第一医院 妇产科,福建 福州 350005)
目的探讨高迁移率族蛋白(HMGB1)、TOLL受体4(TLR4)和NF-B信号通路在子痫前期中的相关作用。方法轻度子痫前期患者10例、重度子痫前期患者20例和同期正常妊娠者30例。免疫组织化学(SP法)检测胎盘中HMGB1、TLR4和NF-κB P65蛋白的表达变化及在组织中的定性、定位;用ELISA法检测血清中HMGB1、TLR4和NF-κB P65蛋白浓度。结果子痫前期患者胎盘中HMGB1、TLR4、和NF-κB P65蛋白表达高于正常对照组 (P<0.05);轻度和重度子痫前期患者间无差异。子痫前期患者血清中HMGB1、TLR4和NF-κB P65的含量较正常组明显升高(P<0.05);且重度子痫前期患者血清中HMGB1、TLR4、和NF-κB P65蛋白表达高于轻度子痫前期患者(P<0.05)。结论HMGB1、TLR4及NF-κB P65蛋白表达水平在子痫前期患者胎盘及血清中显著升高,可能参与了子痫的发病过程。
子痫前期;炎性反应;高迁移率组蛋白;TOLL受体4;核转录因子
子痫前期(preeclampsia, PE)是妊娠特有多系统受累的疾病,目前发病机制尚不清楚,是导致孕产妇和围产儿死亡的主要原因之一。近年来研究显示子痫前期母体对妊娠发生过度炎性反应,使母胎界面免疫平衡失调,导致胎盘血管病变、血管内皮损伤、滋养细胞的迁移受限、浅着床[1]。高迁移率族蛋白(highmobilitygroupbox1, HMGBl)在细胞外可刺激单核细胞产生TNF-α、IL- 1、IL- 6等多种炎性因子,并诱导血管内皮细胞表达多种黏附分子和单核细胞趋化蛋白- 1,被认为是一种作用广泛的促炎因子[2]。本实验旨在探讨HMGB1与子痫前期的关系及下游的信号通路,可为子痫前期的防治提供新的思路和治疗靶点。
1 材料与方法
1.1 研究对象
选择2011年10月至2013年3月在福建医科大学附属第一医院选择行剖宫产手术终止妊娠的孕妇60例,分为轻度子痫前期组10例、重度子痫前期组20例和对照组30例,均无内外科合并症病史,其诊断标准依照乐杰主编的第七版妇产科学。正常妊娠组平均年龄(28.5±3.6)岁,平均孕周(39.6±1.1)周,平均新生儿体质量(3.4±0.4)kg,轻度子痫前期组平均年龄(29.6±4.0)岁,平均孕周(38.8±1.1)周,平均新生儿体质量(3.3±0.0.4)kg,重度子痫前期组平均年龄(27.6±5.3)岁,平均孕周(37.6±3.4)周,平均新生儿体质量(2.7±0.6)kg。所有患者组织标本获取经患者签署知情同意书后进行。
1.2 试剂
酶联免疫吸附试剂盒(IBL公司); 鼠抗人HMGB1、TLR4和NF-κB P65单克隆抗体(均cell signaling-CST公司)。
1.3 方法
1.3.1 标本采集 在分娩前清晨空腹抽取外周肘静脉血2 mL,静置,1 000 r/min离心10 min后分离血清,分装入高压处理后的1.5 mL离心管后置于-70 ℃冰箱保存以备批量待检。胎盘标本均在剖宫产术后娩出胎盘后直视下取近脐带附着处母体面(避开梗死、机化及钙化区)的全层胎盘组织,大小约1.0 cm×1.0 cm×1.0 cm,用0.9%氯化钠注射液反复漂洗后置入10%中性多聚甲醛固定24 h,石蜡包埋,制成2.5 μm厚的切片。
1.3.2 用ELISA检测血清中HMGB1、TLR4和NF-κB P65蛋白浓度:应用美国雷杜酶标仪(RT-6100型)测定样本的A值。在 Curve Expert1.4工作表中,绘制标准曲线:以标准品浓度作横坐标,对应A值作纵坐标,绘制出标准品线性回归曲线,按曲线方程计算各样本浓度值,再乘以2倍数,即为样本浓度。
1.3.3 免疫组织化学检测胎盘中HMGB1、TLR4、NF-κB P65蛋白表达:采用ELISA方法检测血清中HMGB1、TLR4和NF-κB P65蛋白浓度,及免疫组织化学(SP法)检测胎盘HMGB1、TLR4和NF-κB P65蛋白的表达变化及在组织中的定性、定位。光学显微镜下观察各组胎盘组织中HMGB1、TLR4和NF-κB P65的表达。评分标准按Shimizu方法。对每张切片阳性细胞的阳性强度按无着色、淡黄色、棕黄色和棕褐色分别记0、1、2、3分;阳性细胞百分率评分:无阳性细胞0计分, <25% 计1分,25%~50% 计2分,>50% 计3分; 0~2分视为(-),3~6分视为(+)。
1.4 统计学分析
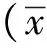
2 结果
2.1 孕妇血清中HMGB1、TLR4和NF-κB P65蛋白浓度
子痫前期组血清HMGB1、TLR4和NF-κB P65含量高于对照组(P<0.05),重度高于轻度患者(P<0.05)(表1)。
2.2 血清NF-κB P65、TLR4及HMGB1的相关性
血清中NF-κB p65表达水平与TLR4存在正相关(P<0.05)(图1A); HMGB1表达水平与TLR4存在呈正相关(P<0.05)(图1B);HMGB1与NF-κB P65存在正相关(P<0.05)(图1C)。
表1 3组血清中HMGB1、TLR4与NF-κB P65含量的比较
*P<0.01 compared with the control group;△P<0.05 compared with the MP group.
2.3 孕妇胎盘组织中HMGB1、TLR4和NF-κB P65蛋白的特点
正常妊娠组HMGB1主要表达于胎盘组织滋养细胞、血管内皮细胞、少量间质细胞的胞核,HMGB1在轻度子痫前期组及重度子痫前期组胎盘组织滋养细胞、血管内皮细胞、少量间质细胞的胞核及胞质表达(图2);TLR4、NF-κB P65蛋白均主要表达于胎盘组织滋养细胞、血管内皮细胞、少量间质细胞的胞质及胞膜(图3,4)。

图1 血清NF-κB P65、TLR4及HMGB1的相关性Fig 1 The correlation among NF-κB P65、TLR4 and HMGB1

A.normal pregnancy group;B.mild preeclampsia group;C.severe preeclampsia group

A.normal pregnancy group;B.mild preeclampsia group;C.severe preeclampsia group

A.normal pregnancy group;B.mild preeclampsia group;C.severe preeclampsia group

groupnHMGB1TLR4NF⁃κBP65-+-+-+control3025(833)5(167)23(767)7(233)26(867)4(133)MP103(333)7(667)∗2(200)8(800)∗2(200)8(800)∗SP204(200)16(800)∗5(250)15(750)∗3(150)17(850)∗
*P<0.05 compared with control.
2.4 孕妇胎盘组织中HMGB1、TLR4和NF-κB P65蛋白的表达变化
子痫前期患者组胎盘HMGB1、TLR4和NF-κB P65蛋白表达均较正常对照组明显增强, (P<0.05) (表2)。
3 讨论
在培养的人微血管内皮细胞中,添加的HMGB1可诱导黏附分子ICAM-l,VCAM- 1的表达以及肿瘤坏死因子,IL- 8,MCP- 1,PAI-l和tPA的释放,增加中性粒细胞黏附,炎性反应,纤溶调节[3]。核蛋白HMGB1一旦释放细胞外就会促进炎性反应,HMGB1通过TLR4信号以氧化还原依赖的方式诱导巨噬细胞产生炎性细胞因子,除了其氧化还原和内源性细胞因子诱导的功能外,HMGB1还可以与某些炎性介质相互作用形成强烈免疫刺激复合物[4]。 收集正常妊娠组和子痫前期组孕妇的血浆和胎盘,子痫前期患者胎盘HMGB1的表达明显高于正常妇女[5];但通过ELISA分析发现,子痫前期患者血浆的HMGB1与正常妇女没有显著差异,这说明由HMGB1引发的炎性反应可能参与了胎盘炎性反应过程。这说明 HMGB1作为炎性危险信号在子痫前期的发生和发展中发挥了重要作用。
TLR4 介导的炎性反应与子痫前期有密切的关系。子痫前期孕妇的滋养层细胞及胎盘组织中 TLR4蛋白的表达比正常孕妇增加,它们认为滋养细胞可通过 TLR4 识别母胎界面的“危险信号”(细菌微生物或内源性损伤相关分子),使母体的细胞因子环境平衡被打破从而导致子痫前期的发生[6],以上研究证明子痫前期与TLR4有关。
NF-κB与细胞因子网络,氧化酶系统等共同参与子痫前期的发病过程。细胞周期因子Dl(cyclinD1)启动子含有2个NF-κB结合位点,激活的NF-κB可启动细胞周期素cyclinDl的转录,由此可能导致滋养细胞异常,异常滋养细胞侵入子宫动脉,使子宫螺旋动脉内皮损伤,最终发展为动脉粥样硬化,胎盘灌流量减少而缺血缺氧[7];本实验结果显示,子痫前期患者血清中HMGB1、TLR4和NF-κB P65的含量较正常组明显升高;且重度子痫前期患者高于轻度子痫前期,提示HMGBl与Toll样受体(TLR4)结合后激活NF-B信号通路。在炎性细胞中,Toll样受体与其配体(HMGB1)相结合后通过募集连接蛋白MyD88,能强烈活化NF-κB信号通路[8]。实验已证实,抗HMGB1抗体能抑制巨噬细胞中 TNF、IL- 6合成[9]。抑制NF-κB核转运等信号途径可起到抗炎效应,这在许多实验性动物身上已得到证实。本实验通过研究 HMGB1、TLR4、NF-κB p65 在子痫前期疾病中的表达特征及相互关系,证实三者在子痫前期疾病的发生机制中发挥了重要作用。通过本实验结果今后可研究如何抑制内源性分子HMGB1的胞外炎性作用及开发有效稳定的HMGB1拮抗剂,为子痫前期治疗研发新靶点。
[1] 钱中清, 曾耀英, 朱斌, 等. 子痫前期患者系统性氧化应激反应的检测[J]. 基础医学与临床,2010, 30: 343- 347.
[2] Andersson U, Tracey KJ. HMGB1 as a mediator of necrosis-induced inflammation and a therapeutic target in arthritis[J]. Rheum Dis Clin North Am, 2004, 30: 627- 637.
[3] Hreggvidsdottir HS, Lundberg AM, Aveberger AC, et al. High mobility group box protein 1 (HMGB1)-partner molecule complexes enhance cytokine production by signaling through the partner molecule receptor[J]. Mol Med, 2012, 18: 224- 230.
[4] Dullne A, O Neill L A. The interleukin- 1 receptor/Toll like receptor supeffamily:signal transduction during inflammation and host defense[J].Sci sTKE, 2003,171:3- 7.
[5] Wang B, Koga K, Osuga Y,etal. High mobility group box 1 (HMGB1) levels in the placenta and in serum in preeclampsia[J]. Am J Reprod Immunol, 2011, 66: 143- 148.
[6] Dunne A, O’Neill LA. The interleukin- 1 receptor/Toll-like receptor superfamily: signal transduction during inflammation and host defense. Science’s STKE: signal transduction knowledge environment,2003,171: re3.
[7] Urbonaviciute V, Furnrohr BG, Meister S,etal. Induction of inflammatory and immune responses by HMGB1-nucleosome complexes: implications for the pathogenesis of SLE[J]. J Exp Med, 2008, 205: 3007- 3018.
[8] Dilly M, Hambruch N, Haeger JD,etal. Epidermal growth factor (EGF) induces motility and upregulates MMP- 9 and TIMP- 1 in bovine trophoblast cells[J]. Mol Reprod Dev, 2010, 77: 622- 629.
[9] Hinz M, Krappmann D, Eichten A,etal. Nuclear factor-kappa B, cancer, and apoptosis[J]. Mol Cell Biol, 2004, 64: 2690- 2698.
新闻点击
含糖加工食品与饮料恐增加心脏病风险
据美国国家科学院学报(PNAS)网站2013-06-18报道,2011年曾有研究指出,女性每日喝两瓶以上含糖饮料可能会增加患心血管疾病的风险,最近又有一项美国德州大学健康科学中心的研究支持这个论点,该研究发现人们通过加工食品及饮料摄取过多的糖份,将使与心脏病相关的风险提高。
研究团队一开始先在动物身上进行临床前试验,之后再在人类病患细胞上进行检测,结果发现葡萄糖代谢产物G6P会对心脏产生伤害,研究主要作者Heinrich Taegtmeyer教授指出,高血压或其它疾病本来就会对心脏造成压力,如果患者又摄取过多的葡萄糖,将只会让心脏的状况更加严重。
研究解释,当人体摄取太多的糖与淀粉,葡萄糖代谢产物G6P就会逐渐形成,进而对心脏造成压力,而光是一分子的G6P就可以使心脏功能出现不正常。现阶段医生只能以给予患者利尿剂控制水分,以及beta阻断剂、ACE抑制剂以降低心脏的压力,使其能较正常运作,但在过去20年都一直没有出现新的治疗方式。
该研究刊载于美国心脏协会期刊(Journal of the American Heart Association)。
Increase of HMGB1, TLR4 and NF-κB in placenta and serum in patients with preeclampsia
WU Jian-bo, WU Xiu-yan, HU Ji-fen*
(Dept. of Obstetrics and Gynecology,the First Hospital of Fujian University,Fuzhou 350005,China)
Objective To evaluate the expression and discussion on high mobility group protein (HMGB1)/toll like receptor 4 (TLR4) and NF-κB possible role in the signaling pathway in preeclampsia. Methods Ten patients with mild preeclampsia(MP), 20 patients with severe preeclampsia(SP) and 30 cases of normal pregnancy were recruited the same period.To check the expression of the HMGB1,TLR4,NF-κB P65 protein in placenta tissue using Immunohistochemical staining.Levels of HMGB1,TLR4,NF-κB P65 in blood serum were measured by ELISA. Results 1)Expression of HMGB1,TLR4,NF-κB P65 were increased as compare to control group(P<0.05); HMGB1,TLR4,NF-κB P65 in placenta of patients with severe preeclampsia and mild preeclampsia failed to show significant difference.2)HMGB1,TLR4,NF-κB P65 in women with preeclampsia was significantly higher than control group(P<0.05); HMGB1,TLR4,NF-κB P65 in women with severe preeclampsia showed a higher level as compared to mild preeclampsia (P<0.05).Conclusions HMGB1,TLR4 and NF-κB P65 were over-expressed in the placenta tissue and serum in patients with preeclampsia, which indicated that HMGB1,TLR4 and NF-κB P65 may play an important role in the development of preeclampsia.
preeclampsia; inflammatory reaction; HMGB1; TLR4; NF-κB P65
2014- 03- 27
2014- 06- 22
福建医科大学教授基金(JS06043); 福建省医科大学青年骨干教师专项基金(JGG201310)
1001-6325(2015)01-0033-05
R714.2
A
*通信作者(corresponding author):

