分子印迹固相萃取-超高效液相色谱-串联质谱法测定猪肉中5种β2-受体激动剂残留
张学亮, 罗云敬*, 姜 洁, 路 勇, 冯 楠
(1.北京工业大学生命科学与生物工程学院,北京100124;2.北京市食品安全监控和风险评估中心,北京100041)
β2-受体激动剂(β2-agonists)是一类人工合成的苯乙醇胺类药物,主要包含克伦特罗、沙丁胺醇、莱克多巴胺等,这类物质的作用包括显著提高动物胴体的瘦肉率、增重和提高饲料转化率[1,2],但对人体有毒害作用。因而,我国农业部等公告[3-6]规定严禁在动物饲料和饮用水等中使用此类药物,在动物源食品中不得检出此类药物,同时给出了部分药物的检测方法。欧盟等西方国家也对食品中部分β2-受体激动剂残留限量做出了规定[7]。
食品中β2-受体激动剂残留的常用检测方法有高效液相色谱法[8,9]、气相色谱-串联质谱法[10]、高效液相色谱-串联质谱法[11]、超高效液相色谱-串联质谱法[12-16]等。分子印迹聚合物(molecularly imprinted polymer,MIP)是人工合成的聚合物,是根据印迹分子定做的,具有特殊的分子结构和官能团,能选择性地识别印迹分子。所以以分子印迹聚合物为固相萃取吸附剂可提高萃取选择性。分子印迹固相萃取也逐渐得到很好的应用[15,16],但是目前国内外尚未见采用分子印迹固相萃取结合液相色谱-串联质谱检测β2-受体激动剂残留的报道。本研究以猪肉为样品基质,在55℃酶解2 h后进行分子印迹固相萃取净化,内标法定量,建立了超高效液相色谱-串联质谱同时检测5种β2-受体激动剂残留的方法。本方法通过减少酶解时间提高了实验效率,而且采用内标法定量和分子印迹固相萃取柱进行净化,进一步提高了方法的准确性。
1 实验部分
1.1 仪器与试剂
UPLC-TQ-S超高效液相色谱-串联四极杆质谱联用仪(美国Waters公司);Milli-Q纯水仪(美国Millipore公司);高速冷冻离心机(美国Sigma公司);电子分析天平(北京赛多利斯仪器系统有限公司)。
苯乙醇胺 A(phenethylamine A)、沙丁胺醇(salbutamol)、沙美特罗(salmeterol)、克伦特罗(clenbuterol)、莱克多巴胺(ractopamine)、d6-沙丁胺醇(d6-salbutamol)、d5-莱克多巴胺(d5-ractopamine)、d6-克伦特罗(d6-clenbuterol)、d3-沙美特罗(d3-salmeterol)、d3-苯乙醇胺 A(d3-phenethylamine A)均购自 Dr.Ehrenstorfer GmbH;纯度均高于98.0%。β-盐酸葡萄糖醛苷酶/芳基硫酸酯酶(30 ku/60 ku)购自默克公司;MIP Beta-Receptors固相萃取柱(25 mg/10 mL)购自美国 SUPELCO
标准储备液的配制:准确称取25 mg的上述标准品,用甲醇溶解在25 mL容量瓶中,配制成1 000 μg/kg的标准储备液,于-18℃保存。
乙酸-乙酸钠缓冲液的配制:称取43.0 g乙酸钠,加入22 mL乙酸,用水溶解并定容到1 000 mL,用乙酸调节pH到5.2。
1.2 样品制备
样品的酶解:准确量取动物性食品样品2 g,置于离心管内,加入1 mg/L的同位素标准溶液20 μL,涡旋混匀,加入 10 mL 0.2 mol/L 乙酸铵缓冲液(pH 5.2)和 100 μL β-葡萄糖醛酸酶/芳基硫酸酯酶,于55℃酶解2 h。酶解液放至室温后,用0.1 mol/L的NaOH溶液调pH至7.0左右,涡旋后于0℃、10 000 r/min下离心10 min,将上清液转入50 mL离心管中,待净化。
样品的净化:MIP柱依次用6 mL乙腈、1 mL水活化,然后提取液上MIP柱,弃去流出液;用3 mL水淋洗,抽真空使柱中的溶液全部流出;再用1 mL乙腈、3 mL 60% (v/v)乙腈水溶液淋洗,抽真空使柱中的溶液全部流出;用2 mL 1%(v/v)甲酸乙腈溶液洗脱,收集洗脱液,浓缩至近干,以流动相复溶后过0.22 μm的有机滤膜,待LC-MS测定。
1.3 色谱条件
色谱柱:Waters ACQUITY UPLC HSS C18(100 mm ×2.1 mm,1.7 μm);流动相:0.1% (v/v)甲酸水溶液(B)/甲醇(A)。梯度洗脱:0~7.0 min,15%A~50%A;7.0~10 min,50%A~99%A;10~13 min,99%A;13.1~16 min,15%A。恒定流速:0.30 mL/min;柱温:40 ℃;进样量:10 μL。
1.4 质谱条件
电喷雾离子源正离子(ESI+)模式;毛细管电压:2.59 kV;离子源温度:150℃;去溶剂气温度:350℃;去溶剂气流量:800 L/h;锥孔气流量:150 L/h;多反应监测模式。10种β2-受体激动剂的质谱分析参数见表1。
2 结果与分析
2.1 色谱与质谱条件的优化
采用超高效液相色谱-串联四极杆质谱分别对5种β2-受体激动剂进行多反应监测扫描,以两对母离子-子离子、保留时间等对这些化合物进行定性、定量。
由于电喷雾质谱的电离是在溶液状态下的电保留时间和峰形外,还会影响分析物的离子化效率,从而影响目标化合物的检测灵敏度。本实验分别采用甲醇、乙腈、甲醇-0.1% (v/v)甲酸水溶液、乙腈-0.1%(v/v)甲酸水溶液作为流动相,考察了流动相组成对各化合物响应值的影响,结果表明甲醇-0.1%(v/v)甲酸水溶液作为流动相时的峰形明显改善,因此以甲醇-0.1%(v/v)甲酸水溶液为流动相。最终得到的5种β2-受体激动剂的总离子流图(total ion chromatogram,TIC)(见图1)。
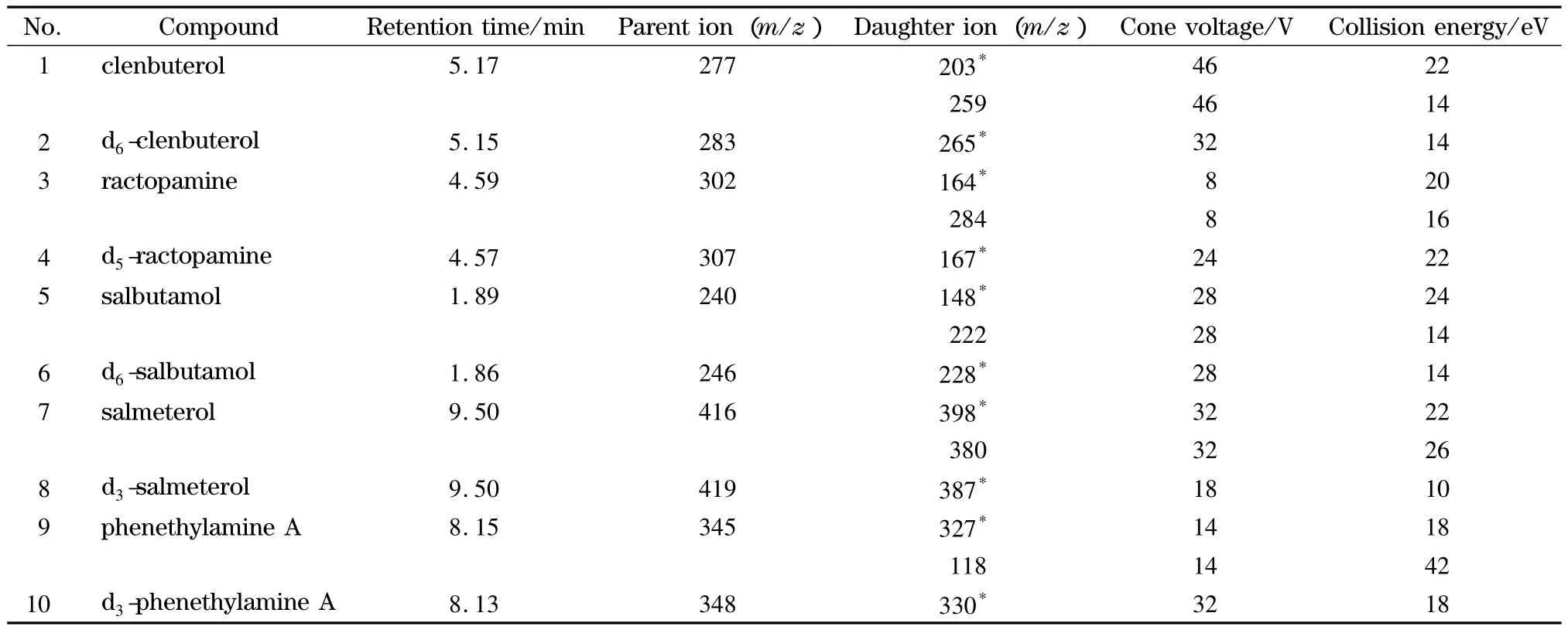
表1 10种化合物的质谱参数Table 1 MS parameters for the ten compounds
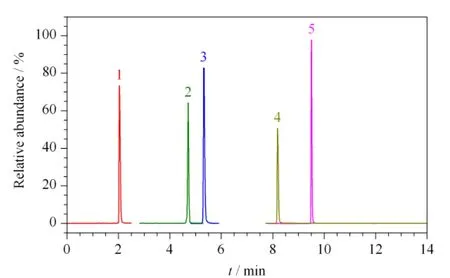
图1 5种化合物的总离子流色谱图Fig.1 Total ion chromatograms(TIC)of the five compounds
2.2 样品前处理方法的优化
食品中β2-受体激动剂检测中前处理方法的关键是选择提取效率好的提取溶剂,以及合理的净化方案,减少目标化合物在样品前处理过程中的损失。王培龙等[10]、胡艳云等[16]已经对提取溶液进行了很好的研究,本文就酶解条件、净化方式等条件进行了优化。
2.2.1 酶解条件的选择
β2-受体激动剂在动物体内代谢过程中,多数会与硫酸酯蛋白和葡萄糖醛酸作用,最终以硫酸轭合物和葡萄糖醛酸轭合物等结合态形式存在,需要将其转化为游离态进行检测,因此采用β-葡萄糖醛苷酶/芳基硫酸酯酶对样品进行酶解。参考Damasceno 等[17]、杨光等[18]对 β-葡萄糖醛苷酶/芳基硫酸酯酶的活性研究,本文比较了55℃下酶解2 h和37℃下酶解16 h的效果。结果如图2所示,因此选择55℃下酶解2 h。在保证效率和回收率的前提下,本方法与王培龙等[10]、胡艳云等[16]方法以及国家标准[6]等酶解方法相比,提高了工作效率。
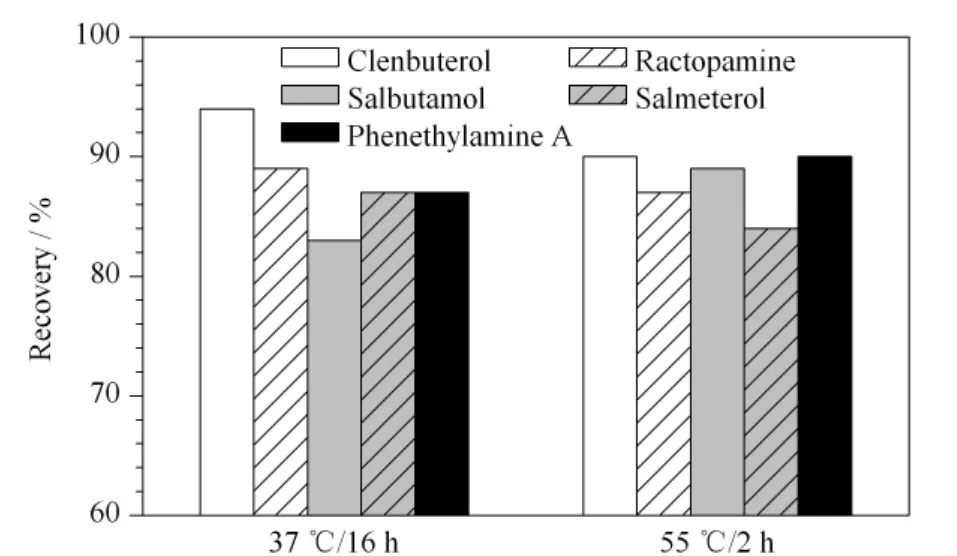
图2 酶解条件对5种β2-受体激动剂回收率的影响Fig.2 Effect of enzyme conditions on the recoveries of the five β2 -agonists
2.2.2 净化条件的优化
实验过程中发现,直接用提取剂提取而不净化时,提取溶液中样品基质干扰物质多,基质效应比较强,同时对色谱柱和仪器的损坏较大。样品基质中主要是大分子蛋白质和脂肪,另外也有小分子的碳水化合物等。实验比较了HLB柱(Waters,6 mL/150 mg,30 μm)、MCX 柱(Waters,6 mL/150 mg,30 μm)、MIP 柱和 DisQuE 净化管 (Waters,15 mL,150 mg PSA、150 mg C18、900 mg MgSO4),以回收率评价提取效果。如图3所示,对于DisQuE净化管、MCX柱、C18柱,由于目标化合物的种类多,极性差异比较大,化合物的保留效果差,损失较大,净化效果不理想;MIP柱作为相对比较专一的交换柱,能够特异性地保留目标化合物,采用低温环境净化(-4℃)和强酸条件也能起到沉淀蛋白质和脂肪的净化作用。所以选择MIP固相萃取柱。
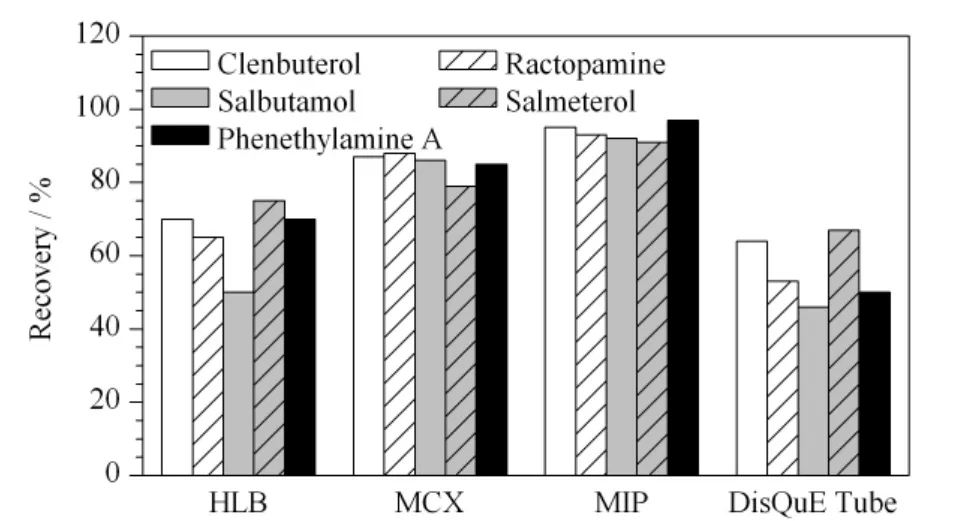
图3 不同净化条件下5种β2-受体激动剂的平均回收率Fig.3 Average recoveries under different purification conditions for the five β2-agonists
2.3 方法的验证
2.3.1 标准曲线和检出限
用阴性样品基质配制 0、0.05、0.1、0.5、1、2、5、10 μg/kg等不同含量的混合标准溶液,同时加入10 μL 1 mg/L的内标物混合液,进行样品前处理和测定。以5种β2-受体激动剂和内标物的响应比值为纵坐标,化合物的含量(单位为μg/kg)为横坐标绘制标准曲线。以信噪比为3确定方法检出限(LOD),信噪比为10确定定量限(LOQ)。5种β2-受体激动剂的线性方程、线性范围、相关系数、检出限和定量限见表2。
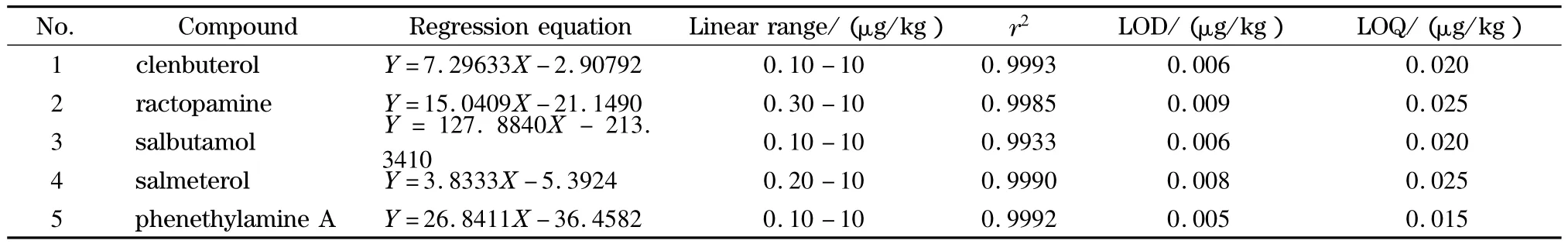
表2 5种β2-受体激动剂的回归方程、线性范围、相关系数(r2)、检出限和定量限Table 2 Regression equations,linear ranges,correlation coefficients (r2),LODs and LOQs of the five β2-agonists
2.3.2 回收率和精密度
如表3所示,在阴性猪肉空白样品中添加低、中、高3 个水平(0.25、1.0、5 μg/kg)的5 种 β2-受体激动剂混合标准溶液,样品前处理后测定目标化合物,每个加标水平进行6次试验。
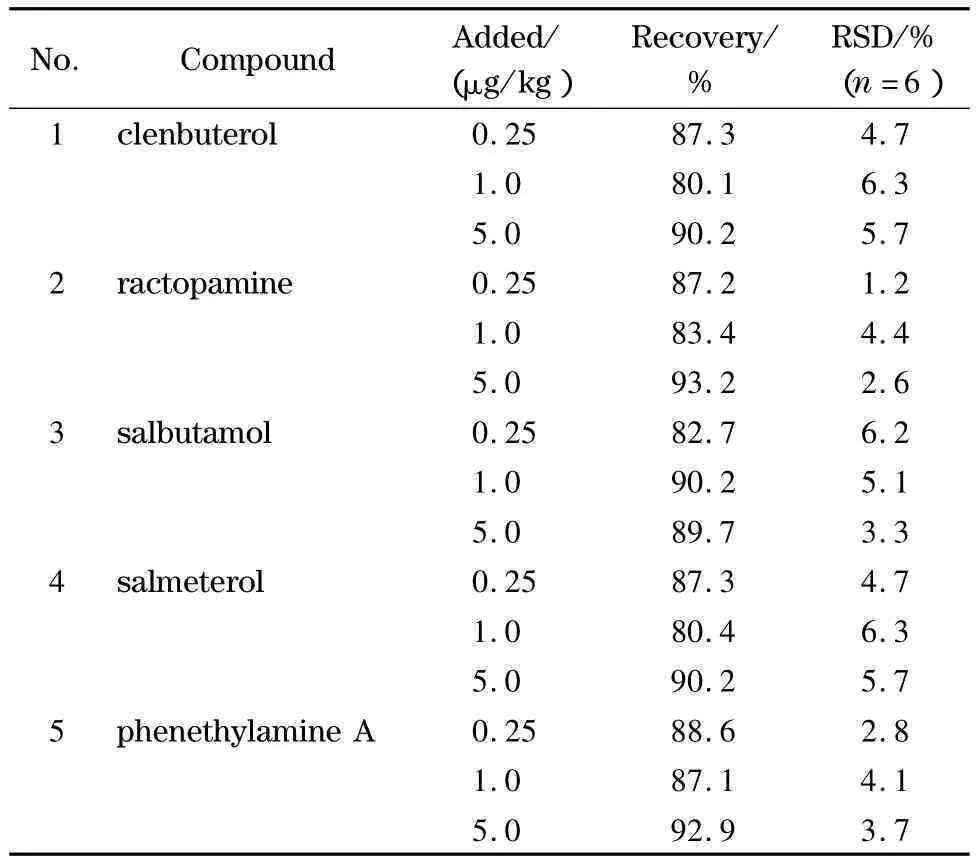
表3 猪肉加标样品中5种β2-受体激动剂的平均回收率和相对标准偏差Table 3 Average recoveries and relative standard deviations ofthe five β2-agonists in spiked pork sample
按照实验室质量控制规范,当空白样品中加标水平低于0.1 mg/kg时,回收率和相对标准偏差的要求分别为60%~120%和0~20%。从表3的结果中可以看出,5种β2-受体激动剂的平均回收率为80.4% ~92.9%,相对标准偏差为1.2% ~6.3%,完全符合要求,方法的重现性和准确度良好,较为可靠。
2.4 实际样品的检测
利用上述方法对不同地区大型超市和市场购买的50份猪肉进行分析,只检出一份猪肉样品中含有0.13 μg/kg 克伦特罗(见图4)。
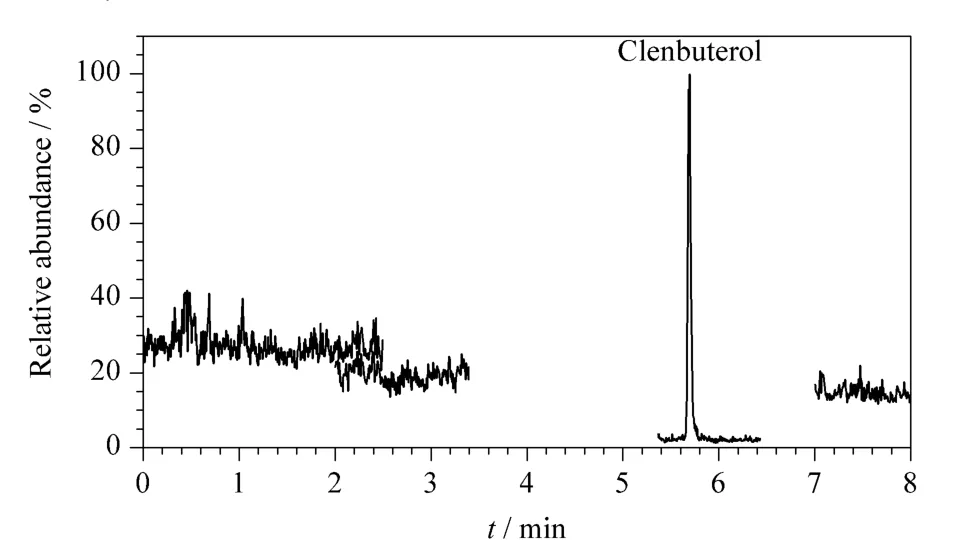
图4 阳性样品的色谱图Fig.4 Chromatogram of a positive sample
3 结论
本研究采用分子印迹固相萃取-超高效液相色谱-串联四极杆质谱技术建立了猪肉中5种β2-受体激动剂残留的同时定量方法。该方法检出限低、回收率高,快速、灵敏、准确,提高了实验效率和准确性,适合同时进行多种β2-受体激动剂残留的测定。
[1] Pan S J,Hancock J,Ding Z,et al.Am J Physiol Endocrinol Metab,2001,280(4):554
[2] Li J S,Qiu Y M,Wang C.Veterinary Residue Analysis.Shanghai:Shanghai Science and Technology Press(李俊琐,邱月明,王超.兽药残留分析.上海:上海科学技术出版社),2002:641
[3] Ministry of Agriculture.No.235 Bulletin of the Ministry of Agriculture of the People’s Republic of China(农业部.中华人民共和国农业部公告第235号).(2002-12-24).http://www. moa. gov. cn/zwllm/nybz/200803/t20080304 _1028649.htm
[4] Drug Medical Device Administration,Animal Husbandry and Veterinary Bureau,Ministry of Agriculture.Chinese Journal of Veterinary Drug(农业部畜牧兽医局药品药械管理处.中国兽药杂志),2003,37(4):6
[5] Bureau of Animal Husbandry of Ministry of Agriculture.Chinese Journal of Veterinary Drug(农业部畜牧局.中国兽药杂志),2003,37(2):7
[6] GB /T 22286-2008
[7] Nielen M W,Lasaroms J J,Essers M L,et al.Anal Bioanal Chem,2008,391(1):199
[8] Li X M,Gao Y,Su X O,et al.Chinese Journal of Analytical Chemistry(李晓敏,高燕,苏晓鸥,等.分析化学),2014,42(12):1779
[9] Huang Y,Zhang Q J,Liu M,et al.Chinese Journal of Chromatography(黄怡,张青杰,刘敏,等.色谱),2012,30(1):56
[10] Wang P L,Fan L,Su X O,et al.Chinese Journal of Analytical Chemistry(王培龙,范理,苏晓鸥,等.分析化学),2012,40(3):470
[11] Cai Q R,Wu J S,Qian Z J,et al.Chinese Journal of Chromatography(蔡勤仁,吴洁珊,钱振杰,等.色谱),2013,31(3):200
[12] Juan C,Igualada C,Moragues F,et al.J Chromatogr A,2010,1217(39):6061
[13] Li Y,Su X O,Wang R G,et al.Chinese Journal of Analytical Chemistry(李阳,苏晓鸥,王瑞国,等.分析化学),2013,41(6):899
[14] Wang X F,Zhao L,Zhang G K,et al.Chinese Journal of Analytical Chemistry(王旭峰,赵丽,张高奎,等.分析化学),2013,41(8):1254
[15] Sun W Y,Zhao B L,Zhang S J,et al.Chinese Journal of Chromatography(孙武勇,赵冰琳,张守杰,等.色谱),2012,30(10):1008
[16] Hu Y Y,Xu H Q,Yao J,et al.Chinese Journal of Analytical Chemistry(胡艳云,徐慧群,姚剑,等.分析化学),2014,42(2):227
[17] Damasceno L,Ventura R,Cardoso J,et al.J Chromatogr B,2002,780(1):61
[18] Yang G,Li Z Q,Li J J.Shandong Journal of Animal Science and Veterinary Medicine(杨光,李振清,李建基.山东畜牧兽医),2004(3):4

